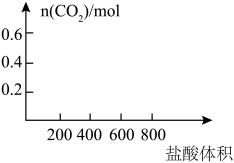
1 . 将35.8gNa2CO3和NaHCO3的固体混合物溶于足量水中,向其中逐滴加入1mol·L-1的盐酸至不再产生气体为止,测得共产生CO28.96L(标准状况)(气体溶解忽略不计)。回答下列问题:
(1)原混合物中Na2CO3为___________ g。
(2)若以滴加盐酸的体积为V(mL),产生气体的物质的量为n(mol),建立n=f(V)的函数关系,将V在不同取值范围时,n=f(V)的关系式填入下表并作图。
___________
(1)原混合物中Na2CO3为
(2)若以滴加盐酸的体积为V(mL),产生气体的物质的量为n(mol),建立n=f(V)的函数关系,将V在不同取值范围时,n=f(V)的关系式填入下表并作图。
| V的取值范围 | n=f(V) |
您最近半年使用:0次
名校
2 . 向某NaOH溶液分别通入不同量的 气体,得到A、B、C三种溶液。分别向这三种溶液中滴入
气体,得到A、B、C三种溶液。分别向这三种溶液中滴入 的盐酸,得到的气体变化如图。则:
的盐酸,得到的气体变化如图。则:_____ ;
(2)C溶液中有两种溶质,除去其中碱性强的溶质的方法为:_____ 。
(3)B溶液中原有的NaOH的物质的量为_____ 。
 气体,得到A、B、C三种溶液。分别向这三种溶液中滴入
气体,得到A、B、C三种溶液。分别向这三种溶液中滴入 的盐酸,得到的气体变化如图。则:
的盐酸,得到的气体变化如图。则: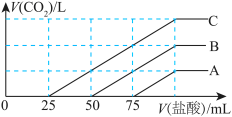
(2)C溶液中有两种溶质,除去其中碱性强的溶质的方法为:
(3)B溶液中原有的NaOH的物质的量为
您最近半年使用:0次
解题方法
3 . 某种天然碱样品的化学式可以用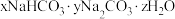 表示(式中x、y、z是最简整数比)。取50g某一浓度的盐酸与3.32g样品充分反应,能生成
表示(式中x、y、z是最简整数比)。取50g某一浓度的盐酸与3.32g样品充分反应,能生成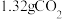 气体。
气体。
(1)若改用1.66g样品与50g这种盐酸反应,能生成
 ?
?(2)另取3.32g样品在300℃下加热至完全分解(已知
 在300℃时不会分解),能产生
在300℃时不会分解),能产生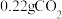 和
和 ,试确定该样品的化学式
,试确定该样品的化学式(3)写出这种天然碱与盐酸完全反应的化学方程式:
 最多,求该盐酸中溶质质量分数
最多,求该盐酸中溶质质量分数
您最近半年使用:0次
4 . 在100mL稀盐酸中加入混合均匀的 和
和 固体粉末,充分反应后使气体全部逸出。下图是加入粉末的质量与产生
固体粉末,充分反应后使气体全部逸出。下图是加入粉末的质量与产生 (该状况下,气体的密度为
(该状况下,气体的密度为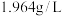 )体积的关系。请计算:
)体积的关系。请计算:
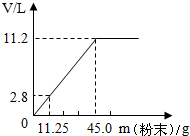
(1)该盐酸中HCl的质量为___________ 。
(2)若该盐酸为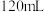 时,加入粉末为
时,加入粉末为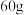 ,产生
,产生 的体积为
的体积为___________ 。
(3)若粉末的质量为 ,该盐酸的体积为
,该盐酸的体积为 ,产生的
,产生的 体积为
体积为 。试写出粉末质量
。试写出粉末质量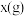 与产生
与产生 体积
体积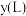 之间的关系:
之间的关系:___________ 。
 和
和 固体粉末,充分反应后使气体全部逸出。下图是加入粉末的质量与产生
固体粉末,充分反应后使气体全部逸出。下图是加入粉末的质量与产生 (该状况下,气体的密度为
(该状况下,气体的密度为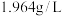 )体积的关系。请计算:
)体积的关系。请计算:
(1)该盐酸中HCl的质量为
(2)若该盐酸为
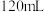 时,加入粉末为
时,加入粉末为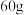 ,产生
,产生 的体积为
的体积为(3)若粉末的质量为
 ,该盐酸的体积为
,该盐酸的体积为 ,产生的
,产生的 体积为
体积为 。试写出粉末质量
。试写出粉末质量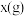 与产生
与产生 体积
体积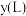 之间的关系:
之间的关系:
您最近半年使用:0次
5 . 某碳酸钠( )固体样品中含有少量
)固体样品中含有少量 杂质。小组同学用不同的方案测定样品中碳酸钠的纯度。
杂质。小组同学用不同的方案测定样品中碳酸钠的纯度。
已知:碳酸钠的纯度 。
。
(1)方案1:
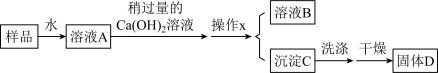
①操作x的名称是_______ 。
②溶液B中所含的金属阳离子有_______ 。
③该方案中,需测量的物理量有_______ 。
(2)方案2:利用如下图所示装置进行实验,通过测量样品与稀硫酸反应产生的二氧化碳的体积,计算样品中碳酸钠的纯度。
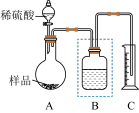
为了提高测量的准确性,B中试剂的选择依据是_______ 。
(3)方案3:称量mg样品,并使其充分加热,冷却至室温,再称量固体质量为ng。则样品中碳酸钠的纯度=_______ (用代数式表示)。[已知: ,
, ]
]
 )固体样品中含有少量
)固体样品中含有少量 杂质。小组同学用不同的方案测定样品中碳酸钠的纯度。
杂质。小组同学用不同的方案测定样品中碳酸钠的纯度。已知:碳酸钠的纯度
 。
。(1)方案1:

①操作x的名称是
②溶液B中所含的金属阳离子有
③该方案中,需测量的物理量有
(2)方案2:利用如下图所示装置进行实验,通过测量样品与稀硫酸反应产生的二氧化碳的体积,计算样品中碳酸钠的纯度。

为了提高测量的准确性,B中试剂的选择依据是
(3)方案3:称量mg样品,并使其充分加热,冷却至室温,再称量固体质量为ng。则样品中碳酸钠的纯度=
 ,
, ]
]
您最近半年使用:0次
6 . 现有Na2CO3和NaHCO3的混合物共48.6g,加入足量盐酸时放出11.2L(标准状况)CO2,请求出:
(1)产生二氧化碳的物质的量是___________ ;
(2)混合物中Na2CO3和NaHCO3的物质的量之比为___________ 。
(1)产生二氧化碳的物质的量是
(2)混合物中Na2CO3和NaHCO3的物质的量之比为
您最近半年使用:0次
名校
解题方法
7 . 将Na2CO3和NaHCO3的混合物充分加热,生成的气体(假设无损耗)全部通入足量的石灰水中,得到20.0g白色沉淀,加热后的残留物加入200mL盐酸恰好完全反应,生成5.60LCO2气体(标准状况下)。试回答下列问题:
(1)所加盐酸的物质的量浓度为_______ mol/L。
(2)原混合物中碳酸钠的质量是_______ g。
(1)所加盐酸的物质的量浓度为
(2)原混合物中碳酸钠的质量是
您最近半年使用:0次
名校
解题方法
8 . 金属钠及其化合物在人类生产生活中起着重要作用。回答下列问题:
(1)存贮时,Na应保存在___________ 中;实验室取用少量金属钠需要用到的实验用品有玻璃片、小刀、___________ 和___________ 等。
(2)工业上采用电解熔融NaCl(熔点为 )制备金属Na,电解反应方程式:
)制备金属Na,电解反应方程式: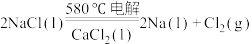 ,加入
,加入 的目的是
的目的是___________ (填序号)。
a.作催化剂,加块电解反应的速率
b.作还原剂,将 还原为
还原为
c.作助熔剂,降低生产过程的能耗
d.作氧化剂,将 氧化为
氧化为
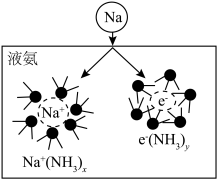
(3)钠能与液氨反应,生成氨基钠(NaNH2)和一种气体单质。将钠投入液氨中,会快速得到深蓝色溶液(生成蓝色的溶剂合电子,如图所示),后慢慢产生气泡。
①生成的气体为___________ (填分子式)
②当 钠投入液氨生成
钠投入液氨生成 气体时,Na共失去的电子
气体时,Na共失去的电子___________  (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
(4)采用空气和Na为原料可直接制备Na2O2。为防止空气中的某些成分与Na2O2反应,空气与熔融金属Na反应前需依次通过___________ 。(填序号)
a.无水 b.饱和食盐水 c.饱和
b.饱和食盐水 c.饱和 溶液 d.
溶液 d. 溶液 e.
溶液 e. 溶液
溶液
(5)对固体 充分加热,产生的气体先通过足量浓硫酸,再通过足量Na2O2,Na2O2增重0.28g,则固体
充分加热,产生的气体先通过足量浓硫酸,再通过足量Na2O2,Na2O2增重0.28g,则固体 的质量为
的质量为___________ g。
(6)为确定 和
和 混合物样品的组成,称取四份该样品溶于水后分别逐滴加入相同浓度的稀盐酸
混合物样品的组成,称取四份该样品溶于水后分别逐滴加入相同浓度的稀盐酸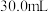 ,充分反应,产生
,充分反应,产生 的体积(已折算成标准状况下的体积,不考虑
的体积(已折算成标准状况下的体积,不考虑 在水中的溶解)如下表:
在水中的溶解)如下表:
①样品中物质的量之比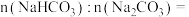
___________ 。
②稀盐酸的物质的量浓度
___________ mol/L。
(1)存贮时,Na应保存在
(2)工业上采用电解熔融NaCl(熔点为
 )制备金属Na,电解反应方程式:
)制备金属Na,电解反应方程式: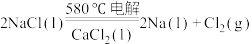 ,加入
,加入 的目的是
的目的是a.作催化剂,加块电解反应的速率
b.作还原剂,将
 还原为
还原为
c.作助熔剂,降低生产过程的能耗
d.作氧化剂,将
 氧化为
氧化为
(3)钠能与液氨反应,生成氨基钠(NaNH2)和一种气体单质。将钠投入液氨中,会快速得到深蓝色溶液(生成蓝色的溶剂合电子,如图所示),后慢慢产生气泡。

①生成的气体为
②当
 钠投入液氨生成
钠投入液氨生成 气体时,Na共失去的电子
气体时,Na共失去的电子 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)(4)采用空气和Na为原料可直接制备Na2O2。为防止空气中的某些成分与Na2O2反应,空气与熔融金属Na反应前需依次通过
a.无水
 b.饱和食盐水 c.饱和
b.饱和食盐水 c.饱和 溶液 d.
溶液 d. 溶液 e.
溶液 e. 溶液
溶液(5)对固体
 充分加热,产生的气体先通过足量浓硫酸,再通过足量Na2O2,Na2O2增重0.28g,则固体
充分加热,产生的气体先通过足量浓硫酸,再通过足量Na2O2,Na2O2增重0.28g,则固体 的质量为
的质量为(6)为确定
 和
和 混合物样品的组成,称取四份该样品溶于水后分别逐滴加入相同浓度的稀盐酸
混合物样品的组成,称取四份该样品溶于水后分别逐滴加入相同浓度的稀盐酸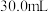 ,充分反应,产生
,充分反应,产生 的体积(已折算成标准状况下的体积,不考虑
的体积(已折算成标准状况下的体积,不考虑 在水中的溶解)如下表:
在水中的溶解)如下表:| 实验序号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| 盐酸体积(mL) | 30.0 | 30.0 | 30.0 | 30.0 |
| 样品质量(g) | 2.96 | 3.70 | 5.18 | 6.66 |
 体积(mL) 体积(mL) | 672 | 840 | 896 | 672 |
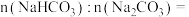
②稀盐酸的物质的量浓度

您最近半年使用:0次
解题方法
9 . Ⅰ.回答下列问题
(1)6.02×1023个CO2与______ mol H2的质量相等。
(2)含0.4 mol Cl-的氯化镁是______ mol,质量是______ g。
(3)4 mol Na2CO3与______ mol Na2SO4所含氧原子数相等。
(4)8 g甲烷(CH4)是______ mol,含______ 个甲烷分子。
(5)相同质量的SO2和SO3的物质的量之比为______ 。
(6)在一密闭容器中充入a mol NO和b mol O2,可发生如下反应:2NO+O2=2NO2,充分反应后容器中氮原子和氧原子的个数之比为______ 。
Ⅱ.向100mLNaOH溶液中通入一定量CO2,充分反应后,得到Na2CO3和NaHCO3的混合溶液。向上述所得溶液中,逐滴滴加2mol·L-1的盐酸,所得气体的体积与所加盐酸体积的关系如图所示。
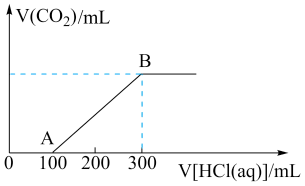
(7)①OA段发生反应的离子方程式为______ 。
②混合溶液中Na2CO3和NaHCO3的物质的量之比为______ 。
(1)6.02×1023个CO2与
(2)含0.4 mol Cl-的氯化镁是
(3)4 mol Na2CO3与
(4)8 g甲烷(CH4)是
(5)相同质量的SO2和SO3的物质的量之比为
(6)在一密闭容器中充入a mol NO和b mol O2,可发生如下反应:2NO+O2=2NO2,充分反应后容器中氮原子和氧原子的个数之比为
Ⅱ.向100mLNaOH溶液中通入一定量CO2,充分反应后,得到Na2CO3和NaHCO3的混合溶液。向上述所得溶液中,逐滴滴加2mol·L-1的盐酸,所得气体的体积与所加盐酸体积的关系如图所示。

(7)①OA段发生反应的离子方程式为
②混合溶液中Na2CO3和NaHCO3的物质的量之比为
您最近半年使用:0次
解题方法
10 . 将一定量的CO2通入20mL未知浓度的NaOH溶液中,在所得的溶液中逐滴加入0.lmol/L稀盐酸至过量,并将溶液加热,产生的气体的体积与加入稀盐酸的体积关系如图所示(忽略气体的溶解和盐酸的挥发)。
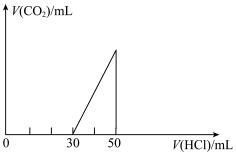
(1)原NaOH溶液的物质的量浓度___________ mol/L。
(2)当30mL<V<50ml时,溶液中发生反应的离子方程式___________ 。
(3)标准状况下,通入CO2的体积为___________ 。

(1)原NaOH溶液的物质的量浓度
(2)当30mL<V<50ml时,溶液中发生反应的离子方程式
(3)标准状况下,通入CO2的体积为
您最近半年使用:0次



