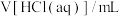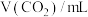解题方法
1 . 将一定量的CO2通入20mL未知浓度的NaOH溶液中,在所得的溶液中逐滴加入0.lmol/L稀盐酸至过量,并将溶液加热,产生的气体的体积与加入稀盐酸的体积关系如图所示(忽略气体的溶解和盐酸的挥发)。
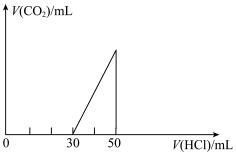
(1)原NaOH溶液的物质的量浓度___________ mol/L。
(2)当30mL<V<50ml时,溶液中发生反应的离子方程式___________ 。
(3)标准状况下,通入CO2的体积为___________ 。

(1)原NaOH溶液的物质的量浓度
(2)当30mL<V<50ml时,溶液中发生反应的离子方程式
(3)标准状况下,通入CO2的体积为
您最近一年使用:0次
解题方法
2 . 加热纯碱和小苏打的混合物54.8g,至质量不再变化时,冷却后称量其固体质量是42.4g,求:
(1)原混合物中纯碱的物质的量___________ mol。
(2)将此混合物与4mol/L的盐酸充分反应放出CO2,需要盐酸的体积至少___________ mL。
(1)原混合物中纯碱的物质的量
(2)将此混合物与4mol/L的盐酸充分反应放出CO2,需要盐酸的体积至少
您最近一年使用:0次
3 . 某干燥白色固体可能含有 、
、 、
、 中的几种,取一定质量的该固体加蒸馏水配制
中的几种,取一定质量的该固体加蒸馏水配制 溶液,并向该溶液中滴加
溶液,并向该溶液中滴加 的盐酸,得到
的盐酸,得到 体积(标准状况下)与盐酸体积的关系如图所示。回答下列问题:
体积(标准状况下)与盐酸体积的关系如图所示。回答下列问题:
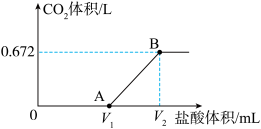
(1)产生的 的物质的量为
的物质的量为______________  ,
, 段反应的离子方程式为
段反应的离子方程式为____________________ 。
(2)若白色固体由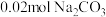 和
和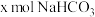 组成,则
组成,则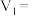
___________ ,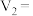
___________ 。
(3)若白色固体由 和
和 组成,
组成, ,则
,则 与
与 溶于水后发生反应的离子方程式为
溶于水后发生反应的离子方程式为_______________________________ ,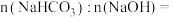
_________________ 。
(4)若白色固体只由 和
和 组成,且
组成,且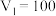 ,
, ,则
,则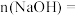
__________  ,原
,原 溶液中的
溶液中的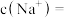
_______________  。
。
(5)另取某 和
和 组成的混合物样品,称取3份该样品溶于水后分别逐滴加入相同浓度盐酸
组成的混合物样品,称取3份该样品溶于水后分别逐滴加入相同浓度盐酸 ,充分反应,产生
,充分反应,产生 的体积如下表(标准状况下,且不考虑
的体积如下表(标准状况下,且不考虑 在水中的溶解):
在水中的溶解):
样品中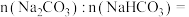
__________________ ,盐酸的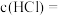
_______________  。
。
 、
、 、
、 中的几种,取一定质量的该固体加蒸馏水配制
中的几种,取一定质量的该固体加蒸馏水配制 溶液,并向该溶液中滴加
溶液,并向该溶液中滴加 的盐酸,得到
的盐酸,得到 体积(标准状况下)与盐酸体积的关系如图所示。回答下列问题:
体积(标准状况下)与盐酸体积的关系如图所示。回答下列问题:
(1)产生的
 的物质的量为
的物质的量为 ,
, 段反应的离子方程式为
段反应的离子方程式为(2)若白色固体由
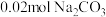 和
和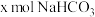 组成,则
组成,则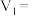
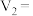
(3)若白色固体由
 和
和 组成,
组成, ,则
,则 与
与 溶于水后发生反应的离子方程式为
溶于水后发生反应的离子方程式为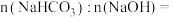
(4)若白色固体只由
 和
和 组成,且
组成,且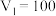 ,
, ,则
,则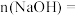
 ,原
,原 溶液中的
溶液中的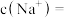
 。
。(5)另取某
 和
和 组成的混合物样品,称取3份该样品溶于水后分别逐滴加入相同浓度盐酸
组成的混合物样品,称取3份该样品溶于水后分别逐滴加入相同浓度盐酸 ,充分反应,产生
,充分反应,产生 的体积如下表(标准状况下,且不考虑
的体积如下表(标准状况下,且不考虑 在水中的溶解):
在水中的溶解):实验序号 | ① | ② | ③ |
| 100.0 | 100.0 | 100.0 |
| 3.80 | 7.60 | 11.40 |
| 896 | 1344 | 896 |
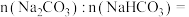
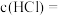
 。
。
您最近一年使用:0次
名校
4 . 将Na2CO3和NaHCO3的混合物3.27 g加热到质量不再减轻时,测得残留固体2.65 g。另取相同质量的此混合物固体,跟 100 mL某浓度的盐酸刚好完全反应生成NaCl,求;
(1)此混合物中NaHCO3与Na2CO3的物质的量之比为______________ ;
(2)所用盐酸的物质的量浓度为______________ ;
(3)生成CO2在标准状况下的体积为______________ 。
(1)此混合物中NaHCO3与Na2CO3的物质的量之比为
(2)所用盐酸的物质的量浓度为
(3)生成CO2在标准状况下的体积为
您最近一年使用:0次
2024-01-10更新
|
115次组卷
|
2卷引用:江苏省常州市溧阳中学2023-2024学年高一上学期阶段性调研测试化学试题
解题方法
5 . 实验室用100mL未知浓度的NaOH溶液捕获 ,充分反应后,再向所得溶液中逐滴加入
,充分反应后,再向所得溶液中逐滴加入 的盐酸,生成
的盐酸,生成 体积(标准状况)与所加盐酸体积间的关系如下图所示(假设生成的
体积(标准状况)与所加盐酸体积间的关系如下图所示(假设生成的 气体全部逸出)。
气体全部逸出)。
(1)当 时,溶液中发生的离子方程式:
时,溶液中发生的离子方程式:___________ 。
(2)捕获 的体积为
的体积为_____ L(标准状况)。
(3)原NaOH溶液的物质的量浓度为______  。
。
 ,充分反应后,再向所得溶液中逐滴加入
,充分反应后,再向所得溶液中逐滴加入 的盐酸,生成
的盐酸,生成 体积(标准状况)与所加盐酸体积间的关系如下图所示(假设生成的
体积(标准状况)与所加盐酸体积间的关系如下图所示(假设生成的 气体全部逸出)。
气体全部逸出)。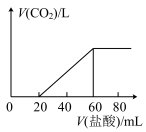
(1)当
 时,溶液中发生的离子方程式:
时,溶液中发生的离子方程式:(2)捕获
 的体积为
的体积为(3)原NaOH溶液的物质的量浓度为
 。
。
您最近一年使用:0次
名校
6 . 研究钠及其化合物的性质有重要的意义。
(1)金属钠非常活泼,通常保存在___________ 中,以隔绝空气。
(2)汽车安全气囊内装有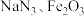 和
和 等物质。
等物质。
①当汽车发生严重碰撞时,引发 分解:
分解: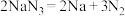 ,
, 中存在的化学键为
中存在的化学键为___________ ;若安全气囊内有 ,其完全分解所释放的
,其完全分解所释放的 在标准状况下的体积为
在标准状况下的体积为___________ L。
②产生的Na立即与 发生置换反应生成
发生置换反应生成 ,其中还原产物是
,其中还原产物是___________ 。
(3)某同学向 和
和 的混合液中逐滴加入一定浓度的盐酸,生成CO2的体积(标准状况)与加入盐酸的体积的关系如图所示。
的混合液中逐滴加入一定浓度的盐酸,生成CO2的体积(标准状况)与加入盐酸的体积的关系如图所示。
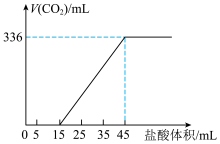
①混合液中
___________ 。
②盐酸的物质的量浓度为___________ 。
(1)金属钠非常活泼,通常保存在
(2)汽车安全气囊内装有
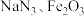 和
和 等物质。
等物质。①当汽车发生严重碰撞时,引发
 分解:
分解: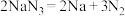 ,
, 中存在的化学键为
中存在的化学键为 ,其完全分解所释放的
,其完全分解所释放的 在标准状况下的体积为
在标准状况下的体积为②产生的Na立即与
 发生置换反应生成
发生置换反应生成 ,其中还原产物是
,其中还原产物是(3)某同学向
 和
和 的混合液中逐滴加入一定浓度的盐酸,生成CO2的体积(标准状况)与加入盐酸的体积的关系如图所示。
的混合液中逐滴加入一定浓度的盐酸,生成CO2的体积(标准状况)与加入盐酸的体积的关系如图所示。
①混合液中

②盐酸的物质的量浓度为
您最近一年使用:0次
名校
解题方法
7 . 某兴趣小组的同学模拟侯德榜制碱法制取纯碱,流程如图:

(1)向饱和NaCl溶液中通入 和氨气时,应先通入
和氨气时,应先通入___________ (填化学式)。操作①的名称为___________ 。
(2)写出反应①的化学方程式:___________ 。
(3)该流程中可循环利用的物质是___________ (填化学式)。
(4)现将 和
和 的固体均匀混合分成两等份。第一份充分加热至恒重,固体质量减少6.2g;第二份与足量稀盐酸充分反应后,加热、蒸干,得到固体23.4g。则混合物中
的固体均匀混合分成两等份。第一份充分加热至恒重,固体质量减少6.2g;第二份与足量稀盐酸充分反应后,加热、蒸干,得到固体23.4g。则混合物中 和
和 的物质的量之比为
的物质的量之比为___________ 。
(5)下列选项中哪种方法可以鉴别 溶液和
溶液和 溶液___________。
溶液___________。
(6)下列实验方案中,不能测定出 和
和 的混合物中
的混合物中 质量分数的是_______。
质量分数的是_______。
(7)钠是一种典型的碱金属元素,下列性质的递变规律正确,且能作为碱金属元素金属性递变规律判断依据的是___________(填字母)。

(1)向饱和NaCl溶液中通入
 和氨气时,应先通入
和氨气时,应先通入(2)写出反应①的化学方程式:
(3)该流程中可循环利用的物质是
(4)现将
 和
和 的固体均匀混合分成两等份。第一份充分加热至恒重,固体质量减少6.2g;第二份与足量稀盐酸充分反应后,加热、蒸干,得到固体23.4g。则混合物中
的固体均匀混合分成两等份。第一份充分加热至恒重,固体质量减少6.2g;第二份与足量稀盐酸充分反应后,加热、蒸干,得到固体23.4g。则混合物中 和
和 的物质的量之比为
的物质的量之比为(5)下列选项中哪种方法可以鉴别
 溶液和
溶液和 溶液___________。
溶液___________。| A.加入澄清石灰水 | B.加入氢氧化钠溶液 |
| C.加热 | D.逐滴加入稀盐酸 |
(6)下列实验方案中,不能测定出
 和
和 的混合物中
的混合物中 质量分数的是_______。
质量分数的是_______。| A.取ag混合物充分加热,质量减少bg |
| B.取ag混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得到bg固体 |
| C.取ag混合物与足量NaOH溶液充分反应,得到bg溶液 |
| D.取ag混合物与足量稀硫酸充分反应,逸出气体经干燥后用碱石灰吸收,质量增加bg |
(7)钠是一种典型的碱金属元素,下列性质的递变规律正确,且能作为碱金属元素金属性递变规律判断依据的是___________(填字母)。
| A.Li、Na、K的原子半径和密度都随原子序数的增加而增大 |
B.碱性: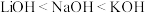 |
C.还原性: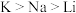 ,故K可以从NaCl溶液中置换出金属钠 ,故K可以从NaCl溶液中置换出金属钠 |
D.熔、沸点: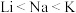 |
您最近一年使用:0次
2023-12-23更新
|
142次组卷
|
3卷引用:湖南省长沙市南雅中学2023-2024学年高一上学期第三次12月月考化学试卷
解题方法
8 . 取5.48g Na2CO3和NaHCO3的固体混合物,分成两等份。
(1)将其中一份固体混合物加水溶解配成100mL溶液。当向溶液中加入300mLBa(OH)2溶液时,恰好使生成白色沉淀的量最多,测得反应后溶液的c(OH-)=0.100 mol∙L-1 (混合溶液体积改变忽略不计)。则原混合物中n(Na2CO3):n(NaHCO3)=___________ 。
(2)将另一份固体混合物充分加热。写出加热时发生反应的化学方程式___________ 。充分加热后的固体溶于水配成100mL溶液,则c(Na+)=___________ mol∙L-1。
(1)将其中一份固体混合物加水溶解配成100mL溶液。当向溶液中加入300mLBa(OH)2溶液时,恰好使生成白色沉淀的量最多,测得反应后溶液的c(OH-)=0.100 mol∙L-1 (混合溶液体积改变忽略不计)。则原混合物中n(Na2CO3):n(NaHCO3)=
(2)将另一份固体混合物充分加热。写出加热时发生反应的化学方程式
您最近一年使用:0次
解题方法
9 . 金属钠及其化合物在人类生产生活中起着重要作用。回答下列问题:
(1)用空气和 可直接制备
可直接制备 。空气与熔融
。空气与熔融 反应前需依次通过填
反应前需依次通过填_______ 、_______ (填标号)
a.浓硫酸 b.饱和食盐水 c. 溶液 d.
溶液 d. 溶液
溶液
(2)将 和
和 的混合物置于真空密闭容器中加热,充分反应后经检测气体产物为
的混合物置于真空密闭容器中加热,充分反应后经检测气体产物为 和水蒸气,其总质量为33g,冷却至标准状况下的体积为16.8L。则剩余固体的成分为
和水蒸气,其总质量为33g,冷却至标准状况下的体积为16.8L。则剩余固体的成分为_______ ,其物质的量之比为_______ ,原混合物中 的质量为
的质量为_______ 。
(3)为探究 的某些化学性质进行如下实验:向锥形瓶内加入饱和
的某些化学性质进行如下实验:向锥形瓶内加入饱和 溶液,用
溶液,用 传感器测定密闭装置中
传感器测定密闭装置中 分压(
分压( 的分压
的分压 气体总压强),测得
气体总压强),测得 分压与温度的变化关系如图所示。温度在50℃之前,装置中
分压与温度的变化关系如图所示。温度在50℃之前,装置中 分压增大的主要原因是
分压增大的主要原因是_______ ;温度升高到50℃之后,装置中 分压急剧增大的原因是
分压急剧增大的原因是_______ 。

(1)用空气和
 可直接制备
可直接制备 。空气与熔融
。空气与熔融 反应前需依次通过填
反应前需依次通过填a.浓硫酸 b.饱和食盐水 c.
 溶液 d.
溶液 d. 溶液
溶液(2)将
 和
和 的混合物置于真空密闭容器中加热,充分反应后经检测气体产物为
的混合物置于真空密闭容器中加热,充分反应后经检测气体产物为 和水蒸气,其总质量为33g,冷却至标准状况下的体积为16.8L。则剩余固体的成分为
和水蒸气,其总质量为33g,冷却至标准状况下的体积为16.8L。则剩余固体的成分为 的质量为
的质量为(3)为探究
 的某些化学性质进行如下实验:向锥形瓶内加入饱和
的某些化学性质进行如下实验:向锥形瓶内加入饱和 溶液,用
溶液,用 传感器测定密闭装置中
传感器测定密闭装置中 分压(
分压( 的分压
的分压 气体总压强),测得
气体总压强),测得 分压与温度的变化关系如图所示。温度在50℃之前,装置中
分压与温度的变化关系如图所示。温度在50℃之前,装置中 分压增大的主要原因是
分压增大的主要原因是 分压急剧增大的原因是
分压急剧增大的原因是
您最近一年使用:0次
名校
解题方法
10 . 钠是活泼的碱金属元素,钠及其化合物在生产和生活中有广泛的应用。
(1)将2.6g CO和0.3g 在足量的氧气中充分燃烧,使生成的
在足量的氧气中充分燃烧,使生成的 和水蒸气通过过量的过氧化钠,上述反应完成后,固体的质量增加了
和水蒸气通过过量的过氧化钠,上述反应完成后,固体的质量增加了___________ g。
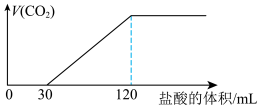
(2)向KOH溶液中通入一定量的 ,再继续向溶液中逐滴加入稀盐酸,标准状况下产生的
,再继续向溶液中逐滴加入稀盐酸,标准状况下产生的 气体体积与所加的盐酸溶液体积之间的关系如图所示,则原KOH溶液中通入
气体体积与所加的盐酸溶液体积之间的关系如图所示,则原KOH溶液中通入 后,所得溶液中的溶质为
后,所得溶液中的溶质为___________ (写化学式)。其对应的物质的量浓度之比为___________ 。
(3)我国化学家侯德榜发明的“联合制碱法”为世界制碱工业做出了巨大贡献,下图为联合制碱法的主要过程(部分物质已略去)。
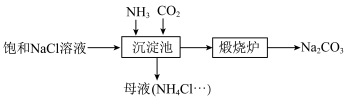
已知:ⅰ. 极易溶于水并生成碱,与酸反应生成盐,如
极易溶于水并生成碱,与酸反应生成盐,如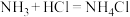 。
。
ⅱ.有关物质的溶解度(20℃)
则沉淀池中主要沉淀物___________ (化学式),发生反应的离子方程式为___________ 。
(1)将2.6g CO和0.3g
 在足量的氧气中充分燃烧,使生成的
在足量的氧气中充分燃烧,使生成的 和水蒸气通过过量的过氧化钠,上述反应完成后,固体的质量增加了
和水蒸气通过过量的过氧化钠,上述反应完成后,固体的质量增加了(2)向KOH溶液中通入一定量的
 ,再继续向溶液中逐滴加入稀盐酸,标准状况下产生的
,再继续向溶液中逐滴加入稀盐酸,标准状况下产生的 气体体积与所加的盐酸溶液体积之间的关系如图所示,则原KOH溶液中通入
气体体积与所加的盐酸溶液体积之间的关系如图所示,则原KOH溶液中通入 后,所得溶液中的溶质为
后,所得溶液中的溶质为
(3)我国化学家侯德榜发明的“联合制碱法”为世界制碱工业做出了巨大贡献,下图为联合制碱法的主要过程(部分物质已略去)。

已知:ⅰ.
 极易溶于水并生成碱,与酸反应生成盐,如
极易溶于水并生成碱,与酸反应生成盐,如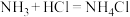 。
。ⅱ.有关物质的溶解度(20℃)
| 物质 | NaCl |  |  |  |
| 溶解度/g | 36.0 | 21.7 | 9.6 | 37.2 |
您最近一年使用:0次