名校
解题方法
1 . 纯碱是重要的生活用碱和化工原料,用途广泛。请同学们按要求回答问题。
Ⅰ.纯碱生产:我国化学家侯德榜改革国外的纯碱生产工艺,其生产流程可简要表示如下。
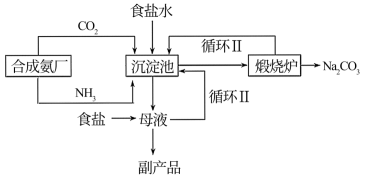
(1)请写出煅烧炉中发生反应的化学方程式:___________ 。
(2)侯氏制碱的创新之处:根据NH4Cl在常温时的溶解度比NaCl大,而在低温下却比NaCl溶解度小的原理,在5℃~10℃时,向母液中加入食盐细粉,而使NH4Cl单独结晶析出供做氮肥,大大提高了原料利用率、降低了生产成本,为世界制碱业做出了巨大贡献。依据上述信息可知,副产品的成分为___________ ,循环Ⅰ中物质的主要成分是___________ 。(本小题涉及到的物质均写化学式)
Ⅱ.产品纯度的测定:上述生产中获得的纯碱产品中含有少量NaCl杂质,为测定该样品中纯碱的质量分数,可用如图所示的装置进行实验。
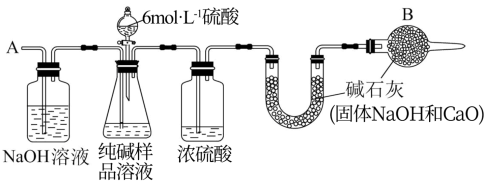
主要实验步骤如下:
①按如图所示装置来组装仪器,并检查装置的气密性;
②将a g纯碱样品放入锥形瓶中,加入适量蒸馏水溶解,得到纯碱样品溶液;
③称量盛有碱石灰的U形管的质量为b g;
④通过分液漏斗滴入6 mol·L-1的硫酸,直到不再产生气体为止;
⑤从导管A处缓缓鼓入一定量的空气;
⑥再次称量盛有碱石灰的U形管的质量为c g;
⑦重复步骤⑤和⑥的操作,直到U形管的质量基本不变,为d g.
请回答下列问题:
(3)装置中干燥管B的作用是___________ 。
(4)从A处通入的空气如果不经过NaOH溶液,测量结果将___________ (填“偏高”、“偏低”或“不变”)。
(5)步骤⑤的目的是___________ 。
(6)步骤⑦的目的是___________ 。
(7)该样品中纯碱的质量分数的计算式为___________ 。
(8)如果所得产品中除含有少量NaCl杂质外还含有少量NaHCO3杂质,下列实验方案中能测定出产品中纯碱的质量分数的是___________ 。
A.取a g产品充分加热,质量减少b g。
B.取a g产品与足量Ba(OH)2溶液反应,过滤、洗涤、干燥,得到b g固体。
C.取a g产品与足量BaCl2溶液反应,过滤、洗涤、干燥,得到b g固体。
Ⅰ.纯碱生产:我国化学家侯德榜改革国外的纯碱生产工艺,其生产流程可简要表示如下。

(1)请写出煅烧炉中发生反应的化学方程式:
(2)侯氏制碱的创新之处:根据NH4Cl在常温时的溶解度比NaCl大,而在低温下却比NaCl溶解度小的原理,在5℃~10℃时,向母液中加入食盐细粉,而使NH4Cl单独结晶析出供做氮肥,大大提高了原料利用率、降低了生产成本,为世界制碱业做出了巨大贡献。依据上述信息可知,副产品的成分为
Ⅱ.产品纯度的测定:上述生产中获得的纯碱产品中含有少量NaCl杂质,为测定该样品中纯碱的质量分数,可用如图所示的装置进行实验。

主要实验步骤如下:
①按如图所示装置来组装仪器,并检查装置的气密性;
②将a g纯碱样品放入锥形瓶中,加入适量蒸馏水溶解,得到纯碱样品溶液;
③称量盛有碱石灰的U形管的质量为b g;
④通过分液漏斗滴入6 mol·L-1的硫酸,直到不再产生气体为止;
⑤从导管A处缓缓鼓入一定量的空气;
⑥再次称量盛有碱石灰的U形管的质量为c g;
⑦重复步骤⑤和⑥的操作,直到U形管的质量基本不变,为d g.
请回答下列问题:
(3)装置中干燥管B的作用是
(4)从A处通入的空气如果不经过NaOH溶液,测量结果将
(5)步骤⑤的目的是
(6)步骤⑦的目的是
(7)该样品中纯碱的质量分数的计算式为
(8)如果所得产品中除含有少量NaCl杂质外还含有少量NaHCO3杂质,下列实验方案中能测定出产品中纯碱的质量分数的是
A.取a g产品充分加热,质量减少b g。
B.取a g产品与足量Ba(OH)2溶液反应,过滤、洗涤、干燥,得到b g固体。
C.取a g产品与足量BaCl2溶液反应,过滤、洗涤、干燥,得到b g固体。
您最近一年使用:0次
名校
解题方法
2 . 向100 mL NaOH溶液中通入一定量的CO2气体,经充分反应后,再向所获得的溶液中逐滴加入0.1 mol·L-1的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示。下列判断不正确的是
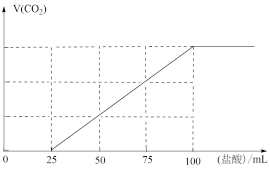

| A.原NaOH溶液的物质的量浓度为0.1 mol·L-1 |
| B.通入CO2的体积为224 mL |
C.V(盐酸)=0~25 mL的范围内发生的离子反应为:CO +H+=HCO +H+=HCO |
| D.所得溶液的溶质成分为Na2CO3和NaHCO3且物质的量之比为1∶2 |
您最近一年使用:0次
名校
3 . 纯碱和小苏打都是重要的化工原料,在生产和生活中有着广泛的应用。
(1)实验室中需0.2mol/L的 溶液980mL,配制时应选用容量瓶的规格和称取
溶液980mL,配制时应选用容量瓶的规格和称取 的质量分别是_______。
的质量分别是_______。
(2)碳酸钠和碳酸氢钠的鉴别与稳定性探究。
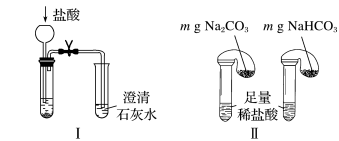
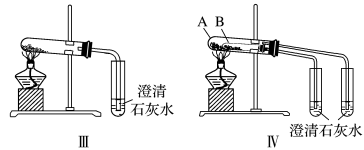
①只根据图Ⅰ、Ⅱ所示实验,能够达到鉴别目的的是_______ (填装置序号)。
②图Ⅲ、Ⅳ中_______ 能更好说明二者的稳定性(填装置序号)。Ⅳ中受热处发生反应的化学方程式:_______ 。
(3)利用图Ⅲ的装置加热 和
和 的混合物,剩余固体成分会随二者物质的量不同而发生变化。当
的混合物,剩余固体成分会随二者物质的量不同而发生变化。当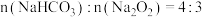 充分混合后,加热至完全反应,试管内剩余的固体是
充分混合后,加热至完全反应,试管内剩余的固体是_______ (填化学式)。
(1)实验室中需0.2mol/L的
 溶液980mL,配制时应选用容量瓶的规格和称取
溶液980mL,配制时应选用容量瓶的规格和称取 的质量分别是_______。
的质量分别是_______。| A.500mL;21.2g | B.900mL;20.1g | C.1000mL;20.1g | D.1000mL;21.2g |


①只根据图Ⅰ、Ⅱ所示实验,能够达到鉴别目的的是
②图Ⅲ、Ⅳ中
(3)利用图Ⅲ的装置加热
 和
和 的混合物,剩余固体成分会随二者物质的量不同而发生变化。当
的混合物,剩余固体成分会随二者物质的量不同而发生变化。当 充分混合后,加热至完全反应,试管内剩余的固体是
充分混合后,加热至完全反应,试管内剩余的固体是
您最近一年使用:0次
2021-12-02更新
|
446次组卷
|
2卷引用:黑龙江省大庆实验中学2021-2022学年高一上学期期中考试化学试题
名校
4 . 将一定物质的量的 、
、 组成的混合物溶于水配成1L溶液,取出50mL溶液,然后滴加一定物质的量浓度的盐酸与它反应,得到的图象如图所示。下列说法错误的是
组成的混合物溶于水配成1L溶液,取出50mL溶液,然后滴加一定物质的量浓度的盐酸与它反应,得到的图象如图所示。下列说法错误的是
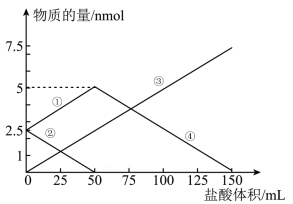
 、
、 组成的混合物溶于水配成1L溶液,取出50mL溶液,然后滴加一定物质的量浓度的盐酸与它反应,得到的图象如图所示。下列说法错误的是
组成的混合物溶于水配成1L溶液,取出50mL溶液,然后滴加一定物质的量浓度的盐酸与它反应,得到的图象如图所示。下列说法错误的是
| A.图象中③线代表的物质是NaCl |
B.④线发生的离子反应: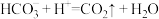 |
| C.盐酸的物质的量浓度是0.05 mol/L |
D.原混合物中 与 与 的物质的量之比为1:2 的物质的量之比为1:2 |
您最近一年使用:0次
名校
解题方法
5 . 向四只盛有一定量 溶液的烧杯中,分别通入不同量的
溶液的烧杯中,分别通入不同量的 气体,再向所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的
气体,再向所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的 气体与
气体与 的量的关系如图所示(忽略
的量的关系如图所示(忽略 的溶解和
的溶解和 的挥发,n代表物质的个数)则下列分析不正确的是
的挥发,n代表物质的个数)则下列分析不正确的是

 溶液的烧杯中,分别通入不同量的
溶液的烧杯中,分别通入不同量的 气体,再向所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的
气体,再向所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的 气体与
气体与 的量的关系如图所示(忽略
的量的关系如图所示(忽略 的溶解和
的溶解和 的挥发,n代表物质的个数)则下列分析不正确的是
的挥发,n代表物质的个数)则下列分析不正确的是
A.Ⅰ图对应溶液中溶质为 |
B.Ⅱ图对应溶液中溶质为 |
C.Ⅲ图对应溶液中溶质为 和 和 ,且 ,且 和 和 的个数比为1:2 的个数比为1:2 |
D.Ⅳ图对应溶液中溶质为 和 和 ,且 ,且 和 和 的个数比为1:1 的个数比为1:1 |
您最近一年使用:0次
2021-11-14更新
|
1099次组卷
|
3卷引用:黑龙江省大庆铁人中学2023-2024学年高一上学期10月月考化学试题
名校
6 . I、某化学课外活动小组欲制取纯Na2CO3溶液并讨论实验过程中的相关问题,可供选择的试剂有:A.大理石 B.盐酸 C.氢氧化钠溶液 D.澄清石灰水
甲、乙、丙三位同学设计的制备实验方案的反应流程分别如下:
甲:NaOH溶液 Na2CO3溶液
Na2CO3溶液
乙:NaOH溶液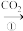 NaHCO3溶液
NaHCO3溶液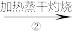 Na2CO3固体
Na2CO3固体 Na2CO3溶液
Na2CO3溶液
丙:NaOH溶液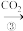 NaHCO3溶液
NaHCO3溶液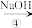 Na2CO3溶液
Na2CO3溶液
请回答下列问题:
(1)___________ 方案最优,其实验的关键是:_________ 。
(2)假设反应②所得的Na2CO3固体中混有未分解的NaHCO3,乙同学选择澄清石灰水测定其中NaHCO3的质量分数,乙同学___________ (填“能”或“不能”)达到实验目的;若能,请说明计算所需的数据;若不能,请简要说明理由:___________ 。
II、若以上所需氢氧化钠溶液需要配制成98mL1.0mol/L的溶液,回答以下问题:
(3)计算:需___________ g的NaOH固体;实验中用到的玻璃仪器除了烧杯、玻璃棒、胶头滴管、量筒、试剂瓶,还需要___________ 。
(4)下列实验步骤,正确的操作顺序是:___________ 。
A.用少量蒸馏水洗涤烧杯及玻璃棒,将洗涤液注入容量瓶中,并重复操作两次
B.把已冷却的氢氧化钠溶液注入已查漏的容量瓶中
C.继续往容量瓶中加蒸馏水,使液面接近刻度线1-2cm处改用胶头滴管滴加蒸馏水,使液面达到刻度线
D.根据计算,用天平称取一定质量的氢氧化钠固体置于小烧杯中加入水溶解,并不断搅拌
E.盖上容量瓶的塞子,振荡,摇匀
(5)如果上述B操作中把未冷却的氢氧化钠溶液注入容量瓶中,所配溶液的浓度将___________ (填“偏高”、“偏低”或“无影响”,下同);如果上述D操作中用滤纸称量固体,所配溶液的浓度将___________ ;如果上述C操作中目光俯视,所配溶液的浓度将___________ 。
甲、乙、丙三位同学设计的制备实验方案的反应流程分别如下:
甲:NaOH溶液
 Na2CO3溶液
Na2CO3溶液乙:NaOH溶液
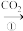 NaHCO3溶液
NaHCO3溶液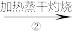 Na2CO3固体
Na2CO3固体 Na2CO3溶液
Na2CO3溶液丙:NaOH溶液
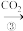 NaHCO3溶液
NaHCO3溶液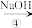 Na2CO3溶液
Na2CO3溶液请回答下列问题:
(1)
(2)假设反应②所得的Na2CO3固体中混有未分解的NaHCO3,乙同学选择澄清石灰水测定其中NaHCO3的质量分数,乙同学
II、若以上所需氢氧化钠溶液需要配制成98mL1.0mol/L的溶液,回答以下问题:
(3)计算:需
(4)下列实验步骤,正确的操作顺序是:
A.用少量蒸馏水洗涤烧杯及玻璃棒,将洗涤液注入容量瓶中,并重复操作两次
B.把已冷却的氢氧化钠溶液注入已查漏的容量瓶中
C.继续往容量瓶中加蒸馏水,使液面接近刻度线1-2cm处改用胶头滴管滴加蒸馏水,使液面达到刻度线
D.根据计算,用天平称取一定质量的氢氧化钠固体置于小烧杯中加入水溶解,并不断搅拌
E.盖上容量瓶的塞子,振荡,摇匀
(5)如果上述B操作中把未冷却的氢氧化钠溶液注入容量瓶中,所配溶液的浓度将
您最近一年使用:0次
14-15高三上·山东德州·阶段练习
名校
解题方法
7 . 向NaOH和Na2CO3混合溶液中滴加1 mol/L的稀盐酸,CO2的生成量与加入盐酸的量的关系如图所示。下列判断正确的是
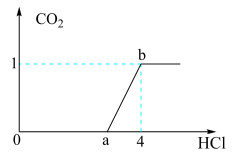

| A.在0~a范围内,只发生中和反应 |
B.ab段发生反应的离子方程式为CO +2H+=CO2↑+H2O +2H+=CO2↑+H2O |
| C.a=3 |
| D.原混合溶液中NaOH与Na2CO3的物质的量之比为1∶2 |
您最近一年使用:0次
2020-11-23更新
|
2867次组卷
|
67卷引用:【全国百强校】黑龙江省大庆市铁人中学2019届高三第一次模拟考试化学试题
【全国百强校】黑龙江省大庆市铁人中学2019届高三第一次模拟考试化学试题【全国百强校】黑龙江省大庆市铁人中学2018-2019学年高一上学期期末考试化学试题黑龙江省大庆市铁人中学2018-2019学年高二下学期期末考试化学试题黑龙江大庆第十中学2019-2020学年高一上学期期末考试化学试题黑龙江省大庆市铁人中学2019-2020学年高一上学期期末考试化学试题(已下线)2015届山东省乐陵市第一中学高三10月初检测化学试卷2015届山东省桓台县二中高三上学期期末考试化学试卷黑龙江省齐齐哈尔市第八中学2018届高三上学期第一阶段测试化学试题2018届高三一轮复习化学:考点16-钠及其化合物的简单计算甘肃省兰州第一中学2018届高三上学期第二次月考(9月)化学试题安徽省六安市第一中学2018届高三上学期第二次月考化学试题湖北省宜昌市葛洲坝中学2018届高三9月月考化学试题河南省鹤壁市淇滨高级中学2017-2018学年高一上学期第三次月考化学试题(已下线)2017-2018学年第一学期期末复习备考之精准复习模拟题高一化学(必修1)(B卷)【全国市级联考】河南省驻马店市2016-2017学年高一下学期期末考试化学试题2018-2019学年 钠及其化合物 专项训练题安徽省六安市舒城中学2018-2019学年高一上学期第四次统考化学试题【全国百强校】山东省菏泽第一中学八一路校区2018-2019学年高一上学期12月月考化学试题黑龙江省齐齐哈尔八中2018-2019学年高一上学期期末考试化学试题【全国百强校】黑龙江省实验中学2018-2019学年高一上学期期末考试化学试题【全国百强校】黑龙江省双鸭山市第一中学2018-2019学年高一下学期开学考试化学试题江西省宜丰中学2018-2019学年高一下学期第一次月考化学试题云南省曲靖市会泽县第一中学2018-2019学年高一下学期第一次半月考试化学试题步步为赢 高二化学暑假作业:作业四 金属及其化合物浙江省湖州市高中联盟2017-2018学年高一下学期期中联考化学试题(已下线)2019年7月27日《每日一题》 2020届一轮复习 周末培优内蒙古鄂尔多斯市第一中学2018-2019学年高二下学期期末考试化学试题浙江省湖州市高中联盟2018-2019学年高一下学期期中化学试题山东省济宁市2020届高三10月月考化学试卷山东省济宁市邹城第一中学2020届高三10月月考化学试题山东省莱阳市第一中学2020届高三10月月考化学试题黑龙江省哈尔滨市第六中学2019-2020学年高一上学期期中考试化学试题江西省赣州市会昌中学2019-2020学年高一上学期第二次月考化学试题吉林省榆树市第一高级中学2019-2020学年高一上学期尖子生第二次考试化学试题(已下线)【南昌新东方】2019 新建二中 高一上第二次月考四川省自贡市田家炳中学2019-2020学年高一下学期开学考试化学试题(已下线)专题3.1 钠及其重要化合物(讲)——2020年高考化学一轮复习讲练测浙江省宁波市北仑中学2019-2020学年高二6月月考化学试题(已下线)第10讲 钠及其重要化合物(精练)——2021年高考化学一轮复习讲练测(已下线)第10讲 钠及其重要化合物(精讲)——2021年高考化学一轮复习讲练测(已下线)期中模拟卷(一)——2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)人教版(2019)高一必修第一册第二章 海水中的重要元素 素养拓展区河南省信阳市罗山县2021届高三第一次调研(8月联考)化学试题(已下线)第2章 章末检测-2020-2021学年高一化学同步课堂帮帮帮(人教版2019必修第一册)安徽省芜湖市2021届高三第二次月考化学试题高一必修第一册(苏教2019版)专题3 B 素养拓展区 过综合 专题素养综合检测福建省福州市罗源第一中学2021届高三上学期10月月考化学试题天津市耀华中学2021届高三上学期第一次月考化学试题广东省韶关市田家炳中学2020-2021学年高一上学期期中考试化学试题吉林省油田高级中学2019-2020学年高一上学期期中考试化学试题吉林省白城市大安市第一中学校2020-2021学年高一上学期第三次月考化学试题河北省任丘市第一中学2020-2021学年高一上学期第二次阶段考试化学试题四川省南充高级中学2020-2021学年高一上学期第二次月考化学试题浙江省建德市严州中学新安江校区2020-2021学年高一上学期1月月考化学试题(已下线)【浙江新东方】在线化学36天津市静海区第一中学2020-2021学年高一上学期期末考试化学试题安徽省六安市舒城中学2020-2021学年高一下学期开学考试化学试题(已下线)小题10 离子推断 ——备战2021年高考化学经典小题考前必刷(全国通用)天津市新华中学2021-2022学年高三上学期第一次月考化学试题河北省邯郸市魏县旭日中学2021-2022学年高一上学期期中考试化学试题辽宁省北镇市满族高级中学2022-2023学年高三上学期第一次质量检测化学试题天津市第四十七中学2021-2022学年高一上学期第二次月考化学试题湖南省衡阳县第五中学2022-2023学年高一上学期期末考试化学试题天津市宝坻区第一中学2022-2023学年高一上学期线上期末训练化学试题四川省泸州市泸县2022-2023学年高一下学期开学考试化学试题天津市南开中学2023-2024学年高三上学期第一次月考化学试题天津市南开中学2023-2024学年高三上学期第一次月检测化学试题
14-15高三上·上海虹口·期末
名校
解题方法
8 . 向100mLNaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入0.2mol/L的盐酸,产生CO2的体积与所加盐酸体积之间的关系如图所示。下列判断正确的是
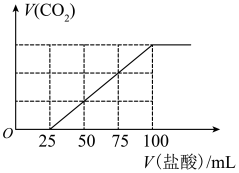

| A.原NaOH溶液的浓度为0.1mol·L-1 |
| B.通入CO2的体积为448mL(标准状况) |
| C.所得溶液的溶质成分的物质的量之比为n(NaOH)∶n(Na2CO3)=1∶3 |
| D.所得溶液的溶质成分的物质的量之比为n(NaHCO3)∶n(Na2CO3)=2∶1 |
您最近一年使用:0次
2020-10-28更新
|
1606次组卷
|
25卷引用:2016届黑龙江省大庆实验中学高三上学期开学考试化学试卷
2016届黑龙江省大庆实验中学高三上学期开学考试化学试卷2015-2016学年黑龙江省大庆铁人中学高一上期末化学试卷(已下线)2014届上海市虹口区高三上学期期末考试(一模)化学试卷(已下线)2015届贵州省贵阳市清华中学高三8月月考理综化学试卷2016届吉林省扶余市第一中学高三上学期第一次月考化学试卷2016届黑龙江哈尔滨师大附中高三上学期期中考试化学试卷2015-2016学年河南省洛阳市孟津一中高一上期末化学试卷2017届黑龙江省双鸭山一中高三上学期第一次质检化学试卷安徽省淮北市第一中学2016-2017学年高二下学期期中考试化学试题2018届高三一轮复习化学:考点17-碳酸钠、碳酸氢钠的性质探究安徽省合肥市第六中学2017-2018学年高一上学期期中考试化学试题【全国百强校】黑龙江省牡丹江市第一高级中学2017-2018学年高二下学期期末考试化学试题江西省上饶市上饶中学2019届高三上学期开学(实验、重点、特长班)检测化学试题吉林省通榆县第一中学2019届高三上学期期中考试化学试题【全国百强校】黑龙江省哈尔滨师范大学附属中学2018-2019学年高一下学期开学考试化学试题河南省安阳市第三十六中学2018-2019学年高二6月月考化学试题夯基提能2020届高三化学选择题对题专练——化学计算中的常见方法和应用江西省九江市同文中学2019-2020学年度高一下学期期初考试化学试题人教版(2019)高一必修第一册 模块综合测评-B卷高一必修第一册(苏教2019版)专题3 第二单元 金属钠及钠的化合物 课时2 碳酸钠、碳酸氢钠河南省南阳市第一中学校2021届高三第三次月考化学试题黑龙江省七台河市勃利县高级中学2021届高三上学期期中考试化学试题(已下线)专题08 常见无机物及其应用——备战2021年高考化学纠错笔记安徽省芜湖市第一中学2021-2022学年高一上学期第二次月末诊断测试化学试题黑龙江省哈尔滨市宾县第二中学2021-2022学年高一下学期开学考试化学试题
名校
解题方法
9 . 有Na2CO3和NaHCO3的混合物1.9g,加热灼烧至质量不再减少(反应的化学方程式是:2NaHCO3= Na2CO3+CO2↑+H2O),再与足量盐酸反应生成0.66g气体,试计算原混合物中NaHCO3的质量分数____________ 。
您最近一年使用:0次
11-12高一上·黑龙江大庆·期末
名校
解题方法
10 . 1L 1mol/L NaOH溶液吸收0.8mol CO2,所得溶液中CO32-与HCO3-的物质的量浓度之比为
| A.1∶3 | B.2∶1 | C.2∶3 | D.3∶2 |
您最近一年使用:0次
2020-01-11更新
|
318次组卷
|
13卷引用:2010—2011学年黑龙江省大庆实验中学高一上学期期末考试化学试卷
(已下线)2010—2011学年黑龙江省大庆实验中学高一上学期期末考试化学试卷(已下线)2011届山西省介休十中高三下学期第一次模拟考试化学试卷(已下线)2010—2011学年广西南宁沛鸿民族中学高二下学期期中考试化学试卷(已下线)2011-2012学年湖南省望城县第一中学高二上学期期末质量检测化学试卷(已下线)2011-2012学年内蒙古巴市一中高二下学期期末考试化学试卷(已下线)2012-2013学年河北省邢台一中高一上学期第三次月考化学试卷浙江省宁波诺丁汉大学附属中学2017-2018学年高一上学期期中考试化学试题山东省菏泽第一中学2017-2018学年高一12月月考化学试题【全国百强校】上海市金山中学2017-2018学年高二上学期期中考试等级化学试题【全国百强校】新疆第二师华山中学2018-2019学年高一上学期期中考试化学试题河北省魏县第五中学2019-2020学年高一上学期第二次月考化学试题天津市静海区第一中学2019-2020学年高一上学期期末学生学业能力调研化学试题福建省莆田第一中学2021-2022学年高一下学期期初学科素养能力竞赛化学试题



