1 . 某小组设计如图实验探究铁与水蒸气的反应。
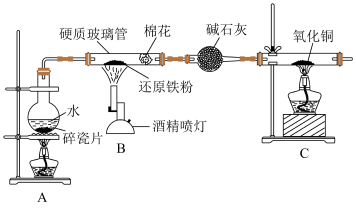
(1)写出铁和水蒸气反应的化学方程式,并用双线桥表示电子转移的方向和数目:______ 。
(2)圆底烧瓶中碎瓷片的作用是防止暴沸,若加热一段时间后发现忘记加碎瓷片,需要补加碎瓷片的操作是______ 。
(3)检验反应后的固体是否存在Fe3O4,引起小组成员争论:
①甲同学认为可以使用化学方法,先用足量硫酸溶解,再分别检验Fe2+和Fe3+。
先检测Fe2+是否存在:请从下列试剂中选择一种:NaOH溶液、新制氯水、KSCN溶液、酸性KMnO4溶液,写出发生反应的离子方程式:______ ;然后再检测Fe3+是否存在。多数同学认为该方法检验是否存在Fe3O4不合理,请写出一条理由:______ 。
②乙同学认为可以利用Fe3O4的物理性质进行快速检验。用铁片接触样品后再移开,若观察到_____ 现象,证明了反应后的固体中含有Fe3O4。

(1)写出铁和水蒸气反应的化学方程式,并用双线桥表示电子转移的方向和数目:
(2)圆底烧瓶中碎瓷片的作用是防止暴沸,若加热一段时间后发现忘记加碎瓷片,需要补加碎瓷片的操作是
(3)检验反应后的固体是否存在Fe3O4,引起小组成员争论:
①甲同学认为可以使用化学方法,先用足量硫酸溶解,再分别检验Fe2+和Fe3+。
先检测Fe2+是否存在:请从下列试剂中选择一种:NaOH溶液、新制氯水、KSCN溶液、酸性KMnO4溶液,写出发生反应的离子方程式:
②乙同学认为可以利用Fe3O4的物理性质进行快速检验。用铁片接触样品后再移开,若观察到
您最近一年使用:0次
2 . 已知氧化性:Fe3+>M2+(M为不活泼的常见金属),向物质的量浓度均为1mol•L-1的Fe2(SO4)3和MSO4的100mL混合液中加入amol铁粉,充分反应后,下列说法不正确的是( )
| A.当a≤0.1时,发生的反应为2Fe3++Fe=3Fe2+ |
| B.当0.1≤a<0.2时,溶液中n(Fe2+)=(0.2+a)mol |
| C.当a≥0.2时,发生的反应为2Fe3++M2++2Fe=4Fe2++M |
| D.若有固体剩余则可能是铁 |
您最近一年使用:0次
2020-03-06更新
|
801次组卷
|
12卷引用:第三章 实验活动2 铁及其化合物的性质 期末备考复习 2023-2024学年高一上学期化学人教版(2019)必修第一册
第三章 实验活动2 铁及其化合物的性质 期末备考复习 2023-2024学年高一上学期化学人教版(2019)必修第一册 河南省驻马店市2020届高三上学期期末统一考试化学试题(已下线)考点03 氧化还原反应-2020年高考化学命题预测与模拟试题分类精编(已下线)课时10 氧化还原反应规律及应用-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考点04 氧化还原反应-备战2022年高考化学学霸纠错(全国通用)(已下线)第03练 氧化还原反应-2023年高考化学一轮复习小题多维练(全国通用)黑龙江省佳木斯市第十二中学2022-2023学年高三上学期期中考试化学试题(已下线)第一章 化学物质及其变化 第5练 氧化还原反应的计算与方程式的配平(已下线)第4讲 氧化还原反应的基本概念与规律四川省泸州市合江县马街中学校2023-2024学年高一上学期1月期末化学试题(已下线)第04讲 氧化还原反应的基本概念和规律(讲义)-【上好课】2025年高考化学一轮复习讲练测(新教材新高考)福建省泉州市第七中学2023-2024学年高一下学期5月期中考试化学试题
名校
3 . 氧化性Fe3+>Cu2+,向物质的量浓度均为2mol/L的Fe2(SO4)3、CuSO4的500mL混合液中加入a mol铁粉,充分反应后,下列说法不正确的是
| A.当a≤1时,发生的反应为2Fe3++Fe=3Fe2+ |
| B.当a≥2时,发生的反应为2Fe3++2Cu2++3Fe=5Fe2++2Cu |
| C.当1≤a<2时,溶液中 n(Fe2+)=(2+a)mol |
| D.若有固体剩余,则固体中一定有铜,可能有铁 |
您最近一年使用:0次
11-12高三·云南玉溪·阶段练习
名校
4 . 下列由相关实验现象所推出的结论正确的是
| A.Cl2、SO2均能使品红溶液褪色,说明二者均有氧化性 |
| B.向溶液中滴加酸化的Ba(NO3)2溶液出现白色沉淀,说明该溶液中一定有SO42- |
| C.Fe与稀HNO3、稀H2SO4反应均有气泡产生,说明Fe与两种酸均发生置换反应 |
| D.分别充满HCl、NH3的烧瓶倒置于水中后液面均迅速上升,说明二者均易溶于水 |
您最近一年使用:0次
2019-01-30更新
|
1471次组卷
|
24卷引用:山西省太原师范学院附属中学、太原市师苑中学校2021-2022学年高一下学期3月月考化学试题
山西省太原师范学院附属中学、太原市师苑中学校2021-2022学年高一下学期3月月考化学试题(已下线)2013届云南省玉溪一中高三第二次月考化学试卷(已下线)2013届浙江省宁波市效实中学高三上学期期中考试化学试卷(已下线)2014届陕西省西安市第一中学高三上学期期中考试化学试卷江苏省姜堰第二中学2018-2019学年高二上学期期末考试化学试题天津市静海区第一中学2020届高三3月统练化学试题内蒙古包头稀土高新区第二中学2019-2020高一下学期月考化学试题华中师范大学海南附属中学2019-2020学年高一下学期3月月考化学试题吉林省德惠市实验中学2020-2021学年高一下学期第一次月考化学试题重庆市凤鸣山中学2020-2021学年高一下学期期中考试化学试题湖南省江永县第三中学2020-2021学年高一下学期期中考试化学试题湖南省邵东县第三中学2020-2021学年高一下学期第一次月考化学试题四川省仁寿县第二中学2021-2022学年高三上学期第二次教育教学质量检测(10月月考)化学试题甘肃省天水市第一中学2021-2022学年高一下学期第一阶段考试化学试题四川省成都外国语学校2021-2022学年高二下学期6月月考化学试题甘肃省民勤县第一中学2021-2022学年高一下学期期中考试化学(选修)试题贵州省黔西南州同源中学2021-2022学年高一下学期第三次月考化学试题辽宁省沈阳市辽中区第二高级中学2021-2022学年高一下学期摸底考试化学试题(已下线)专题10 常见非金属元素的性质及应用-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)广东省佛山市顺德区容山中学2022-2023学年高一下学期3月月考化学试题甘肃省定西市渭源县第一中学2022-2023学年高一下学期第一次阶段考试化学试题四川省射洪中学校2022-2023学年高一下学期期中考试化学试题湖南省长沙市第一中学2022-2023学年高一上学期入学考试化学试题安徽省芜湖市第一中学2022-2023学年高一下学期3月份教学质量诊断测试化学试卷
名校
解题方法
5 . 工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是___ 。
(2)另称取铁钉6.0g放入15.0ml浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+,若要确认其中的Fe2+,应选用___ (选填序号)。
a.KSCN溶液和氯水 b.K3Fe(CN)6溶液 c.浓氨水 d.酸性KMnO4溶液
②乙同学取336ml(标准状况)气体Y通入足量溴水中,发生反应:SO2+Br2+2H2O=2HBr+H2SO4,然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g。由此推知气体Y中SO2的体积分数为___ 。分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含有H2和Q气体(Q不考虑水蒸气)。为此设计了下列探究实验装置(图中夹持仪器省略)。
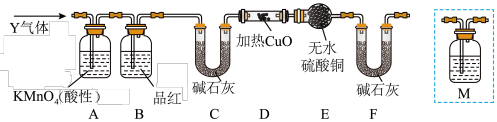
(3)装置B中试剂的作用是___ 。
(4)如果气体Y中含有H2,预计实验现象应是___ 。
(5)认为气体Y中还含有Q的理由是___ (用化学方程式表示)。
(6)为确认Q的存在,需在装置中添加M于___ (选填序号)。
a.A之前 b.A-B间 c.B-C间 d.C-D间
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是
(2)另称取铁钉6.0g放入15.0ml浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+,若要确认其中的Fe2+,应选用
a.KSCN溶液和氯水 b.K3Fe(CN)6溶液 c.浓氨水 d.酸性KMnO4溶液
②乙同学取336ml(标准状况)气体Y通入足量溴水中,发生反应:SO2+Br2+2H2O=2HBr+H2SO4,然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g。由此推知气体Y中SO2的体积分数为

(3)装置B中试剂的作用是
(4)如果气体Y中含有H2,预计实验现象应是
(5)认为气体Y中还含有Q的理由是
(6)为确认Q的存在,需在装置中添加M于
a.A之前 b.A-B间 c.B-C间 d.C-D间
您最近一年使用:0次
名校
解题方法
6 . 我校高一化学兴趣小组的同学们为探究铁与浓硫酸的反应,设计了如图所示装置进行实验。
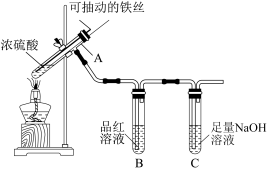
(1)实验过程中,观察到B中的实验现象是_______________ ;写出C中发生反应的离子方程式_________________________ 。
(2)浓硫酸与足量的铁丝反应一段时间后,若观察到从C中有少量的气泡冒出,此气泡的成分是___________ 。试分析产生该气体的原因____________________ 。
(3)用“可抽动的铁丝”代替“直接投入铁片”的优点是_____________________ ;
(4)反应一段时间后,他们对A中溶液的金属阳离子进行了探究
①提出假设:
假设1:_____________ ;
假设2:_____________ ;
假设3:溶液中存在Fe2+和Fe3+。
②已知假设3是正确的,选择合适的试剂,设计实验验证上述假设3,写出实验操作步骤、实验现象及结论。限选试剂:稀HNO3、氯水、酸性KMnO4溶液、NaOH溶液、KSCN溶液。

(1)实验过程中,观察到B中的实验现象是
(2)浓硫酸与足量的铁丝反应一段时间后,若观察到从C中有少量的气泡冒出,此气泡的成分是
(3)用“可抽动的铁丝”代替“直接投入铁片”的优点是
(4)反应一段时间后,他们对A中溶液的金属阳离子进行了探究
①提出假设:
假设1:
假设2:
假设3:溶液中存在Fe2+和Fe3+。
②已知假设3是正确的,选择合适的试剂,设计实验验证上述假设3,写出实验操作步骤、实验现象及结论。限选试剂:稀HNO3、氯水、酸性KMnO4溶液、NaOH溶液、KSCN溶液。
| 实验操作步骤 | 实验现象 | 结论 |
| Ⅰ | 溶液中存在Fe3+; | |
| Ⅱ |
您最近一年使用:0次
2016-12-09更新
|
890次组卷
|
2卷引用:2015-2016学年山西省太原五中高一上学期期末化学试卷
7 . 某校化学小组学生利用如图所列装置进行“铁与水反应”的实验,并利用产物进一步制取FeCl3•6H2O晶体.(图中夹持及尾气处理装置均已略去)
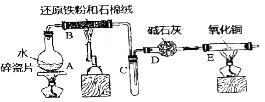
(1)装置B中发生反应的化学方程式是________ ;
(2)装置E中的现象是________ ;
(3)该小组把B中反应后的产物加入足量的盐酸,用该溶液制取FeCl3•6H2O晶体.
①欲检验溶液里含有Fe3+,选用的试剂为________ ,现象是________ ;
②该实验小组同学用上述试剂没有检验到Fe3+,用离子方程式解释滤液中不存在Fe3+可能的原因________ ;
③将此溶液中FeCl2完全氧化为FeCl3,最好选择下列物质中的________
④在③所得溶液浓缩结晶前需要用实验证明FeCl2已完全氧化,实验方法是________ 。

(1)装置B中发生反应的化学方程式是
(2)装置E中的现象是
(3)该小组把B中反应后的产物加入足量的盐酸,用该溶液制取FeCl3•6H2O晶体.
①欲检验溶液里含有Fe3+,选用的试剂为
②该实验小组同学用上述试剂没有检验到Fe3+,用离子方程式解释滤液中不存在Fe3+可能的原因
③将此溶液中FeCl2完全氧化为FeCl3,最好选择下列物质中的
| A.酸性KMnO4溶液 | B.Cl2 | C.Na2O2 | D.FeCl3 |
您最近一年使用:0次
2016-12-09更新
|
426次组卷
|
3卷引用:2015-2016学年山西省怀仁一中高一下第一次月考化学试卷
2015-2016学年山西省怀仁一中高一下第一次月考化学试卷(已下线)第三章 章末检测(1)——《高中新教材同步备课》(人教版 必修第一册)安徽省池州市第一中学2020-2021学年高一12月月考化学试题



