名校
解题方法
1 . 化学与生产生活密切相关,下列有关说法不正确的是
| A.某管道疏通剂主要成分是NaOH粉末和铝粉,可与“洁厕灵”混合使用提高疏通和清洁效果 |
| B.洗涤棉布衣物不容易“甩干”是因为衣物与水分子间形成了氢键 |
C.高铁酸钾( )在水处理过程中涉及的变化有:蛋白质变性、胶体聚沉、盐类水解、氧化还原反应 )在水处理过程中涉及的变化有:蛋白质变性、胶体聚沉、盐类水解、氧化还原反应 |
| D.酱油中添加少量苯甲酸钠作防腐剂 |
您最近一年使用:0次
2024-03-22更新
|
360次组卷
|
2卷引用:河南省信阳高级中学2024届高三二模(模拟测试九)理综-化学试题
名校
解题方法
2 . 硫氰化钾(KSCN)俗称玫瑰红酸钾,是一种用途广泛的化学药品。某实验小组模拟工业制备硫氰化钾的方法,设计实验如图:
I.制备NH4SCN溶液
(1)装置A用于制备NH3,圆底烧瓶内的固体a是_______ (填名称)。
(2)三颈烧瓶内盛放有CS2、水和固体催化剂,发生反应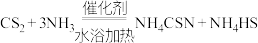 。实验开始时,打开K2和K1,水浴加热装置B,反应发生。三颈烧瓶左侧导管口必须插入CS2中,其目的是
。实验开始时,打开K2和K1,水浴加热装置B,反应发生。三颈烧瓶左侧导管口必须插入CS2中,其目的是_______ 。
(3)一段时间后,当观察到三颈烧瓶内_______ 时,停止通入气体,反应完成。
II.制备KSCN溶液
(4)关闭K1,将三颈烧瓶继续加热至100℃,待NH4HS完全分解后,再打开K3,继续保持水浴温度为100℃,缓缓滴入稍过量的KOH溶液,制得KSCN溶液。发生反应的化学方程式为_______ ;酸性K2Cr2O7溶液除可以吸收NH3外,还能将H2S气体氧化成硫酸,其离子方程式为_______ 。
III.制备KSCN晶体
(5)先除去三颈烧瓶中的固体催化剂,再通过蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得到硫氰化钾晶体。该提取过程中一定不用的仪器有_______ (填序号)。
①坩埚②蒸发皿③分液漏斗④玻璃棒⑤烧杯
(6)测定晶体中KSCN的含量:称取5.0g样品,配成500mL溶液。量取25.00mL溶液加入锥形瓶中,加入适量稀硝酸,再加入几滴铁盐溶液作指示剂,用0.1000mol/LAgNO3标准溶液滴定,达到滴定终点,三次滴定平均消耗AgNO3标准溶液21.00mL。
①滴定时发生的反应: ,则指示剂的化学式为
,则指示剂的化学式为_______ (填序号)。
A. B.
B. C.
C. D.
D.
②晶体中KSCN的质量分数为_______ (计算结果保留三位有效数字)。

I.制备NH4SCN溶液
(1)装置A用于制备NH3,圆底烧瓶内的固体a是
(2)三颈烧瓶内盛放有CS2、水和固体催化剂,发生反应
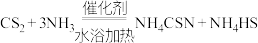 。实验开始时,打开K2和K1,水浴加热装置B,反应发生。三颈烧瓶左侧导管口必须插入CS2中,其目的是
。实验开始时,打开K2和K1,水浴加热装置B,反应发生。三颈烧瓶左侧导管口必须插入CS2中,其目的是(3)一段时间后,当观察到三颈烧瓶内
II.制备KSCN溶液
(4)关闭K1,将三颈烧瓶继续加热至100℃,待NH4HS完全分解后,再打开K3,继续保持水浴温度为100℃,缓缓滴入稍过量的KOH溶液,制得KSCN溶液。发生反应的化学方程式为
III.制备KSCN晶体
(5)先除去三颈烧瓶中的固体催化剂,再通过蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得到硫氰化钾晶体。该提取过程中一定不用的仪器有
①坩埚②蒸发皿③分液漏斗④玻璃棒⑤烧杯
(6)测定晶体中KSCN的含量:称取5.0g样品,配成500mL溶液。量取25.00mL溶液加入锥形瓶中,加入适量稀硝酸,再加入几滴铁盐溶液作指示剂,用0.1000mol/LAgNO3标准溶液滴定,达到滴定终点,三次滴定平均消耗AgNO3标准溶液21.00mL。
①滴定时发生的反应:
 ,则指示剂的化学式为
,则指示剂的化学式为A.
 B.
B. C.
C. D.
D.
②晶体中KSCN的质量分数为
您最近一年使用:0次
2024-02-29更新
|
89次组卷
|
2卷引用:河南省信阳高级中学2023-2024学年高三上学期2月月考理综试题-高中化学
名校
解题方法
3 . 室温下,某化学研究小组通过下列3组实验探究H2O2溶液的性质。
已知:①Cr最高价为 与
与 的反应为
的反应为 (深蓝色)。
(深蓝色)。
②H2O2溶液呈弱酸性。
根据实验操作和现象,下列有关推论错误的是
| 实验 | 实验操作和现象 |
| I | 向CrO3溶液中滴加少量0.1mol/LH2O2溶液,溶液变深蓝色 |
| II | 向2mL0.1mol/LH2O2溶液中滴加少量FeSO4溶液,溶液迅速变黄,稍后产生气体;再加入几滴KSCN溶液,溶液变红,一段时间后,溶液颜色明显变浅并逐渐褪色 |
| III | 向2mL0.01mol/LNaOH溶液中滴加少量酚酞,溶液变红,向其中滴加3~5滴0.01mol/LH2O2溶液,振荡,溶液逐渐褪色 |
 与
与 的反应为
的反应为 (深蓝色)。
(深蓝色)。②H2O2溶液呈弱酸性。
根据实验操作和现象,下列有关推论错误的是
| A.实验I中溶液变深蓝色,该反应为非氧化还原反应 |
| B.实验II中前一段溶液迅速变黄,稍后产生气体,体现了H2O2的氧化性,产生的Fe3+对H2O2分解起催化作用 |
| C.实验II中后一段溶液颜色明显变浅并逐渐褪色,说明H2O2能与KSCN反应 |
| D.实验III中溶液逐渐褪色,体现了H2O2的弱酸性 |
您最近一年使用:0次
2023-11-21更新
|
172次组卷
|
2卷引用:河南省信阳高级中学2023-2024学年高三上学期12月月考化学试题
名校
解题方法
4 . 根据实验目的,下列实验方案设计、现象和结论均正确的是
| 选项 | 实验目的 | 方案设计 | 现象和结论 |
| A | 比较金属活动性 | Mg、Al、NaOH溶液构成原电池装置 | 若Mg片上冒气泡,证明活动性:Al>Mg |
| B | 检验Fe(NO3)2中是否混有Fe(NO3)3 | 取样品于试管中,滴加稀硫酸溶解,再滴加几滴KSCN溶液 | 若变红色,说明混有Fe(NO3)3 |
| C | 比较Fe3+和I2的氧化性 | 向FeCl3溶液中滴加淀粉—KI溶液 | 若溶液变蓝,说明氧化性:Fe3+>I2 |
| D | 探究温度对化学反应速率的影响 | 向两支试管各加入2mL0.1mol∙L-1酸性KMnO4溶液和2mL0.01mol∙L-1H2C2O4溶液,将其中一支放入冰水中,一支放入80℃热水中 | 若80℃热水中褪色快,说明温度升高,反应速率加快 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-09-23更新
|
154次组卷
|
2卷引用:河南省信阳市信阳高级中学2024届高三上学期9月一模化学试题
名校
5 . 下列根据实验操作和现象所得到的结论错误的是
| 选项 | 实验操作和现象 | 结论 |
| A | 向 中滴加浓盐酸,出现黄绿色气体 中滴加浓盐酸,出现黄绿色气体 |  具有氧化性 具有氧化性 |
| B | 向溶有 的 的 溶液中通入气体X,出现白色沉淀 溶液中通入气体X,出现白色沉淀 | 气体X一定具有强氧化性 |
| C | 向少量 溶液中滴加维生素C溶液,溶液变为浅绿色 溶液中滴加维生素C溶液,溶液变为浅绿色 | 维生素C具有还原性 |
| D | 向KI溶液中滴加几滴 溶液,再滴加淀粉溶液后变蓝色 溶液,再滴加淀粉溶液后变蓝色 |  的氧化性比 的氧化性比 的强 的强 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-09-27更新
|
456次组卷
|
4卷引用:河南省潢川第一中学2023-2024学年高三上学期第一次月考化学试题
河南省潢川第一中学2023-2024学年高三上学期第一次月考化学试题河南省新未来2023届高三上学期9月联考化学试题河南省濮阳市南乐县第一高级中学2022-2023学年高三上学期10月月考化学试题(已下线)专题24 实验分析设计型选择题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)
名校
6 . 下列关于Fe3+、Fe2+的说法错误的是
| A.Fe3O4中铁元素有+2价和+3价,Fe3O4是混合物 |
| B.配制FeCl3溶液时,先将FeCl3晶体溶于较浓的盐酸中,再加水稀释到所需要的浓度 |
| C.Fe溶于一定量稀硝酸中可能生成Fe3+和Fe2+ |
| D.向FeCl2溶液中加入少量铁粉是为了防止Fe2+被氧化 |
您最近一年使用:0次
2022-09-08更新
|
190次组卷
|
4卷引用:河南省宋基信阳实验中学2022-2023学年高三上学期9月月考化学试题
7 . 硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]是分析化学中的重要试剂,是一种复盐,一般亚铁盐在空气中易被氧化,形成复盐后就比较稳定。与其他复盐一样,硫酸亚铁铵在水中的溶解度比组成它的每一种盐的溶解度都小,利用这一性质可以用等物质的量的(NH4)2SO4和FeSO4混合制备。请回答以下问题:
I.硫酸亚铁铵晶体的制备
步骤一:称取3.0g铁屑,加入15mLl0%Na2CO3溶液,小火加热30分钟,过滤洗涤、干燥、称量得固体m1g。
步骤二:将步骤一中的m1g固体转移至锥形瓶,加入15mL3mol·L-1H2SO4,加热至不再有气体生成,趁热过滤,洗涤固体,将滤液和洗涤液合并后转移至蒸发皿中备用,准确称量剩余固体质量得m2g。
步骤三:计算所得FeSO4的物质的量,计算等物质的量的(NH4)2SO4固体的质量,准确称取(NH4)2SO4。
步骤四:将(NH4)2SO4固体加入蒸发皿中,缓慢加热浓缩至表面出现结晶薄膜为止,放置冷却。
步骤五:经过一系列操作,最终得到较纯净的(NH4)2FeSO4·6H2O。
(1)碱煮30分钟的目的是____ 。
(2)步骤二中的加热,最佳加热方式为____ ,理由是____ 。
(3)关于步骤五中的一系列操作的相关表述,错误的是____ (填字母)。
II.硫酸亚铁铵的分解
已知硫酸亚铁铵在不同温度下加热分解产物不同。设计如图实验装置(夹持装置略去),在500℃时隔绝空气加热A中的硫酸亚铁铵至分解完全,确定分解产物的成分。

(4)B装置的作用是____ 。
(5)实验中,观察到C中无明显现象,D中有白色沉淀生成,可确定分解产物中的某种气体,写出D中发生反应的离子方程式____ 。若去掉C,是否能得出同样结论,并解释其原因____ 。
(6)A中固体完全分解后变为红棕色粉末,某同学设计实验验证固体残留物仅为Fe2O3而不含FeO。请填写表中的实验现象。
I.硫酸亚铁铵晶体的制备
步骤一:称取3.0g铁屑,加入15mLl0%Na2CO3溶液,小火加热30分钟,过滤洗涤、干燥、称量得固体m1g。
步骤二:将步骤一中的m1g固体转移至锥形瓶,加入15mL3mol·L-1H2SO4,加热至不再有气体生成,趁热过滤,洗涤固体,将滤液和洗涤液合并后转移至蒸发皿中备用,准确称量剩余固体质量得m2g。
步骤三:计算所得FeSO4的物质的量,计算等物质的量的(NH4)2SO4固体的质量,准确称取(NH4)2SO4。
步骤四:将(NH4)2SO4固体加入蒸发皿中,缓慢加热浓缩至表面出现结晶薄膜为止,放置冷却。
步骤五:经过一系列操作,最终得到较纯净的(NH4)2FeSO4·6H2O。
(1)碱煮30分钟的目的是
(2)步骤二中的加热,最佳加热方式为
(3)关于步骤五中的一系列操作的相关表述,错误的是
| A.过滤时可使用玻璃棒搅拌的方式来缩短时间 |
| B.过滤和洗涤的速度都要尽可能的快,可以减少产品的氧化 |
| C.洗涤时使用无水乙醇既可以洗去晶体表面的杂质离子,又可以起到干燥作用 |
| D.所得的产品可以采取电热炉烘干的方式彻底干燥 |
II.硫酸亚铁铵的分解
已知硫酸亚铁铵在不同温度下加热分解产物不同。设计如图实验装置(夹持装置略去),在500℃时隔绝空气加热A中的硫酸亚铁铵至分解完全,确定分解产物的成分。

(4)B装置的作用是
(5)实验中,观察到C中无明显现象,D中有白色沉淀生成,可确定分解产物中的某种气体,写出D中发生反应的离子方程式
(6)A中固体完全分解后变为红棕色粉末,某同学设计实验验证固体残留物仅为Fe2O3而不含FeO。请填写表中的实验现象。
| 实验步骤 | 预期现象 | 结论 |
| ①取少量A中残留物于试管中,加入适量稀硫酸,充分振荡便其完全溶解;②将溶液分成两份,分别滴加高锰酸钾溶液、KSCN溶液 | 固体残留物仅为Fe2O3 |
您最近一年使用:0次
解题方法
8 . X在一定条件下可发生如下转化,有关叙述错误的是
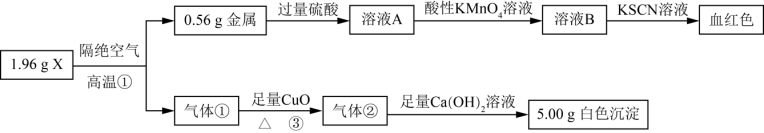

| A.气体①为CO,其质量为(1.96g-0.56g) |
B.反应②的离子方程式为:5Fe2++MnO +4H2O=5Fe3++Mn2++8OH- +4H2O=5Fe3++Mn2++8OH- |
| C.反应③中若气体①反应完全,需CuO的质量为4.0g |
| D.X的化学式为Fe(CO)5 |
您最近一年使用:0次
2021-03-04更新
|
66次组卷
|
3卷引用:河南省信阳市2021-2022学年高三上学期第一次教学质量检测化学试题
9 . 用下面的方案进行某些离子的检验,其中方案设计严密的是( )
A.检验试液中的 :试液 :试液 无沉淀 无沉淀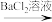 白色沉淀 白色沉淀 |
B.检验试液中的 :试液 :试液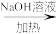 气体 气体 试纸变蓝 试纸变蓝 |
C.检验试液中的I-:试液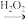 黄色溶液 黄色溶液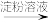 深黄色溶液 深黄色溶液 |
D.检验试液中的Fe2+:试液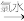 无明显现象 无明显现象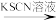 红色溶液 红色溶液 |
您最近一年使用:0次
2020-11-25更新
|
479次组卷
|
3卷引用:河南省信阳市罗山县2021届高三上学期第二次调研考试化学试题
名校
解题方法
10 . 某溶液含有K+、Fe3+、SO 、CO
、CO 、I-中的几种。取样,滴加KSCN溶液后显血红色。为确定该溶液的组成,还需检验的离子是( )
、I-中的几种。取样,滴加KSCN溶液后显血红色。为确定该溶液的组成,还需检验的离子是( )
 、CO
、CO 、I-中的几种。取样,滴加KSCN溶液后显血红色。为确定该溶液的组成,还需检验的离子是( )
、I-中的几种。取样,滴加KSCN溶液后显血红色。为确定该溶液的组成,还需检验的离子是( )| A.K+ | B.I- | C.SO | D.CO |
您最近一年使用:0次
2020-08-20更新
|
754次组卷
|
15卷引用:河南省信阳市罗山县2020届高三毕业班第一次调研化学试题
河南省信阳市罗山县2020届高三毕业班第一次调研化学试题江西省奉新县第一中学2021届高三上学期第一次月考化学试题江西省上饶市横峰中学2021届高三上学期第一次月考化学试题山东省济南市历城第二中学2021届高三上学期学情检测化学试题天津市静海区第一中学2021届高三12月考化学试题(已下线)第05讲 离子共存 离子的检验和推断(精讲)-2022年一轮复习讲练测辽宁省营口市第二高级中学2021-2022学年高三上学期第一次月考化学试题(已下线)专题04 离子共存与离子检验-备战2023年高考化学母题题源解密(广东卷)黑龙江省牡丹江市第三高级中学2022-2023学年高三上学期第一次月考化学试题河北省石家庄市第四中学2022-2023学年高三上学期十月月考化学试题上海市黄浦区2023届高三一模考试化学试题(已下线)专题07 离子反应黑龙江省哈尔滨师范大学附属中学2020-2021学年高二下学期期末考试化学试题四川省绵阳中学实验学校2019-2020学年高一下学期入学考试化学试题 山东省临沂市郯城县美澳学校2022-2023学年高一上学期线上期末检测化学试题



