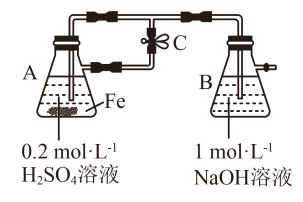
1 . 下列实验设计可以达到实验目的的是
选项 | 实验目的 | 实验设计 |
A | 检验 | 将少量 |
B | 检验待测液中含有 | 用玻璃棒蘸取待测液在无色火焰上灼烧观察现象 |
C | 制备 | 将5~6滴饱和 |
D | 室温下,用pH试纸测定浓度均为0.1mol/L的NaClO溶液和 | 比较HClO和 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
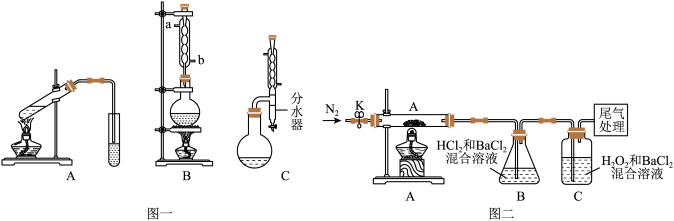
2 . 下列关于 、
、 的说法错误的是
的说法错误的是
 、
、 的说法错误的是
的说法错误的是
A.配制 溶液时,先将氯化铁晶体溶于较浓的盐酸中,再加水稀释到所需要的浓度 溶液时,先将氯化铁晶体溶于较浓的盐酸中,再加水稀释到所需要的浓度 |
B.用如图装置可以制备 沉淀,得到的白色沉淀在A容器中 沉淀,得到的白色沉淀在A容器中 |
C.向某溶液中滴加KSCN溶液,溶液不变色,滴加氯水后溶液显红色,此现象可确定溶液中含有 |
D.向 溶液中加入少量铁粉是为了防止 溶液中加入少量铁粉是为了防止 被氧化 被氧化 |
您最近一年使用:0次
2022-03-03更新
|
319次组卷
|
2卷引用:贵州省毕节市赫章县2021-2022学年高一上学期期末考试化学试题
3 . 化学实验装置的科学设计是实验是否取得预期效果的关键。请回答下列有关实验装置的相关问题:
I.图一中A为教材制备乙酸乙酯的实验装置,甲同学认为图一中B装置比A要好,则冷却水应从______ 口进入;乙同学认为图一中C装置效果更好,理由是_______ 。
Ⅱ.“摩尔盐”[(NH4)2Fe(SO4)2•6H2O]是分析化学中的重要试剂。已知:摩尔盐隔绝空气加热至500℃时可完全分解。某学习小组欲探究其分解产物。
(1)[提出猜想]小组同学认为分解产物可能有以下几种情况:
A.Fe2O3、SO2、NH3、H2O B.FeO、SO3、NH3、H2O
C.FeO、SO2、NH3、H2O D.Fe2O3、SO3、SO2、NH3、H2O
根据所学知识,可确定_________ 不成立(填序号)
(2)[药品验纯]甲同学提出可以用湿润的红色石蕊试纸、稀盐酸和_________ 溶液检验出“摩尔盐”中的三种离子;取一定量的“摩尔盐”配成溶液,取少量溶液置于试管中,向其中滴加_______ (填试剂名称和实验现象),则“摩尔盐”未因氧化而变质。
(3)[实验探究]为检验分解产物,甲同学设计了如下实验装置。
①取一定量“摩尔盐”置于加热管A中,加热至分解完全后打开K,再通入N2,目的是________ 。
②实验中观察到A中固体逐渐变为红棕色,B、C中均产生白色沉淀.C中发生反应的离子方程式为________ 。
③实验验证取A中残留物少许加入稀硫酸溶解,再滴入KMnO4稀溶液,不褪色证明产物不含______ 。
(4)[实验结论与反思]通过实验现象和认真反思,上述猜想中一定正确的是______ 。(填序号)

I.图一中A为教材制备乙酸乙酯的实验装置,甲同学认为图一中B装置比A要好,则冷却水应从
Ⅱ.“摩尔盐”[(NH4)2Fe(SO4)2•6H2O]是分析化学中的重要试剂。已知:摩尔盐隔绝空气加热至500℃时可完全分解。某学习小组欲探究其分解产物。
(1)[提出猜想]小组同学认为分解产物可能有以下几种情况:
A.Fe2O3、SO2、NH3、H2O B.FeO、SO3、NH3、H2O
C.FeO、SO2、NH3、H2O D.Fe2O3、SO3、SO2、NH3、H2O
根据所学知识,可确定
(2)[药品验纯]甲同学提出可以用湿润的红色石蕊试纸、稀盐酸和
(3)[实验探究]为检验分解产物,甲同学设计了如下实验装置。
①取一定量“摩尔盐”置于加热管A中,加热至分解完全后打开K,再通入N2,目的是
②实验中观察到A中固体逐渐变为红棕色,B、C中均产生白色沉淀.C中发生反应的离子方程式为
③实验验证取A中残留物少许加入稀硫酸溶解,再滴入KMnO4稀溶液,不褪色证明产物不含
(4)[实验结论与反思]通过实验现象和认真反思,上述猜想中一定正确的是
您最近一年使用:0次
2019-09-29更新
|
186次组卷
|
7卷引用:贵州省遵义正安县一中2020届高三上学期开学考试化学试题
4 . 下列实验的操作、现象和结论都正确的是
| 选项 | 实验目的 | 实验操作及现象 | 结论 |
| A | 探究铁粉在氯气中燃烧所得固体粉末的成分 | 取少量固体粉末,加入2~3mL蒸馏水,振荡,迅速滴入几滴KSCN溶液,溶液不显红色 | 该固体粉末中不存在FeCl3 |
| B | 证明SO2具有漂白性 | 将SO2缓慢通入滴有酚酞的NaOH溶液中,溶液红色褪去 | SO2有漂白性 |
| C | 探究温度对化学平衡的影响 | 加热盛有CuCl2溶液的试管,溶液变为黄色,冷却后变为蓝色 | [Cu(H2O)4]2+转化为[CuCl4]2-的反应放热 |
| D | 探究Cl2的性质 | 将Cl2通入K2S溶液中,生成淡黄色沉淀 | Cl2具有氧化性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
5 . 菠菜富含膳食纤维、胡萝卜素、维生素c、维生素e、钙、磷、铁、等矿物质。14~18岁青少年每日合理摄入铁量为20~25mg,某化学小组针对菠菜中含铁量进行如下实验。
(一)实验目的:菠菜含铁量是否满足青少年日常所需
(二)实验方案:取适量新鲜菠菜平均分成三份,实验操作和现象记录如下:
(1)灼烧菠菜时,除了酒精灯还需要下列仪器中的_______ (填选项)。
A. B.
B. C.
C. D.
D. E.
E.
(2)写出实验三中 参与的最主要反应的离子方程式
参与的最主要反应的离子方程式_______ 。
(3)检验试剂KSCN溶液中的 采用
采用_______ 的方法。
(4)由三组实验做出如下推断,其中合理的是:_______(填选项)。
(三)实验数据:菠菜中含铁量的测定,实验步骤如下:
①取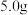 新鲜菠菜,充分灼烧,将灰分转移至干燥器中冷却。
新鲜菠菜,充分灼烧,将灰分转移至干燥器中冷却。
②向灰分中加入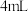 盐酸和
盐酸和 ,浸泡
,浸泡 ,过滤并用少量盐酸洗涤烧杯和沉淀,滤液和洗涤液合并;
,过滤并用少量盐酸洗涤烧杯和沉淀,滤液和洗涤液合并;
③将合并液定容成 待测液,利用分光光度法测得铁的浓度为
待测液,利用分光光度法测得铁的浓度为 。
。
根据上述实验,回答下列问题:
(5)步骤②洗涤烧杯和沉淀的目的是_______ 。
(6)步骤③定容操作若仰视容量瓶刻度线,会造成菠菜样品含铁量测定结果_______ 。(填“偏高”、“偏低”或“无影响”)。
(7)根据实验数据计算菠菜含铁量为_______ 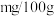 。
。
(四)实验结论:由于菠菜中含有大量草酸( )与铁元素形成沉淀影响铁元素吸收,所以不是理想的补铁剂。(附:猪肝每
)与铁元素形成沉淀影响铁元素吸收,所以不是理想的补铁剂。(附:猪肝每 中含铁量达到
中含铁量达到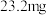 ,且容易被人体吸收。)
,且容易被人体吸收。)
(一)实验目的:菠菜含铁量是否满足青少年日常所需
(二)实验方案:取适量新鲜菠菜平均分成三份,实验操作和现象记录如下:
| 实验 | 操作步骤 | 检验试剂 | 现象 |
| 实验一 | 适量蒸馏水浸泡,过滤,取滤液,加检验试剂后加入适量 ,再次加入检验试剂 ,再次加入检验试剂 | KSCN溶液 | 均无明显现象 |
| 实验二 | 充分灼烧,加适量盐酸浸泡,取滤液,加检验试剂 | KSCN溶液 | 极浅的红色 |
| 实验三 | 充分灼烧,加适量盐酸、 浸泡,取滤液,加检验试剂 浸泡,取滤液,加检验试剂 | KSCN溶液 | 较深的红色 |
A.
 B.
B. C.
C. D.
D. E.
E.
(2)写出实验三中
 参与的最主要反应的离子方程式
参与的最主要反应的离子方程式(3)检验试剂KSCN溶液中的
 采用
采用(4)由三组实验做出如下推断,其中合理的是:_______(填选项)。
| A.菠菜样品中含铁量极低 | B.菠菜中的铁元素很难用蒸馏水直接溶出 |
| C.仅用盐酸无法溶出菠菜灰分中的铁元素 | D.灼烧的目的是将菠菜中的铁元素氧化 |
(三)实验数据:菠菜中含铁量的测定,实验步骤如下:
①取
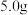 新鲜菠菜,充分灼烧,将灰分转移至干燥器中冷却。
新鲜菠菜,充分灼烧,将灰分转移至干燥器中冷却。②向灰分中加入
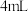 盐酸和
盐酸和 ,浸泡
,浸泡 ,过滤并用少量盐酸洗涤烧杯和沉淀,滤液和洗涤液合并;
,过滤并用少量盐酸洗涤烧杯和沉淀,滤液和洗涤液合并;③将合并液定容成
 待测液,利用分光光度法测得铁的浓度为
待测液,利用分光光度法测得铁的浓度为 。
。根据上述实验,回答下列问题:
(5)步骤②洗涤烧杯和沉淀的目的是
(6)步骤③定容操作若仰视容量瓶刻度线,会造成菠菜样品含铁量测定结果
(7)根据实验数据计算菠菜含铁量为
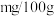 。
。(四)实验结论:由于菠菜中含有大量草酸(
 )与铁元素形成沉淀影响铁元素吸收,所以不是理想的补铁剂。(附:猪肝每
)与铁元素形成沉淀影响铁元素吸收,所以不是理想的补铁剂。(附:猪肝每 中含铁量达到
中含铁量达到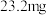 ,且容易被人体吸收。)
,且容易被人体吸收。)
您最近一年使用:0次
2023-03-02更新
|
610次组卷
|
4卷引用:贵州省遵义市南白中学2022-2023学年高一下学期第一次联考化学试题
6 . 下列实验中,对应的现象以及实验目的都正确的是
| 选项 | 目的 | 实验 | 现象 |
| A | 检验CO2气体中混有SO2 | 将气体通入盛有足量的澄清石灰水中的洗气瓶中 | 石灰水变浑浊 |
| B | 检验黑色固体Fe3O4中含有+3价铁元素 | 将少量黑色固体加入盛有KSCN溶液的烧杯中 | 固体溶解,溶液呈血红色 |
| C | 比较氯和碳的非金属性强弱 | 将碳酸钠溶液中滴入稀盐酸 | 有气泡产生 |
| D | 验证氧化性:Fe3+>Cu2+ | 将一定量铜粉加到盛有一定体积的1.0mol•L﹣1Fe2(SO4)3溶液的试管中 | 铜粉溶解,溶液变蓝色 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
7 . 下列实验操作能达到实验目的的是
| 选项 | 实验目的 | 实验操作 |
| A | 检验补铁剂硫酸亚铁片是否被氧化 | 将K3[Fe(CN)6]溶液滴入硫酸亚铁片的水溶液 |
| B | 验证SO2的漂白性 | 将SO2通入溴水 |
| C | 检验洁厕剂的主要成分是盐酸 | 向待测液中滴加硝酸银溶液 |
| D | 制备少量的NH3 | 将浓氨水滴加到碱石灰上 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
8 . 柠檬酸亚铁(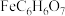 ,摩尔质量:246
,摩尔质量:246 )在食品工业中做营养增补剂,可用于乳制品等。一种用硫铁矿(成分为60%
)在食品工业中做营养增补剂,可用于乳制品等。一种用硫铁矿(成分为60%  、
、 、
、 及其他杂质)为原料来制备柠檬酸亚铁的流程如图所示:
及其他杂质)为原料来制备柠檬酸亚铁的流程如图所示:
①“焙烧”生成了铁红;
②常温下,柠檬酸(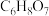 )是一种三元弱酸;
)是一种三元弱酸;
③“还原”时 发生的反应为
发生的反应为 。
。
请回答下列问题:
(1)焙烧时气体与矿料逆流而行,目的是________________ ,请写出焙烧过程中硫铁矿发生反应的化学方程式:_________________ 。
(2)滤渣1的主要成分是___________ (写化学式)。
(3)柠檬酸亚铁(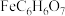 )是一种
)是一种___________ (填“正”“酸式”或“碱式”)盐。
(4)“沉铁”时需控制温度在32℃左右,温度不能过高的原因是________________ 。
(5)在制备过程中,若条件控制不当,容易生成 ,请写出检验
,请写出检验 所用试剂及现象:
所用试剂及现象:______________ 。
(6)某工厂用1kg硫铁矿经上述流程制得1.6kg柠檬酸亚铁,则柠檬酸亚铁的产率为________ (保留两位有效数字)。
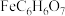 ,摩尔质量:246
,摩尔质量:246 )在食品工业中做营养增补剂,可用于乳制品等。一种用硫铁矿(成分为60%
)在食品工业中做营养增补剂,可用于乳制品等。一种用硫铁矿(成分为60%  、
、 、
、 及其他杂质)为原料来制备柠檬酸亚铁的流程如图所示:
及其他杂质)为原料来制备柠檬酸亚铁的流程如图所示:
①“焙烧”生成了铁红;
②常温下,柠檬酸(
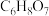 )是一种三元弱酸;
)是一种三元弱酸;③“还原”时
 发生的反应为
发生的反应为 。
。请回答下列问题:
(1)焙烧时气体与矿料逆流而行,目的是
(2)滤渣1的主要成分是
(3)柠檬酸亚铁(
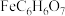 )是一种
)是一种(4)“沉铁”时需控制温度在32℃左右,温度不能过高的原因是
(5)在制备过程中,若条件控制不当,容易生成
 ,请写出检验
,请写出检验 所用试剂及现象:
所用试剂及现象:(6)某工厂用1kg硫铁矿经上述流程制得1.6kg柠檬酸亚铁,则柠檬酸亚铁的产率为
您最近一年使用:0次
名校
9 . I.如图是利用电化学装置将SO2转化为重要的化工原料H2SO4的原理示意图。
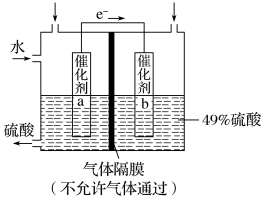
请回答下列问题:
(1)该装置将_______ 能转化为______ 能。
(2)催化剂b表面O2发生_______ 反应,其附近溶液酸性______ (填“增强”、“不变”或“减弱”)。
(3)催化剂a表面的电极反应式:_______ 。
II.某废料铁泥主要成分是Fe2O3、FeO和Fe,其他杂质不与硫酸反应。实验室用该废料提取Fe2O3,设计实验流程如图:

(4)步骤(I)充分反应后进行的实验操作名称是______ 。
(5)步骤(II)中加入H2O2溶液后需要适当加热但温度不能过高,原因是______ 。
(6)为了检验溶液B中是否有亚铁离子剩余,有同学提出只需要取少量溶液B于试管中并向其中滴加氢氧化钠溶液,然后观察现象即可证明。请你判断该同学的方法是否可行并说出理由______ 。
(7)步骤(III)中将NaOH溶液换成氨气也可以得到Fe(OH)3沉淀,反应的离子方程式为______ 。

请回答下列问题:
(1)该装置将
(2)催化剂b表面O2发生
(3)催化剂a表面的电极反应式:
II.某废料铁泥主要成分是Fe2O3、FeO和Fe,其他杂质不与硫酸反应。实验室用该废料提取Fe2O3,设计实验流程如图:

(4)步骤(I)充分反应后进行的实验操作名称是
(5)步骤(II)中加入H2O2溶液后需要适当加热但温度不能过高,原因是
(6)为了检验溶液B中是否有亚铁离子剩余,有同学提出只需要取少量溶液B于试管中并向其中滴加氢氧化钠溶液,然后观察现象即可证明。请你判断该同学的方法是否可行并说出理由
(7)步骤(III)中将NaOH溶液换成氨气也可以得到Fe(OH)3沉淀,反应的离子方程式为
您最近一年使用:0次
2023-05-19更新
|
712次组卷
|
2卷引用:贵州省遵义市仁怀市高中教育联盟2022-2023学年高一下学期5月期中考试化学试题
名校
解题方法
10 . 资料显示Fe2+呈淡绿色、Fe3+呈棕黄色、FeSO3是墨绿色沉淀Fe(OH)3胶体是红褐色液体。某高三老师在讲授“Fe3+的氧化性”时,组织学生进行探究实验。
(1)在课堂教学探究Na2SO3溶液与FeCl3溶液的实际反应时,同学们有以下猜想,请补充完整:
猜想一:Na2SO3溶液与FeCl3溶液发生氧化还原反应;
猜想二:Na2SO3溶液与FeCl3溶液发生双水解反应,产生了Fe(OH)3胶体;
猜想三:___________ 。
(2)甲同学认可猜想一,他预测的实验现象是_____ ,其反应的离子方程式为____ 。
老师安排甲同学做了如下实验i:
(3)乙同学观察实验现象后认为猜想二合理,并想用红色激光笔照射该红褐色液体以验证自己的猜想正确,他预测的现象是_____ 。实验发现,乙同学的猜想成立,反应的离子方程式为_____ 。
(4)针对“氧化还原反应有没有发生”,老师组织同学们讨论,同学们思考得出以下检验方案:
方案①:取少量W液体,加铁氰化钾溶液,检验是否有Fe2+
方案②:取少量W液体,加酸性高锰酸钾溶液,检验是否有Fe2+
方案③:取少量W液体,加盐酸酸化,再加氯化钡溶液,检验是否有
你认为方案②______ (填“合理”或“不合理”),你的理由是______ 。
甲同学在老师的指导下迅速完成了实验ii:
乙同学也在老师的指导下完成了方案①的操作,发现有蓝色沉淀生成。
通过实验探究,大家认识到Fe3+与 的反应体系中,氧化还原反应与水解反应不仅共存还存在竞争。
的反应体系中,氧化还原反应与水解反应不仅共存还存在竞争。
(1)在课堂教学探究Na2SO3溶液与FeCl3溶液的实际反应时,同学们有以下猜想,请补充完整:
猜想一:Na2SO3溶液与FeCl3溶液发生氧化还原反应;
猜想二:Na2SO3溶液与FeCl3溶液发生双水解反应,产生了Fe(OH)3胶体;
猜想三:
(2)甲同学认可猜想一,他预测的实验现象是
老师安排甲同学做了如下实验i:
| 装置 | 操作 | 现象 |
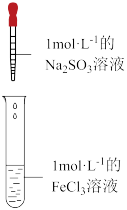 | 向2mL1mol•L-1的FeCl3溶液中,逐滴滴加2mL1mol•L-1的Na2SO3溶液 | 溶液黄色逐渐加深,最终得到红褐色液体(W) |
(4)针对“氧化还原反应有没有发生”,老师组织同学们讨论,同学们思考得出以下检验方案:
方案①:取少量W液体,加铁氰化钾溶液,检验是否有Fe2+
方案②:取少量W液体,加酸性高锰酸钾溶液,检验是否有Fe2+
方案③:取少量W液体,加盐酸酸化,再加氯化钡溶液,检验是否有

你认为方案②
甲同学在老师的指导下迅速完成了实验ii:
| 装置 | 操作 | 现象 |
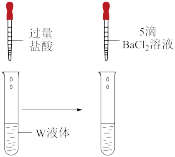 | 取1mLW液体于试管中,滴加过量盐酸,再滴加5滴BaCl2溶液 | 产生白色沉淀 |
通过实验探究,大家认识到Fe3+与
 的反应体系中,氧化还原反应与水解反应不仅共存还存在竞争。
的反应体系中,氧化还原反应与水解反应不仅共存还存在竞争。
您最近一年使用:0次
2020-12-01更新
|
323次组卷
|
2卷引用:贵州省罗甸县边阳中学2022届高三模拟测试化学试题

 晶体是否已经氧化变质
晶体是否已经氧化变质 中,滴加几滴KSCN溶液,观察溶液是否变红
中,滴加几滴KSCN溶液,观察溶液是否变红
 胶体
胶体 溶液滴加到煮沸的蒸馏水中,继续煮沸至液体呈红褐色为止
溶液滴加到煮沸的蒸馏水中,继续煮沸至液体呈红褐色为止 溶液的pH
溶液的pH 的酸性强弱
的酸性强弱

