名校
1 . 下列关于物质的性质对应用途的说法错误的是
A.高铁酸钾 具有强氧化性,能杀菌消毒,所以可以用作消毒剂 具有强氧化性,能杀菌消毒,所以可以用作消毒剂 |
B. 具有很强的毒性,所以不能用于自来水的杀菌消毒 具有很强的毒性,所以不能用于自来水的杀菌消毒 |
C. 溶液显血红色,所以可以在影视剧中用作替代血液的道具 溶液显血红色,所以可以在影视剧中用作替代血液的道具 |
| D.钛合金因为其生物相容性好,所以可以用作人造骨骼 |
您最近一年使用:0次
2024-02-20更新
|
142次组卷
|
2卷引用:重庆市巴蜀中学校2023-2024学年高一上学期1月期末化学试题
2 . 由下列实验操作及现象不能够得出相应结论的是
| 选项 | 操作 | 现象 | 结论 |
| A | 将石墨电极放入NaCl溶液中,连接小灯泡,接通电源 | 小灯泡变亮 | NaCl是电解质 |
| B | 向澄清的苯酚钠溶液中通入CO2气体 | 溶液变浑浊 | 苯酚的酸性比碳酸弱 |
| C | 把水滴入盛有少量Na2O2的试管中,立即把带火星木条放在试管口 | 木条复燃 | 反应生成了O2 |
| D | 向可能含有Fe2+的FeCl3溶液中加入酸性KMnO4溶液 | 酸性 KMnO4溶液褪色 | FeCl3溶液中混有Fe2+杂质离子 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
3 . 下列过程中的化学反应,有关离子方程式书写正确的是
A.向 溶液中滴加少量 溶液中滴加少量 溶液: 溶液: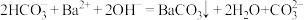 |
B.过量铁粉加入稀硝酸中: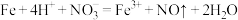 |
C. 溶于 溶于 溶液: 溶液: |
D.向纯碱溶液中滴加少量盐酸: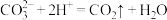 |
您最近一年使用:0次
2023-09-10更新
|
381次组卷
|
3卷引用:重庆市巴蜀中学校2022-2023学年高一下学期3月月考化学试题
名校
解题方法
4 . 已知离子氧化性:Fe3+>Cu2+>Fe2+>Zn2+,在溶有Fe2(SO4)3和CuSO4的溶液中加入锌粉,下列说法中不正确的是
| A.若锌粉有剩余,则溶液中的金属阳离子只有Zn2+ |
| B.若锌粉有剩余,则不溶物中一定有铜,可能有铁 |
| C.若固体仅有铜单质,则溶液中可能有Cu2+,则一定有Fe2+、Zn2+,一定无Fe3+ |
| D.若固体有铁单质,则溶液中无Cu2+,一定有Zn2+,-定无Fe3+,但下能确定有无Fe2+ |
您最近一年使用:0次
2023-02-04更新
|
466次组卷
|
2卷引用:重庆市巴蜀中学校2022-2023学年高一上学期期末考试化学试题
名校
解题方法
5 . 根据实验目的,下列方案设计、现象和结论不正确的是
| 选项 | 实验目的 | 方案设计 | 现象和结论 |
| A | 验证NaCl、Na2SO4混合溶液中的Cl- | 取少量混合溶液于试管中,加入过量的Ba(NO3)2溶液,静置,向上层清液中滴加AgNO3溶液 | 若上层清液变浑浊,则混合溶液中含有Cl- |
| B | 探究碳酸钠溶液显碱性是由 水解导致 水解导致 | 取2.0mL0.1 mol∙L-1Na2CO3溶液,滴入3滴酚酞,观察现象,再滴入几滴1mol/L BaCl2溶液 | 滴入酚酞溶液变红,再滴入BaCl2后出现白色沉淀,溶液颜色变浅 |
| C | 探究铝在浓硝酸中会发生钝化 | 将去除氧化膜的铝片放入浓硝酸中,一段时间后取出用水洗净,放入硫酸铜溶液 | 铝片表面未见紫红色固体,说明铝片已钝化 |
| D | 证明氧化性:Cl2>Fe3+> | 向2支盛有FeCl2溶液的试管中分别通入氯气。向其中一支滴加KSCN溶液,向另一支依次滴加H2SO3溶液和BaCl2溶液 | 第一支试管中溶液变成血红色,第二支试管中产生白色沉淀,则证明氧化性:Cl2>Fe3+> |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
6 . 部分含铁物质的分类与相应化合价关系如图所示。下列推断正确的是
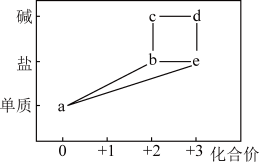

| A.不能通过化合反应制备b |
| B.实验室可用电解法制备c |
| C.a与水蒸气反应可生成d和氢气 |
D.实验室检验e溶液,只能用 溶液 溶液 |
您最近一年使用:0次
名校
解题方法
7 . 实验室制溴苯的原理为 +Br2
+Br2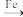
 +HBr,某实验小组按如图所示流程模拟提纯粗溴苯。
+HBr,某实验小组按如图所示流程模拟提纯粗溴苯。
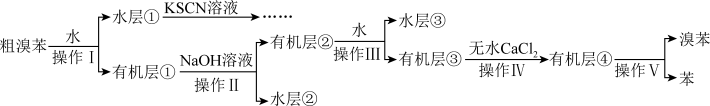
已知:①溴苯与苯互溶;
②各物质的沸点如下:
下列说法正确的是
 +Br2
+Br2
 +HBr,某实验小组按如图所示流程模拟提纯粗溴苯。
+HBr,某实验小组按如图所示流程模拟提纯粗溴苯。
已知:①溴苯与苯互溶;
②各物质的沸点如下:
| 苯 | 液溴 | 溴苯 | |
| 沸点 | 80℃ | 59℃ | 156℃ |
| A.水层①中加入KSCN溶液变红,说明溴化铁已完全被除尽 |
| B.水层②中含有两种盐 |
| C.操作II是分液,操作V是重结晶 |
| D.操作I、IV用到的玻璃仪器不重复 |
您最近一年使用:0次
名校
解题方法
8 . 由下列实验内容能得到相应结论的是
| 选项 | 实验内容 | 实验结论 |
| A | 测定同温度下同浓度的碳酸钠和硫酸钠溶液的pH,比较大小 | 碳元素和硫元素的非金属性强弱 |
| B | 向新制氢氧化铜悬浊液中滴加蔗糖溶液,加热,观察现象 | 蔗糖中含有醛基 |
| C | 向某黄色溶液中加入淀粉KI溶液,溶液变蓝 | 溶液中含有Fe3+ |
| D | 电流通过AlCl3溶液时,可以导电 | AlCl3是离子化合物 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
9 . 铁是应用泛的金属之一,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)某课题小组采用离子交换和滴定的方法来测定铁的某氯化物 的化学式。实验中称取0.54g的
的化学式。实验中称取0.54g的 样品,溶解后先进行阳离子交换预处理,再通过含有饱和
样品,溶解后先进行阳离子交换预处理,再通过含有饱和 的阴离子交换柱,使
的阴离子交换柱,使 和
和 发生交换。交换完成后,流出溶液的
发生交换。交换完成后,流出溶液的 用
用 的盐酸滴定,滴定至终点时消耗盐酸25.00mL。通过计算求出
的盐酸滴定,滴定至终点时消耗盐酸25.00mL。通过计算求出 中x的值为
中x的值为_________ (取整数)。
(2)在实验室中,FeCl2可用铁粉和_________ 反应制备,FeCl3可用铁粉和_________ 反应制备。现有一瓶FeCl2溶液,某同学欲检验该溶液是否已经变质,首先取适量溶液于洁净的试管中,然后向溶液中滴加几滴______________ ,观察溶液是否变成红色即可得出结论。
(3)FeCl3与氢碘酸混合时有棕色物质生成,写出该反应的离子方程式:________ ;工业上还可以用FeCl3溶液来腐蚀印刷电路板上的铜,向反应所得的溶液中加入一定量的锌粉充分反应后,从理论上分析,下列说法合理的是____________ 。(填序号)。
A.若无固体剩余,则溶液中可能含有 、
、 、
、 、
、 四种离子
四种离子
B.若溶液中有 ,则体系中一定没有固体剩余
,则体系中一定没有固体剩余
C.若有固体剩余,则溶液中一定有反应 发生
发生
D.当溶液中有 存在时,则一定没有
存在时,则一定没有 析出
析出
(4)高铁酸钾( )是一种强氧化剂,可作为水处理剂和高容量电池的电极材料。在
)是一种强氧化剂,可作为水处理剂和高容量电池的电极材料。在 中铁元素的化合价为
中铁元素的化合价为_________ , 与
与 在强碱性条件下反应可制取
在强碱性条件下反应可制取 ,其反应的离子方程式为
,其反应的离子方程式为________ 。
(1)某课题小组采用离子交换和滴定的方法来测定铁的某氯化物
 的化学式。实验中称取0.54g的
的化学式。实验中称取0.54g的 样品,溶解后先进行阳离子交换预处理,再通过含有饱和
样品,溶解后先进行阳离子交换预处理,再通过含有饱和 的阴离子交换柱,使
的阴离子交换柱,使 和
和 发生交换。交换完成后,流出溶液的
发生交换。交换完成后,流出溶液的 用
用 的盐酸滴定,滴定至终点时消耗盐酸25.00mL。通过计算求出
的盐酸滴定,滴定至终点时消耗盐酸25.00mL。通过计算求出 中x的值为
中x的值为(2)在实验室中,FeCl2可用铁粉和
(3)FeCl3与氢碘酸混合时有棕色物质生成,写出该反应的离子方程式:
A.若无固体剩余,则溶液中可能含有
 、
、 、
、 、
、 四种离子
四种离子B.若溶液中有
 ,则体系中一定没有固体剩余
,则体系中一定没有固体剩余C.若有固体剩余,则溶液中一定有反应
 发生
发生D.当溶液中有
 存在时,则一定没有
存在时,则一定没有 析出
析出(4)高铁酸钾(
 )是一种强氧化剂,可作为水处理剂和高容量电池的电极材料。在
)是一种强氧化剂,可作为水处理剂和高容量电池的电极材料。在 中铁元素的化合价为
中铁元素的化合价为 与
与 在强碱性条件下反应可制取
在强碱性条件下反应可制取 ,其反应的离子方程式为
,其反应的离子方程式为
您最近一年使用:0次
10 . 以硫铁矿(主要成分为 ,还有少量
,还有少量 、
、 等杂质)为原料制备绿矾晶体
等杂质)为原料制备绿矾晶体 的工艺流程如下:
的工艺流程如下:
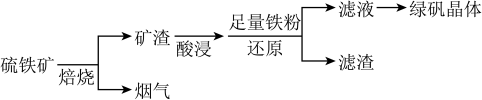
(1)“酸浸”过程,矿渣中的 与稀
与稀 反应的离子方程式
反应的离子方程式____________________ 。
(2)烟气中的 会污染环境,可用足量氨水吸收。写出该反应的离子方程式
会污染环境,可用足量氨水吸收。写出该反应的离子方程式____________________________ 。
(3)写出检验滤液中阴离子的方法___________________________ 。
(4)铁粉还原过滤,滤渣主要成分是___________________________ (写化学式)。
(5)燃料细菌脱硫法是用氧化亚铁硫杄菌(T.f)对硫铁矿进行催化脱硫,同时得到 溶液。其过程如图所示:
溶液。其过程如图所示:
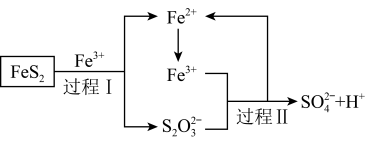
已知总反应为: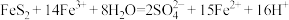
写出过程Ⅱ反应的离子方程式________________________________ 。
 ,还有少量
,还有少量 、
、 等杂质)为原料制备绿矾晶体
等杂质)为原料制备绿矾晶体 的工艺流程如下:
的工艺流程如下:
(1)“酸浸”过程,矿渣中的
 与稀
与稀 反应的离子方程式
反应的离子方程式(2)烟气中的
 会污染环境,可用足量氨水吸收。写出该反应的离子方程式
会污染环境,可用足量氨水吸收。写出该反应的离子方程式(3)写出检验滤液中阴离子的方法
(4)铁粉还原过滤,滤渣主要成分是
(5)燃料细菌脱硫法是用氧化亚铁硫杄菌(T.f)对硫铁矿进行催化脱硫,同时得到
 溶液。其过程如图所示:
溶液。其过程如图所示:
已知总反应为:
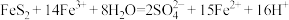
写出过程Ⅱ反应的离子方程式
您最近一年使用:0次
2020-02-26更新
|
609次组卷
|
7卷引用:重庆复旦中学2020-2021学年高一下学期(高2023届)期中考试化学试题



