名校
解题方法
1 . I.无水 可用作有机合成的催化剂、食品膨松剂等。工业上可由铝土矿(主要成分是
可用作有机合成的催化剂、食品膨松剂等。工业上可由铝土矿(主要成分是 和
和 )和焦炭制备,流程如下:
)和焦炭制备,流程如下:

已知: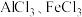 分别在
分别在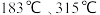 时升华,完成下列填空:
时升华,完成下列填空:
(1)氯化炉中 和焦炭在高温下发生反应的化学方程式为
和焦炭在高温下发生反应的化学方程式为___________ 。
(2)升华器中主要含有 和
和 ,需加入少量
,需加入少量 ,其作用是
,其作用是___________ 。
(3) 时,升华器中物质经充分反应后需降温实现
时,升华器中物质经充分反应后需降温实现 和
和 的分离。请选择合适的温度范围
的分离。请选择合适的温度范围___________ 。
a.低于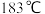 b.介于
b.介于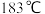 和
和 之间 c.高于
之间 c.高于
(4)欲证明 样品含有
样品含有 ,可采用的方法是
,可采用的方法是___________ 。
II.样品(含少量 )中
)中 含量可通过下列操作测得(部分物质略去)
含量可通过下列操作测得(部分物质略去)

(5)加入过量氢氧化钠涉及的离子方程式为___________ 。
(6)计算该样品中 的质量分数
的质量分数___________ (结果用m、n表示,不必化简)。
(7)取纯化后 配成溶液,向
配成溶液,向 的
的 溶液中滴加
溶液中滴加 的
的 溶液
溶液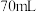 时,生成沉淀
时,生成沉淀___________ g。
 可用作有机合成的催化剂、食品膨松剂等。工业上可由铝土矿(主要成分是
可用作有机合成的催化剂、食品膨松剂等。工业上可由铝土矿(主要成分是 和
和 )和焦炭制备,流程如下:
)和焦炭制备,流程如下:
已知:
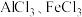 分别在
分别在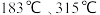 时升华,完成下列填空:
时升华,完成下列填空:(1)氯化炉中
 和焦炭在高温下发生反应的化学方程式为
和焦炭在高温下发生反应的化学方程式为(2)升华器中主要含有
 和
和 ,需加入少量
,需加入少量 ,其作用是
,其作用是(3)
 时,升华器中物质经充分反应后需降温实现
时,升华器中物质经充分反应后需降温实现 和
和 的分离。请选择合适的温度范围
的分离。请选择合适的温度范围a.低于
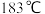 b.介于
b.介于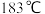 和
和 之间 c.高于
之间 c.高于
(4)欲证明
 样品含有
样品含有 ,可采用的方法是
,可采用的方法是II.样品(含少量
 )中
)中 含量可通过下列操作测得(部分物质略去)
含量可通过下列操作测得(部分物质略去)
(5)加入过量氢氧化钠涉及的离子方程式为
(6)计算该样品中
 的质量分数
的质量分数(7)取纯化后
 配成溶液,向
配成溶液,向 的
的 溶液中滴加
溶液中滴加 的
的 溶液
溶液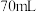 时,生成沉淀
时,生成沉淀
您最近一年使用:0次
名校
解题方法
2 . 某研究性学习小组探究FeSO4的化学性质并测定某药片中FeSO4的含量,回答下列问题。
(1)探究FeSO4溶液的酸碱性。实验测得FeSO4溶液呈_______ (填“酸性”、“中性”、“碱性”)。
(2)利用如图装置探究FeSO4的稳定性。

(2)已知:绿矾为FeSO4·7H2O晶体,受热分解产物为4种氧化物。
①实验中观察到Ⅰ中固体逐渐变为红棕色,Ⅱ中有白色沉淀生成。Ⅱ中现象表明绿矾分解产物有_______ (填化学式)。
②预测Ⅲ中现象为_______ ,设计实验证明Ⅲ中现象有可逆性,操作和现象为:取少量Ⅲ中溶液于试管中,_______ 。
③Ⅳ中NaOH溶液的作用是吸收尾气,防止污染空气。反应的化学方程式为_______ 。
(3)缺铁性贫血往往口服主要成分为FeSO4的药片。现用氧化还原滴定法测定某品牌药片中FeSO4含量,反应原理为:MnO +5Fe2+ +8H+ =Mn2+ +5Fe3+ +4H2O。称取8.0g药片,剥掉表面糖衣,将药片捣碎,配成100mL溶液,用KMnO4溶液滴定。
+5Fe2+ +8H+ =Mn2+ +5Fe3+ +4H2O。称取8.0g药片,剥掉表面糖衣,将药片捣碎,配成100mL溶液,用KMnO4溶液滴定。
该药片中FeSO4的质量分数为_______ ,若盛装KMnO4溶液的滴定管用蒸馏水洗净后没有润洗,则测定结果将_______ 。(填“偏大”、“偏小”、“不变”)。
(1)探究FeSO4溶液的酸碱性。实验测得FeSO4溶液呈
(2)利用如图装置探究FeSO4的稳定性。

(2)已知:绿矾为FeSO4·7H2O晶体,受热分解产物为4种氧化物。
①实验中观察到Ⅰ中固体逐渐变为红棕色,Ⅱ中有白色沉淀生成。Ⅱ中现象表明绿矾分解产物有
②预测Ⅲ中现象为
③Ⅳ中NaOH溶液的作用是吸收尾气,防止污染空气。反应的化学方程式为
(3)缺铁性贫血往往口服主要成分为FeSO4的药片。现用氧化还原滴定法测定某品牌药片中FeSO4含量,反应原理为:MnO
 +5Fe2+ +8H+ =Mn2+ +5Fe3+ +4H2O。称取8.0g药片,剥掉表面糖衣,将药片捣碎,配成100mL溶液,用KMnO4溶液滴定。
+5Fe2+ +8H+ =Mn2+ +5Fe3+ +4H2O。称取8.0g药片,剥掉表面糖衣,将药片捣碎,配成100mL溶液,用KMnO4溶液滴定。| 滴定次数 | 待测FeSO4溶液体积/mL | 0.1000 mol/LKMnO4溶液体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 25.11 |
| 2 | 25.00 | 0.56 | 30.56 |
| 3 | 25.00 | 0.22 | 25.11 |
您最近一年使用:0次
3 . 工业上,处理低品位黄铜矿[二硫化亚铁铜(CuFeS2)含量较低]常采用生物堆浸法。堆浸所得的溶液可用于制备绿矾(FeSO4·7H2O)和胆矾(CuSO4·5H2O)。相关流程如下图。
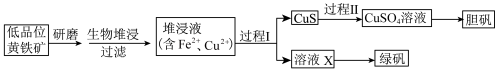
已知:①生物堆浸使用的氧化亚铁硫杆菌(T.f细菌)在pH 1.0~6.0范围内可保持活性。
②金属离子沉淀的pH如下表。
(1)生物堆浸前,需先将矿石进行研磨,目的是__________________ 。
(2)生物堆浸过程的反应在T.f细菌的作用下进行,主要包括两个阶段,第一阶段的反应为:CuFeS2 +4H+ +O2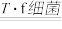 Cu2+ Fe2++ 2S+ 2H2O,第二阶段的反应为Fe2+继续被氧化转变成Fe3+,反应的离子方程式为
Cu2+ Fe2++ 2S+ 2H2O,第二阶段的反应为Fe2+继续被氧化转变成Fe3+,反应的离子方程式为__________ 。
(3)结合已知推断:生物堆浸过程中,应控制溶液的pH在__________ 范围内。
(4)过程I中,加入Na2S2O3固体会还原堆浸液中的Fe3+, 得到溶液X。为判断堆浸液中Fe3+是否被还原完全,可取少量溶液X,向其中加入_____________ 试剂(填试剂的化学式),观察溶液颜色变化。
(5)过程II中,用H2O2和稀硫酸处理后,CuS完全溶解 ,用离子方程式表示H2O2的作用是________ 。
(6)绿矾的纯度可通过KMnO4滴定法测定。取m g绿矾晶体,加适量稀硫酸溶解。用物质的量浓度为c mol/L的KMnO4溶液滴定。至恰好完全反应时,消耗KMnO4溶液的体积为V mL。绿矾晶体质量分数的计算式为______ 。(已知: FeSO4•7H2O的摩尔质量为278 g/mol )

已知:①生物堆浸使用的氧化亚铁硫杆菌(T.f细菌)在pH 1.0~6.0范围内可保持活性。
②金属离子沉淀的pH如下表。
| Fe3+ | Cu2+ | Fe2+ | |
| 开始沉淀时的pH | 1.5 | 4.2 | 6.3 |
| 完全沉淀时的pH | 2.8 | 6.7 | 8.3 |
(2)生物堆浸过程的反应在T.f细菌的作用下进行,主要包括两个阶段,第一阶段的反应为:CuFeS2 +4H+ +O2
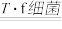 Cu2+ Fe2++ 2S+ 2H2O,第二阶段的反应为Fe2+继续被氧化转变成Fe3+,反应的离子方程式为
Cu2+ Fe2++ 2S+ 2H2O,第二阶段的反应为Fe2+继续被氧化转变成Fe3+,反应的离子方程式为(3)结合已知推断:生物堆浸过程中,应控制溶液的pH在
(4)过程I中,加入Na2S2O3固体会还原堆浸液中的Fe3+, 得到溶液X。为判断堆浸液中Fe3+是否被还原完全,可取少量溶液X,向其中加入
(5)过程II中,用H2O2和稀硫酸处理后,CuS
(6)绿矾的纯度可通过KMnO4滴定法测定。取m g绿矾晶体,加适量稀硫酸溶解。用物质的量浓度为c mol/L的KMnO4溶液滴定。至恰好完全反应时,消耗KMnO4溶液的体积为V mL。绿矾晶体质量分数的计算式为
您最近一年使用:0次
2020-11-06更新
|
453次组卷
|
3卷引用:北京市海淀区2021届高三上学期期中考试化学试题
19-20高三·浙江·阶段练习
解题方法
4 . K3[ Fe(C2O4)3]·3H2O(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。回答下列问题:
(1)某小组为探究三草酸合铁酸钾的热分解产物,按如图所示装置进行实验。

①反应开始前通入氮气的目的是___________________________________ 。
②实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断装置A中反应一 定生成了气体___________________ 、___________________ 。
③样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验Fe2O3存在的方法是_______________________________________________ 。
(2)测定三草酸合铁酸钾中铁的含量。
步骤一:称量5.40g三草酸合铁酸钾样品,配制成250mL溶液。
步骤二:用移液管移取所配溶液25.00 mL于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根离子恰好全部被氧化成二氧化碳,同时,MnO4- 被还原成Mn2+。向反应后的溶液中加入过量锌粉使Fe3+全部转化为Fe2+ ,过滤、洗涤,将滤液及洗涤液收集到锥形瓶中。
步骤三:向上述收集到的溶液中加稀H2SO4, 用0.010 mol·L-1KMnO4溶液滴定该溶液至终点,消耗KMnO4溶液21.98 mL,反应中 被还原成Mn2+。
被还原成Mn2+。
步骤四:重复步骤二、步骤三操作,其中步骤三滴定时消耗0.010mol·L-1KMnO4溶液22.02mL。
①配制三草酸合铁酸钾溶液的操作依次是:称量、溶解、冷却、移液、洗涤、_____ 、摇匀。
②步骤二中判断滴定至终点依据的现象是_____________________________________ 。
③实验测得该样品中铁的质量分数为_________________________ 。
(3)配合物的稳定性可以用稳定常数K来衡量,如Cu2++4NH3 [Cu(NH3)4]2+,其稳定常数的表达式为K=
[Cu(NH3)4]2+,其稳定常数的表达式为K=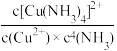 。已知某温度下,K{[Fe(C2O4)3]3-}=1020, K[ Fe(SCN)3]=2×103,能否用KSCN溶液直接检验K3[Fe(C2O4)3] ·3H2O中的铁元素?
。已知某温度下,K{[Fe(C2O4)3]3-}=1020, K[ Fe(SCN)3]=2×103,能否用KSCN溶液直接检验K3[Fe(C2O4)3] ·3H2O中的铁元素? _________ (填“是”或“否”)。,
(1)某小组为探究三草酸合铁酸钾的热分解产物,按如图所示装置进行实验。

①反应开始前通入氮气的目的是
②实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断装置A中反应一 定生成了气体
③样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验Fe2O3存在的方法是
(2)测定三草酸合铁酸钾中铁的含量。
步骤一:称量5.40g三草酸合铁酸钾样品,配制成250mL溶液。
步骤二:用移液管移取所配溶液25.00 mL于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根离子恰好全部被氧化成二氧化碳,同时,MnO4- 被还原成Mn2+。向反应后的溶液中加入过量锌粉使Fe3+全部转化为Fe2+ ,过滤、洗涤,将滤液及洗涤液收集到锥形瓶中。
步骤三:向上述收集到的溶液中加稀H2SO4, 用0.010 mol·L-1KMnO4溶液滴定该溶液至终点,消耗KMnO4溶液21.98 mL,反应中
 被还原成Mn2+。
被还原成Mn2+。步骤四:重复步骤二、步骤三操作,其中步骤三滴定时消耗0.010mol·L-1KMnO4溶液22.02mL。
①配制三草酸合铁酸钾溶液的操作依次是:称量、溶解、冷却、移液、洗涤、
②步骤二中判断滴定至终点依据的现象是
③实验测得该样品中铁的质量分数为
(3)配合物的稳定性可以用稳定常数K来衡量,如Cu2++4NH3
 [Cu(NH3)4]2+,其稳定常数的表达式为K=
[Cu(NH3)4]2+,其稳定常数的表达式为K=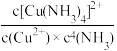 。已知某温度下,K{[Fe(C2O4)3]3-}=1020, K[ Fe(SCN)3]=2×103,能否用KSCN溶液直接检验K3[Fe(C2O4)3] ·3H2O中的铁元素?
。已知某温度下,K{[Fe(C2O4)3]3-}=1020, K[ Fe(SCN)3]=2×103,能否用KSCN溶液直接检验K3[Fe(C2O4)3] ·3H2O中的铁元素?
您最近一年使用:0次
名校
5 . 聚合硫酸铁[Fex(OH)y(SO4)z]m简称PFS,是一种高效絮凝剂,广泛用于水的净化,其中铁元素为+3价。
(1)聚合硫酸铁PFS化学式中x、y、z之间的等量关系式是___________ 。
(2)用聚合硫酸铁PFS进行模拟净化高岭土废水(用高岭土与自来水配制而成,其中质量浓度为100 mg·L-1)。该高岭土废水净化效果(即浊度去除率)受絮凝剂的投加量及pH的影响如下左右图所示:
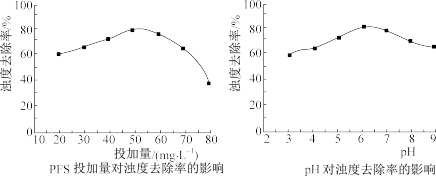
可知聚合硫酸铁PFS最佳投加量是___________ ,最佳pH是___________ 。
(3)已知:①聚合硫酸铁一等品质总铁含量性能指标要求:铁的质量分数大于11.0%。
②MnO +5Fe2++8H+=Mn2++5Fe3++4H2O
+5Fe2++8H+=Mn2++5Fe3++4H2O
为测定某聚合硫酸铁样品中铁的含量是否达到一级品质指标要求,进行如下实验:
a.准确称取1.500 g该聚合硫酸铁样品溶于适量硫酸,配成100.00 mL溶液A。
b.准确量取20.00 mL溶液A,加入足量铜粉,充分反应后过滤、洗涤,将滤液和洗涤的滤出液合并配成溶液B。
c 用0.0100 mol·L-1的酸性KMnO4溶液滴加到溶液B中至恰好反应完全,消耗酸性KMnO4溶液13.20 mL。
请通过计算确定该聚合硫酸铁样品中铁的含量是否符合指标要求_________ (写出计算过程)。
(1)聚合硫酸铁PFS化学式中x、y、z之间的等量关系式是
(2)用聚合硫酸铁PFS进行模拟净化高岭土废水(用高岭土与自来水配制而成,其中质量浓度为100 mg·L-1)。该高岭土废水净化效果(即浊度去除率)受絮凝剂的投加量及pH的影响如下左右图所示:

可知聚合硫酸铁PFS最佳投加量是
(3)已知:①聚合硫酸铁一等品质总铁含量性能指标要求:铁的质量分数大于11.0%。
②MnO
 +5Fe2++8H+=Mn2++5Fe3++4H2O
+5Fe2++8H+=Mn2++5Fe3++4H2O为测定某聚合硫酸铁样品中铁的含量是否达到一级品质指标要求,进行如下实验:
a.准确称取1.500 g该聚合硫酸铁样品溶于适量硫酸,配成100.00 mL溶液A。
b.准确量取20.00 mL溶液A,加入足量铜粉,充分反应后过滤、洗涤,将滤液和洗涤的滤出液合并配成溶液B。
c 用0.0100 mol·L-1的酸性KMnO4溶液滴加到溶液B中至恰好反应完全,消耗酸性KMnO4溶液13.20 mL。
请通过计算确定该聚合硫酸铁样品中铁的含量是否符合指标要求
您最近一年使用:0次
名校
解题方法
6 . 某校化学兴趣小组实验室模拟工业制备硫氰化钾(KSCN)。实验装置如图:
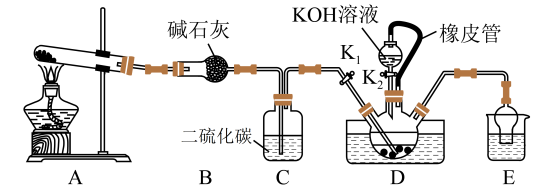
实验步骤如下:
(1)制备 NH4SCN 溶液:CS2+2NH3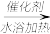 NH4SCN+H2S。该反应比较缓慢。
NH4SCN+H2S。该反应比较缓慢。
①实验前,应进行的操作是_____ 。三颈烧瓶内盛放有 CS2、水和催化剂, 三颈烧瓶的下层 CS2液体必须浸没导气管口,目的是______ 。
②实验开始时打开 K1,加热装置 A、D,缓缓地向装置 D 中充入气体。装置 A 的试管中发生的化学反应方程式为____ ,装置 C 的作用可能是_____ 。
(2)制备 KSCN 溶液:移去 A 处的酒精灯,关闭 K1,打开 K2,利用耐碱分液漏斗边加液边加热,则此时装置D 中发生反应的化学方程式是_____ 。
(3)制备 KSCN晶体:先滤去三颈烧瓶中的固体催化剂,再减压蒸发浓缩,________ , 过滤,洗涤,干燥,得到硫氰化钾晶体。
(4)测定 KSCN 的含量称取 10.0g 样品配成 1000mL 溶液量取 20.00mL 于锥形瓶中,并加入几滴 Fe(NO3)3溶液,用 0.1000mol/LAgNO3标准溶液滴定,达到滴定终点时消 AgNO3标准溶液 20.00mL。
①滴定时发生的离子反应为 SCN-+Ag+= AgSCN↓,则刚好沉淀完时的锥形瓶中颜色变化是_______ 。
②KSCN 的质量分数为___________ 。

实验步骤如下:
(1)制备 NH4SCN 溶液:CS2+2NH3
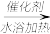 NH4SCN+H2S。该反应比较缓慢。
NH4SCN+H2S。该反应比较缓慢。①实验前,应进行的操作是
②实验开始时打开 K1,加热装置 A、D,缓缓地向装置 D 中充入气体。装置 A 的试管中发生的化学反应方程式为
(2)制备 KSCN 溶液:移去 A 处的酒精灯,关闭 K1,打开 K2,利用耐碱分液漏斗边加液边加热,则此时装置D 中发生反应的化学方程式是
(3)制备 KSCN晶体:先滤去三颈烧瓶中的固体催化剂,再减压蒸发浓缩,
(4)测定 KSCN 的含量称取 10.0g 样品配成 1000mL 溶液量取 20.00mL 于锥形瓶中,并加入几滴 Fe(NO3)3溶液,用 0.1000mol/LAgNO3标准溶液滴定,达到滴定终点时消 AgNO3标准溶液 20.00mL。
①滴定时发生的离子反应为 SCN-+Ag+= AgSCN↓,则刚好沉淀完时的锥形瓶中颜色变化是
②KSCN 的质量分数为
您最近一年使用:0次
2020-07-23更新
|
334次组卷
|
3卷引用:四川省成都市成华区2019-2020学年高一下学期期末化学试题
解题方法
7 . Fe2O3和Cu2O都是红色粉末,常用作颜料.实验小组通过实验来探究某一红色粉末中Fe2O3和Cu2O的含量(不含其他物质)。
已知:Cu2O+H2SO4=Cu+Cu SO4+H2O
探究过程如下:
取少量该粉末放入 足量稀硫酸中,粉末完全溶解。
(1)①若滴加KSCN试剂后溶液不变为红色,则Fe2O3和Cu2O的物质的量之比为________ 。
②实验小组发现可通过对反应后溶液的称量来获得绿矾晶体(FeSO4·7H2O),设计了简单的流程来完成绿矾的制备:
混合液 过滤
过滤 一系列操作
一系列操作 绿矾晶体(FeSO4·7H2O)
绿矾晶体(FeSO4·7H2O)
试剂a为_____________ (填化学式),“一系列操作”为__________ 、__________ 、过滤、洗涤、干燥。
(2)测定Cu2O的质量分数:另取一种由Fe2O3和Cu2O组成的固体混合物9.28g,将其放在空气中充分加热(只发生Cu2O→CuO的反应),待质量不再变化时,测得质量为9.60g,则固体混合物中Cu2O的质量分数为_________________ (保留三位有效数字)
已知:Cu2O+H2SO4=Cu+Cu SO4+H2O
探究过程如下:
取少量该粉末放入 足量稀硫酸中,粉末完全溶解。
(1)①若滴加KSCN试剂后溶液不变为红色,则Fe2O3和Cu2O的物质的量之比为
②实验小组发现可通过对反应后溶液的称量来获得绿矾晶体(FeSO4·7H2O),设计了简单的流程来完成绿矾的制备:
混合液
 过滤
过滤 一系列操作
一系列操作 绿矾晶体(FeSO4·7H2O)
绿矾晶体(FeSO4·7H2O)试剂a为
(2)测定Cu2O的质量分数:另取一种由Fe2O3和Cu2O组成的固体混合物9.28g,将其放在空气中充分加热(只发生Cu2O→CuO的反应),待质量不再变化时,测得质量为9.60g,则固体混合物中Cu2O的质量分数为
您最近一年使用:0次
2012·上海杨浦·二模
名校
解题方法
8 . 氯化铁是常见的水处理剂。某氯化铁(FeCl3·6H2O)样品含有少量FeCl2杂质。现要测定其中FeCl3·6H2O的质量分数,实验按以下步骤进行:
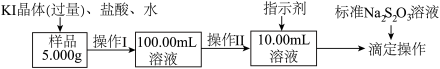
已知有关离子方程式为:2Fe3+ +2I- 2Fe2++ I2 , I2+2S2O32-2I- +S4O62-
(1)取少量氯化铁样品滴入50mL沸水中,加热片刻,液体呈现红褐色,反应的离子方程式为:____________________ 。
(2)操作Ⅰ所用到的玻璃仪器除烧杯、玻璃棒外,还必须有_______ 、_______ (填仪器名称)。
(3)操作Ⅱ必须 用到的仪器是_______ (选填编号);
a.50mL烧杯 b.10mL量筒 c.20mL量筒 d.25mL滴定管
指示剂是淀粉溶液,则达到滴定终点的现象是________________________________ 。
(4)滴定时,消耗浓度为0.1000mol/L的标准Na2S2O3 溶液18.17mL。该样品中FeCl3·6H2O的质量分数为_______________ 。
(5)要把样品氯化铁中的少量FeCl2杂质除去,可用的试剂是_______ (选填编号)。
a.铁粉 b.氯水 c.溴水 d.双氧水
(6)如果采用以下步骤测定氯化铁样品中铁元素 的含量,完成下列填空。
①称量样品 ②加水溶解 ③加足量氨水,沉淀 ④过滤 ⑤灼烧 ⑥称量并进行恒重操作。
还缺少的一步操作是_________ ;在过滤前,需要检验是否沉淀完全,其操作是_____________ ;判断是否恒重的标准是__________________________________________ 。

已知有关离子方程式为:2Fe3+ +2I- 2Fe2++ I2 , I2+2S2O32-2I- +S4O62-
(1)取少量氯化铁样品滴入50mL沸水中,加热片刻,液体呈现红褐色,反应的离子方程式为:
(2)操作Ⅰ所用到的玻璃仪器除烧杯、玻璃棒外,还必须有
(3)操作Ⅱ
a.50mL烧杯 b.10mL量筒 c.20mL量筒 d.25mL滴定管
指示剂是淀粉溶液,则达到滴定终点的现象是
(4)滴定时,消耗浓度为0.1000mol/L的标准Na2S2O3 溶液18.17mL。该样品中FeCl3·6H2O的质量分数为
(5)要把样品氯化铁中的少量FeCl2杂质除去,可用的试剂是
a.铁粉 b.氯水 c.溴水 d.双氧水
(6)如果采用以下步骤测定氯化铁样品中
①称量样品 ②加水溶解 ③加足量氨水,沉淀 ④过滤 ⑤灼烧 ⑥称量并进行恒重操作。
还缺少的一步操作是
您最近一年使用:0次
名校
解题方法
9 . 铁有两种氯化物,都是重要的化工试剂。查阅有关资料如下:
【氯化铁】熔点为306℃,沸点为315℃;易吸收空气中的水分而潮解。工业上采用向500~600℃的铁粉中通入氯气来生产无水氯化铁。
【氯化亚铁】熔点为670℃,易升华。工业上采用向炽热铁粉中通入氯化氢来生产无水氯化亚铁。
某化学活动小组用下图所示的装置(夹持装置略去)模拟工业生产制备无水氯化铁。请回答下列问题:

(1)在装置A中,用KMnO4与浓盐酸反应制取氯气,反应的离子方程式为_________ 。仪器D的名称是__________________ 。
(2)D中装的药品是碱石灰,其作用是__________________________ 。
(3)定性分析。取装置C中的少量产物溶于稀硫酸中配成稀溶液待用。若产物中混有FeCl2,可用下列试剂中的_____ (只能选取一种试剂,填序号)进行检测,实验现象是__________________________________ 。
①H2O2溶液 ②KI-淀粉溶液 ③KSCN溶液 ④酸性KMnO4溶液
(4)定量分析。取装置C中的产物,按以下步骤进行测定:①称取4.60g产品溶于过量的稀盐酸中;②加入足量H2O2溶液;③再加入足量NaOH溶液;④过滤、洗涤后灼烧沉淀;⑤称量所得红棕色固体为2.40g。则该样品中铁元素的质量分数为_______ %(结果精确到小数点后两位)。
(5)由(4)定量分析数据得出结论,并提出改进措施。
①用题目所给的装置制得的产物中,铁元素含量______ (填“相等”、“偏高”或“偏低”),说明含有FeCl2杂质。
②若要得到较纯净的无水氯化铁,可采取的“装置”改进措施是_________ 。
【氯化铁】熔点为306℃,沸点为315℃;易吸收空气中的水分而潮解。工业上采用向500~600℃的铁粉中通入氯气来生产无水氯化铁。
【氯化亚铁】熔点为670℃,易升华。工业上采用向炽热铁粉中通入氯化氢来生产无水氯化亚铁。
某化学活动小组用下图所示的装置(夹持装置略去)模拟工业生产制备无水氯化铁。请回答下列问题:

(1)在装置A中,用KMnO4与浓盐酸反应制取氯气,反应的离子方程式为
(2)D中装的药品是碱石灰,其作用是
(3)定性分析。取装置C中的少量产物溶于稀硫酸中配成稀溶液待用。若产物中混有FeCl2,可用下列试剂中的
①H2O2溶液 ②KI-淀粉溶液 ③KSCN溶液 ④酸性KMnO4溶液
(4)定量分析。取装置C中的产物,按以下步骤进行测定:①称取4.60g产品溶于过量的稀盐酸中;②加入足量H2O2溶液;③再加入足量NaOH溶液;④过滤、洗涤后灼烧沉淀;⑤称量所得红棕色固体为2.40g。则该样品中铁元素的质量分数为
(5)由(4)定量分析数据得出结论,并提出改进措施。
①用题目所给的装置制得的产物中,铁元素含量
②若要得到较纯净的无水氯化铁,可采取的“装置”改进措施是
您最近一年使用:0次
2019-01-07更新
|
667次组卷
|
4卷引用:四川省广安友谊中学2018-2019学年高一上学期期末模拟化学试题
14-15高一上·山东潍坊·期末
名校
解题方法
10 . 铁是人体不可缺少的微量元素,硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如下:
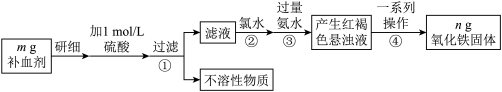
(1)实验中用已经准确量取的浓硫酸配制500 mL 1 mol/L的硫酸溶液,则配制时用到的仪器除烧杯、500 mL容量瓶外,还需要____________________ 。
(2)步骤②加入过量氯水后发生反应的离子方程式为_________________________ 。
(3)步骤④中一系列操作步骤为_________ 、洗涤、灼烧、冷却、称量。
(4)若实验无损耗,则该补血剂含铁元素的质量分数为____________ 。
(5)某同学发现部分补血剂药片表面发黄,取样品研细,溶于1 mol/L的硫酸溶液,过滤。取滤液加_______________ 溶液,溶液变红说明该补血剂已部分变质。向变色后的溶液中加入橙汁,溶液红色褪去,说明橙汁含具有___________ 性(填“氧化”或“还原”)的物质。
(6)下列检验(5)中滤液中是否有Fe2+应选用的试剂是________ 。
A. KSCN溶液 B. 酸性KMnO4溶液 C. 铁粉 D. FeCl3溶液

(1)实验中用已经准确量取的浓硫酸配制500 mL 1 mol/L的硫酸溶液,则配制时用到的仪器除烧杯、500 mL容量瓶外,还需要
(2)步骤②加入过量氯水后发生反应的离子方程式为
(3)步骤④中一系列操作步骤为
(4)若实验无损耗,则该补血剂含铁元素的质量分数为
(5)某同学发现部分补血剂药片表面发黄,取样品研细,溶于1 mol/L的硫酸溶液,过滤。取滤液加
(6)下列检验(5)中滤液中是否有Fe2+应选用的试剂是
A. KSCN溶液 B. 酸性KMnO4溶液 C. 铁粉 D. FeCl3溶液
您最近一年使用:0次



