名校
解题方法
1 . 黄铁矿(主要成分 )是工业制硫酸的主要原料,在空气中煅烧黄铁矿,生成
)是工业制硫酸的主要原料,在空气中煅烧黄铁矿,生成 和
和 气体。某化学学习小组设计了如下实验,通过测量生成
气体。某化学学习小组设计了如下实验,通过测量生成 的质量来测定黄铁矿的纯度,根据要求回答下列问题。
的质量来测定黄铁矿的纯度,根据要求回答下列问题。

(1)用各装置接口字母表示气流从左到右的顺序_______ 。
(2)将样品研磨成粉末状再反应的目的是_______ 。
(3)装置③中煅烧时发生反应的化学方程式为_______ 。
(4)装置②中铜网的作用是_______ 。
(5)反应结束后,关闭③处酒精喷灯仍需通一段时间的空气,其目的是_______ 。
(6)写出装置④中发生反应的离子方程式_______ 。
(7)该小组取8.0g样品进行实验,实验后装置④增重6.4g,则该样品纯度为_______ 。
 )是工业制硫酸的主要原料,在空气中煅烧黄铁矿,生成
)是工业制硫酸的主要原料,在空气中煅烧黄铁矿,生成 和
和 气体。某化学学习小组设计了如下实验,通过测量生成
气体。某化学学习小组设计了如下实验,通过测量生成 的质量来测定黄铁矿的纯度,根据要求回答下列问题。
的质量来测定黄铁矿的纯度,根据要求回答下列问题。
(1)用各装置接口字母表示气流从左到右的顺序
(2)将样品研磨成粉末状再反应的目的是
(3)装置③中煅烧时发生反应的化学方程式为
(4)装置②中铜网的作用是
(5)反应结束后,关闭③处酒精喷灯仍需通一段时间的空气,其目的是
(6)写出装置④中发生反应的离子方程式
(7)该小组取8.0g样品进行实验,实验后装置④增重6.4g,则该样品纯度为
您最近一年使用:0次
2021-07-05更新
|
426次组卷
|
3卷引用:湖北省黄冈市2020-2021学年高一下学期期末调研考试化学试题
2 . 下列实验操作、现象和结论都正确的是
| 选项 | 操作 | 现象 | 结论 |
| A | 加热溴乙烷和KOH乙醇混合液,将气体通入酸性重铬酸钾溶液中 | 重铬酸钾溶液由橙色变为绿色 | 溴乙烷一定发生消去反应生成了乙烯 |
| B | 常温下,将铝片投入浓硝酸中 | 没有明显现象 | 铝不和硝酸反应 |
| C | 向FeSO4溶液中滴加KSCN溶液 | 溶液变红色 | FeSO4已被氧化 |
| D | 在84消毒液中滴几滴酚酞溶液 | 溶液只变红色 | NaClO发生了水解反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
3 . 电子工业常用 溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。某小组为了从使用过的腐蚀废液中回收铜,并重新获得纯净的
溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。某小组为了从使用过的腐蚀废液中回收铜,并重新获得纯净的 溶液,准备采用下图步骤,下列说法正确的是
溶液,准备采用下图步骤,下列说法正确的是

 溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。某小组为了从使用过的腐蚀废液中回收铜,并重新获得纯净的
溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。某小组为了从使用过的腐蚀废液中回收铜,并重新获得纯净的 溶液,准备采用下图步骤,下列说法正确的是
溶液,准备采用下图步骤,下列说法正确的是
A. 溶液腐蚀铜箔的离子方程式为: 溶液腐蚀铜箔的离子方程式为: |
B.要证明滤液Ⅰ中不含 而含有 而含有 ,先加入少量KSCN溶液,再加入适量氯水,观察现象 ,先加入少量KSCN溶液,再加入适量氯水,观察现象 |
| C.①是Fe,②是稀硫酸 |
D.“通入气体③”操作不能替换为“加入适量酸性 溶液”操作 溶液”操作 |
您最近一年使用:0次
4 . 室温下进行下列实验,根据实验操作和现象所得到的结论正确的是
| 选项 | 实验操作和现象 | 结论 |
| A | 将水滴入盛有过氧化钠固体的试管中,立刻把带火星的木条放在试管口,可看到有气泡产生,木条复燃 |  固体遇水产生 固体遇水产生 |
| B | 将X溶液滴在KI淀粉试纸上,试纸变蓝色 | X溶液中一定含有 |
| C | 向 和KSCN的混合溶液中滴入酸化的 和KSCN的混合溶液中滴入酸化的 溶液,溶液变红 溶液,溶液变红 |  的氧化性一定比 的氧化性一定比 的强 的强 |
| D | 向2支均盛有2mL相同浓度的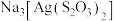 溶液的试管中,分别滴入2滴相同浓度的KCI、KI溶液,前者无明显现象,后者有黄色沉淀 溶液的试管中,分别滴入2滴相同浓度的KCI、KI溶液,前者无明显现象,后者有黄色沉淀 |  |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
5 . “综合利用”是把生产过程排放的废弃物最大限度地利用起来,做到物尽其用,从而达到最好的经济和社会效益。为了防治某大气污染物,某工厂设计了如图所示的工艺流程。下列有关叙述错误的是
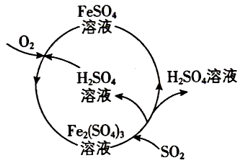

A.该工艺流程利用污染物 获得了 获得了 |
B.该工艺流程中 是催化剂 是催化剂 |
| C.该过程中化合价发生改变的元素有Fe、S和O |
D.该工艺流程的总反应为 |
您最近一年使用:0次
2021-06-24更新
|
347次组卷
|
4卷引用:湖北省黄石市有色一中2020-2021学年高一下学期期末考试化学试题
解题方法
6 . 为探索工业含铝、铁、铜合金废料的再利用,某同学实设计的回收利用方案如下:

(1)气体 X 的化学式是___________ ;
(2)检验滤液 D 是否含有 Fe3+的最佳试剂为___________ (填序号)
A.KMnO4 B.NaOH C.氯水 D.KSCN
(3)若要从滤液 D 得到绿矾晶体,必须进行的实验操作步骤:___________ 、冷却结晶、过滤、自然干燥。
(4)写出反应①的离子方程式___________ ;
(5)试剂 Y 应该是一种___________ (填“氧化剂”或“还原剂”),它不可能是___________
A.H2O2 B.H2S C.O2 D.铁单质
(6)浓硝酸可以溶解铜,也可以溶解上述合金。若固体未完全溶解,则滤液 D 中 Fe元素将以___________ ( 填“Fe3+”或“Fe2+”)离子形式存在。

(1)气体 X 的化学式是
(2)检验滤液 D 是否含有 Fe3+的最佳试剂为
A.KMnO4 B.NaOH C.氯水 D.KSCN
(3)若要从滤液 D 得到绿矾晶体,必须进行的实验操作步骤:
(4)写出反应①的离子方程式
(5)试剂 Y 应该是一种
A.H2O2 B.H2S C.O2 D.铁单质
(6)浓硝酸可以溶解铜,也可以溶解上述合金。若固体未完全溶解,则滤液 D 中 Fe元素将以
您最近一年使用:0次
2021-06-16更新
|
316次组卷
|
2卷引用:湖北省黄石市有色一中2020-2021学年高一下学期期末考试化学试题
10-11高二下·湖南株洲·期中
名校
解题方法
7 . 为了检验某氯化亚铁溶液是否变质生成Fe3+,最好向溶液中加入
| A.KSCN溶液 | B.铁片 | C.NaOH溶液 | D.石蕊试液 |
您最近一年使用:0次
2021-04-28更新
|
309次组卷
|
71卷引用:2012-2013湖北省孝感高中高一上学期期末考试化学试卷
(已下线)2012-2013湖北省孝感高中高一上学期期末考试化学试卷(已下线)2011-2012学年吉林省长春外国语学校高一上学期期末考试文科化学试卷(已下线)2011-2012学年安徽省桐城十中高一上学期期末考试化学试卷(已下线)2011-2012学年云南省保山曙光中学高一上学期期末考试化学试卷(已下线)2011-2012学年安徽省六安三中高一下学期期末考试化学A卷(已下线)2012-2013年云南省景洪市第四中学高一上学期期末考试化学试卷(已下线)2011-2012学年云南景洪第一中学高一上期末考试化学试卷2015-2016学年吉林省长春外国语学校高一上期末化学试卷2015-2016学年黑龙江哈尔滨三十二中高一上学期期末化学试卷2015-2016学年福建省师大附中高一上学期期末化学试卷2015-2016学年吉林省延边二中高一上期末化学试卷2016-2017学年吉林长春外国语学校高一上期末文化学卷吉林省长春外国语学校2017-2018学年高一上学期期末考试化学(文)试题贵州省黔东南州2017-2018学年度第一学期高一化学期末考试试题内蒙古杭锦后旗奋斗中学2017-2018学年高一上学期期末考试化学试题四川省乐山市高中2017-2018学年高一上学期期末化学试题云南省中央民族大学附属中学芒市国际学校2017-2018学年高二上学期末考试化学试题云南省沾益县第四中学2017-2018学年高一上学期期末考试化学试题云南省峨山彝族自治县第一中学2017-2018学年高一上学期期末考试化学试题【全国百强校】吉林省长春外国语学校2018-2019学年高一(文)上学期期末考试化学试题【全国百强校】云南省云天化中学2018-2019学年高一上学期期末考试化学试题陕西省黄陵中学2018-2019学年高一(普通班)上学期期末考试化学试题【市级联考】广东省惠州市2018-2019学年高一第一学期期末质量检测化学试题【全国百强校】西藏自治区山南市第二高级中学2018-2019学年高一上学期期末考试化学试题安徽省阜阳颍上一中2018-2019学年高一上学期期末考试化学试题新疆伊西哈拉镇中学2018-2019学年高一上学期期末考试化学试题上海市北虹高级中学2018-2019学年高二上学期期末考试化学试题新疆巴楚县第一中学2019-2020学年高一上学期期末考试化学试题西藏自治区日喀则市南木林高级中学2019-2020学年高一上学期期末考试化学试题西藏自治区山南市第三高级中学2019-2020学年高一上学期期末考试化学试题广东省惠州市惠阳区中山中学2021-2022学年高一上学期期末质量检测化学试题(已下线)2010-2011学年湖南省醴陵二中高二下学期期中考试化学试卷(已下线)2010—2011学年湖南省醴陵二中高二下学期期中考试化学试卷(已下线)2011-2012学年广东省兴中学高二下学期期中学业水平考试化学试卷2015-2016学年吉林省吉林五十五中高二上学期期中(文)化学试卷2015-2016学年河北省永年二中高一上学期12月月考化学试卷2016-2017学年河北冀州中学高一12月月考文化学卷2016-2017学年山东省济南市历城区第二中学高一下学期开学考试化学试卷河南省平顶山市、许昌市、汝州2017-2018学年高一上学期第三次联考化学试题云南民族大学附属中学2017-2018学年高一下学期期中考试化学试题河北省邯郸市永年区第二中学2019届高三上学期9月月考化学试题【全国百强校】贵州省铜仁市第一中学2019届高三上学期第二次月考化学试题【全国百强校】黑龙江省牡丹江市第一高级中学2018-2019学年高二(文)上学期10月月考化学试题【全国百强校】甘肃省兰州市第一中学2018-2019学年高一上学期12月月考化学试题宁夏回族自治区青铜峡市高级中学2018-2019学年高一上学期12月月考化学试题山西省忻州市实验中学2018-2019学年高一上学期第三次教学质量检测化学试题【全国百强校】吉林省延边市第二中学2018-2019学年高一下学期开学考试化学试题(已下线)2019年11月8日《每日一题》必修1—— Fe2+和Fe3+的检验云南省峨山彝族自治县第一中学2019-2020学年高二上学期期中考试化学(文)试题湖南省张家界市民族中学2019-2020学年高一上学期第三次月考化学试题黑龙江省大兴安岭漠河县第一中学2019-2020学年高一上学期11月月考化学试题四川省泸县第四中学2019-2020学年高一下学期第一次在线月考化学试题四川省武胜烈面中学校2019-2020学年高一下学期开学考试化学试题海南省三亚华侨学校2019-2020学年高一上学期12月月考化学试题辽宁省凌源市第三中学2019-2020学年高二下学期第一次月考化学试题四川省仁寿县文宫中学2019-2020学年高一5月月考化学试题海南省三亚华侨学校2019-2020学年高一下学期开学考试化学试题(已下线)3.1.2 铁的氢氧化物 铁盐和亚铁盐练习(2)——《高中新教材同步备课》(人教版 必修第一册)内蒙古通辽市奈曼旗实验中学2018-2019学年高一下学期期中考试化学试题(已下线)3.1.2 铁的重要化合物(基础练)-2020-2021学年高一化学上学期十分钟同步课堂专练(人教版2019必修第一册)(已下线)3.2.3 铁的重要化合物(基础练)-2020-2021学年高一化学上学期十分钟同步课堂专练(人教版)湖南省常德市外国语学校2020-2021学年高一上学期第二次月考化学试题云南省峨山彝族自治县第一中学2020-2021学年高一上学期12月月考化学试题广东省珠海市第二中学2020-2021学年高一12月月考化学试题河北省衡水市武强中学2020-2021学年高一上学期第三次月考化学试题云南省玉溪市峨山县第一中学2020-2021学年高一下学期期中考试化学试题江苏省外国语学校2020-2021学年高一下学期期中考试化学试题云南省玉溪市第二中学2020-2021学年高一下学期期中考试化学(文)试题甘肃省永昌县第一高级中学2020-2021学年高二上学期期中考试化学(文)试题(已下线)5.2.3 重要的金属化合物(第3课时)-【帮课堂】2021-2022学年高一化学同步精品讲义(沪科版2020必修第二册)江西省安福县第三中学2021-2022学年高一上学期第二次月考化学试题
10-11高三上·吉林长春·期中
名校
解题方法
8 . 把一定量铁粉放入氯化铁溶液中,完全反应后,所得溶液中Fe2+和Fe3+的溶度恰好相等,则未反应的Fe3+和已反应的Fe3+的物质的量的比为
| A.1∶1 | B.1∶2 | C.3∶2 | D.2∶3 |
您最近一年使用:0次
2021-04-15更新
|
1217次组卷
|
85卷引用:2012-2013湖北省孝感高中高一上学期期末考试化学试卷
(已下线)2012-2013湖北省孝感高中高一上学期期末考试化学试卷2015-2016学年湖北省宜昌市部分示范高中高一上期末联考化学试卷湖北省荆州市2019-2020学年高一上学期期末考试化学试题(已下线)2010—2011学年海南省洋浦中学高一上学期期末考试化学试卷(已下线)2011-2012学年甘肃省武威第五中学高一期末考试化学试卷(已下线)2011-2012学年甘肃省白银市平川中恒学校高一上学期期末考试化学试卷(已下线)2011-2012学年吉林省长春外国语学校高一上学期期末考试文科化学试卷(已下线)2011-2012学年吉林省长春市十一高中高一上学期期末考试化学试卷(已下线)2011—2012学年海南省洋浦中学高一第一学期期末考试化学试卷(已下线)2012-2013学年福建省福清东张中学高一上学期期末考试化学试卷(已下线)2012-2013学年陕西省宝鸡中学高一上学期期末考试化学试卷(已下线)2013-2014学年福建省厦门市高一上学期期末质量检测模拟化学试卷(已下线)2013-2014学年北京市西城区高一上学期期末考试化学试卷2014-2015辽宁省大连市第二十高中高一上学期期末化学试卷2014-2015陕西省西安市一中高一上学期期末化学试卷2014-2015四川省乐山市高一年级上学期期末考试化学试卷重庆市第一中学2016-2017学年高一上学期期末考试化学试题2016-2017学年江西省南昌市第十中学高一上学期期末考试化学试卷云南省峨山彝族自治县第一中学2016-2017学年高二下学期期末考试化学试题湖北省宜昌市长阳县第一高级中学2017-2018学年高一12月月考化学试题宁夏育才中学2017-2018学年高一上学期期末考试化学试题新疆昌吉市2017-2018学年高一上学期期末考试化学试题天津市和平区2017-2018学年高一上学期期末考试化学试题江西省临川实验学校2017-2018学年高一上学期期末质量检测化学试题云南省玉溪第一中学2017-2018学年高一上学期期末考试化学试题河南省开封市兰考县第三高级中学2017-2018学年高一上学期期末考试化学试卷云南省兰坪县第一中学2019-2020学年高一上学期期末考试化学试题陕西省西安中学2019-2020学年高一上学期期末考试化学试题广东省梅州市蕉岭县蕉岭中学2019—2020学年高一上学期期末考试化学试题四川省眉山市2019-2020学年高一上学期期末教学质量检测化学试题山东省枣庄市2019-2020学年高一下学期期末考试化学试题重庆市铜梁中学校等七校2019-2020学年高一上学期期末联考化学试题甘肃省兰州市第一中学2020-2021学年高一上学期期末考试化学(文)试题宁夏固原市隆德县2020-2021学年高一上学期期末考试化学试题广西南宁市邕宁高中2020-2021学年高一上学期期末考试化学试题(已下线)吉林省长春市十一高中2010-2011学年度高三上学期期中考(已下线)2011届陕西省西安交大阳光中学高三上学期期中考试化学卷(已下线)2010年福建省三明一中高一上学期期中考试化学卷(已下线)2010年上海市吴淞中学高二上学期期中考试化学试卷(已下线)2011-2012学年江西省赣州市信丰县信丰中学高一第二次月考化学试卷(已下线)2011-2012学年云南省玉溪一中高一下学期期中考试化学试卷(已下线)2014-2015江苏省宿迁市五校高一上学期期中联考化学试卷2014-2015江苏省涟水中学高一12月月考化学试卷2015-2016学年北大附中河南分校高一上9月考化学试卷2015-2016学年河北省永年二中高一上学期12月月考化学试卷2015-2016学年四川阆中中学校高一上第二次段考化学试卷2015-2016学年陕西省西安一中高一上12月月考化学试卷2016-2017学年浙江省余姚中学高一上期中化学试卷2016-2017学年山东省枣庄八中高一12月月考化学卷山西省忻州市第一中学2016-2017学年高一必修一:3.2.3几种重要的金属化合物同步练习化学试题黑龙江省牡丹江市第一高级中学2017-2018学年高二10月月考(文)化学试题江苏省东台市创新学校2018届高三10月月考化学试题甘肃省甘谷县第一中学2017-2018学年高一上学期第二次月考化学试题上海杨浦高级中学2017-2018学年高二上学期12月月考化学试题山西省太原市成成中学校2017-2018学年高一12月月考化学试题陕西省黄陵中学2017-2018学年高一(普通班)下学期开学考试化学试题2018-2019学年苏教版高中化学必修一 专题综合测评3【全国百强校】山东省泰安市第一中学2018-2019学年高一上学期期中考试化学试题【全国百强校】甘肃省兰州市第一中学2018-2019学年高一上学期12月月考化学试题山西省忻州市实验中学2018-2019学年高一上学期第三次教学质量检测化学试题河南省封丘县一中2018-2019学年高一上学期12月月考化学试题山东省泰安市宁阳一中2018-2019学年高一上学期阶段性考试二(12月)化学试题山西省晋中市平遥县第二中学2018-2019学年高一上学期12月月考化学试题河南省永城市实验高级中学2019届高三上学期期中考试化学试题甘肃省白银市会宁县第一中学2018届高三上学期期中考试化学试题吉林省白城市通榆县第一中学2020届高三上学期第二次月考化学试题山西省晋中市平遥县第二中学2019-2020学年高一12月月考化学试题四川省三台中学2019-2020学年高一上学期第三次月考化学试题鲁科版高中化学必修1第二章《元素与物质世界》测试卷上海市闵行区向明世博中学2018-2019学年高二上学期期中考试化学试题河南省焦作市沁阳市第一中学2019-2020学年高一上学期12月月考化学试题陕西省咸阳市实验中学2019-2020学年高一上学期第三次月考化学试题(已下线)3.1.1 铁及其化合物练习(1)——《高中新教材同步备课》(鲁科版 必修第一册)(已下线)第03章 铁 金属材料(A卷基础强化篇)——2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)人教版(2019)高一必修第一册 第三章 第一节 铁及其化合物鲁科版(2019)高一必修第一册第3章 物质的性质与转化 第1节 铁的多样性高一必修第一册(鲁科2019)第3章 第1节 铁的多样性 教材帮(已下线)3.1.1 铁的单质-2020-2021学年高一化学同步课堂帮帮帮(人教版2019必修第一册)宁夏石嘴山市平罗中学2020-2021学年高一上学期第三次月考化学试题湖南省常德市石门县第六中学2019-2020学年高一下学期第三次月考化学试题云南省梁河县第一中学2020-2021学年高一上学期第二次月考化学试题江西省抚州市金溪县第一中学2020-2021学年高一上学期第二次月考化学试题云南省楚雄中学2020-2021学年高一下学期4月月考化学试题甘肃省武威市民勤县第四中学2020-2021学年高一下学期第一次月考化学(实验班)试题(已下线)专题08 铁及其化合物 (热点讲义)-2022年高三毕业班化学常考点归纳与变式演练
名校
解题方法
9 . 某兴趣小组设计实验制取Cl2并验证Cl2的氧化性。回答下列问题:
(1)用K2MnO4与浓盐酸反应制取Cl2,装置如图甲:
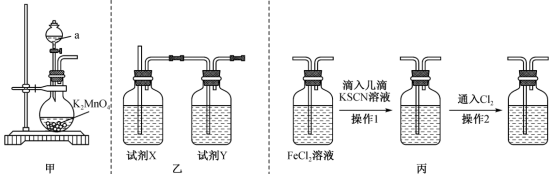
①反应的化学方程式为K2MnO4+8HCl(浓)=MnCl2+2Cl2↑+2KCl+4H2O,该反应中氧化剂为__________ (填化学式),若生成5.6 L Cl2(标准状况),则被氧化的盐酸为__________ mol。
②制取的Cl2中含有的杂质有__________ (填化学式),通过乙装置除去该杂质,则试剂X、试剂Y依次为__________ (填字母)。
A.饱和食盐水、碱石灰 B.饱和食盐水、浓硫酸 C.浓硫酸、饱和食盐水
(2)用图丙所示装置验证Cl2的氧化性。操作1后观察到现象为_________________________ ,操作2后观察到现象为________________________________________ ,产生操作2后现象的原因是__________________________________________ (用必要的语言和离子方程式说明)。
(3)KMnO4、K2MnO4均能与浓盐酸反应制取Cl2,充分反应后Mn元素的化合价均降为+2,消耗等物质的量的KMnO4、K2MnO4产生Cl2的体积(标准状况)更大的是__________ (填“KMnO4”或“K2MnO4”)。
(1)用K2MnO4与浓盐酸反应制取Cl2,装置如图甲:

①反应的化学方程式为K2MnO4+8HCl(浓)=MnCl2+2Cl2↑+2KCl+4H2O,该反应中氧化剂为
②制取的Cl2中含有的杂质有
A.饱和食盐水、碱石灰 B.饱和食盐水、浓硫酸 C.浓硫酸、饱和食盐水
(2)用图丙所示装置验证Cl2的氧化性。操作1后观察到现象为
(3)KMnO4、K2MnO4均能与浓盐酸反应制取Cl2,充分反应后Mn元素的化合价均降为+2,消耗等物质的量的KMnO4、K2MnO4产生Cl2的体积(标准状况)更大的是
您最近一年使用:0次
2021-03-09更新
|
230次组卷
|
4卷引用:湖北省荆州市六县市区2020-2021学年高一上学期期末考试化学试题
10 . 下列由实验现象得到的结论正确的是
| 实验 | 现象 | 结论 | |
| A | 足量Cu粉加入FeCl3溶液中 | 铜粉逐渐减少,溶液由黄色变为蓝绿色 | 氧化性:Fe3+>Cu2+ |
| B | 将几滴KSCN溶液滴入在空气中放置一段时间的FeSO4、H2SO4混合溶液中 | 溶液变为血红色 | KSCN能使含有Fe2+的溶液变为血红色 |
| C | 向可能混有Na2CO3的NaCl溶液中滴加少许稀盐酸 | 无气体生成 | 该溶液中不含Na2CO3 |
| D | 将久置空气中的铝片加入NaOH溶液中 | 开始无气体生成 | 开始没有化学反应发生 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次



