23-24高二上·全国·课时练习
解题方法
1 . 对于反应FeCl3+3KSCN Fe(SCN)3+3KCl,加入KCl固体平衡是否移动
Fe(SCN)3+3KCl,加入KCl固体平衡是否移动________ ?为什么________ ?
 Fe(SCN)3+3KCl,加入KCl固体平衡是否移动
Fe(SCN)3+3KCl,加入KCl固体平衡是否移动
您最近一年使用:0次
解题方法
2 . 铁是人体必需的微量元素之一,补铁剂中的Fe2+在空气中很容易被氧化为Fe3+,影响铁元素在人体中的吸收利用。某实验小组进行如图所示的对照实验,验证补铁剂和维生素C一起服用的科学性。
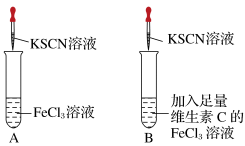
[实验操作]第一步:在A、B两支试管中加入对比试剂;第二步:振荡;第三步:滴加KSCN溶液。
[实验现象]
(1)A试管中溶液变___________ 色,B试管中无明显现象。
[实验结论]
(2)维生素C具有___________ (填“氧化性”或“还原性”),能防止Fe2+被氧化为Fe3+,所以补铁剂和维生素C一起服用具有科学依据。
[生活应用]
(3)某品牌泡腾片的主要成分为维生素C和NaHCO3,放入水中立即产生大量气泡(CO2)使口感更好,说明维生素C具有___________ (填“酸性”或“碱性”)。
(4)为防止烹调时蔬菜中维生素C的损失,烹调蔬菜应注意___________ (写一条即可)。

[实验操作]第一步:在A、B两支试管中加入对比试剂;第二步:振荡;第三步:滴加KSCN溶液。
[实验现象]
(1)A试管中溶液变
[实验结论]
(2)维生素C具有
[生活应用]
(3)某品牌泡腾片的主要成分为维生素C和NaHCO3,放入水中立即产生大量气泡(CO2)使口感更好,说明维生素C具有
(4)为防止烹调时蔬菜中维生素C的损失,烹调蔬菜应注意
您最近一年使用:0次
3 . 某同学为了检验家中的两种补铁药(成分均为FeSO4)是否变质,查阅了有关资料,得知SCN-、Fe2+能被酸性KMnO4溶液氧化而使酸性KMnO4溶液褪色,并结合已学的知识设计了如下实验:
①将药片除去糖衣研细后溶解、过滤。
②取滤液分别加入两支试管中,在一支试管中加入酸性KMnO4溶液,在另一支试管中加入KSCN溶液。
请回答下列问题:
(1)若滴入酸性KMnO4溶液后褪色,滴入KSCN溶液后不变红,结论是_______ 。
(2)若滴入酸性KMnO4溶液后不褪色,滴入KSCN溶液变红,结论是_________ 。
(3)若滴入酸性KMnO4溶液后褪色,滴入KSCN溶液变红,结论是________ 。
(4)________ (填“能”或“不能”)将酸性KMnO4溶液和KSCN溶液滴入同一支试管中进行验证,原因是_________________ 。
①将药片除去糖衣研细后溶解、过滤。
②取滤液分别加入两支试管中,在一支试管中加入酸性KMnO4溶液,在另一支试管中加入KSCN溶液。
请回答下列问题:
(1)若滴入酸性KMnO4溶液后褪色,滴入KSCN溶液后不变红,结论是
(2)若滴入酸性KMnO4溶液后不褪色,滴入KSCN溶液变红,结论是
(3)若滴入酸性KMnO4溶液后褪色,滴入KSCN溶液变红,结论是
(4)
您最近一年使用:0次
19-20高一·浙江·阶段练习
名校
解题方法
4 . 某同学用如下实验探究Fe2+、Fe3+的性质。请回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol·L-1的溶液,在FeCl3溶液中需加入少量铁屑,发生反应的化学方程式为_______ 。
(2)甲同学取2 mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化,FeCl2溶液与氯水反应的化学方程式为_______ 。
(3)乙同学认为甲同学的实验不够严谨,该同学在2 mL FeCl2溶液中先加入0.5 mL煤油,再于液面下依次加入1滴KSCN溶液和几滴氯水,溶液变红,煤油的作用是_______ 。
(4)丁同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为_______ 。
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol·L-1的溶液,在FeCl3溶液中需加入少量铁屑,发生反应的化学方程式为
(2)甲同学取2 mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化,FeCl2溶液与氯水反应的化学方程式为
(3)乙同学认为甲同学的实验不够严谨,该同学在2 mL FeCl2溶液中先加入0.5 mL煤油,再于液面下依次加入1滴KSCN溶液和几滴氯水,溶液变红,煤油的作用是
(4)丁同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为
您最近一年使用:0次
2023-02-03更新
|
234次组卷
|
5卷引用:第2课时 铁盐和亚铁盐
第2课时 铁盐和亚铁盐(已下线)【定心卷】3.1.2 铁的重要化合物随堂练习-人教版2023-2024学年必修第一册(已下线)【浙江新东方】双师 (44).黑龙江省鸡西市第一中学2021-2022学年高一上学期期中考试化学试题新疆巴音郭楞蒙古自治州第一中学等两校2022-2023学年高一上学期期末联考化学试题
5 . 电路板广泛用于计算机、手机等电子产品中。某兴趣小组拟制作带有“化学”标志的电路板并对废液进行回收利用。
Ⅰ、制作电路板
小组同学取一小块覆铜板,用油性笔在铜板上写出“化学”标志,然后浸入 溶液中,一段时间后,取出覆铜板并用水洗净,获得带有图案的印刷电路板和废液(如下图所示)。
溶液中,一段时间后,取出覆铜板并用水洗净,获得带有图案的印刷电路板和废液(如下图所示)。___________ 。
(2)取少量废液于试管中,___________ (填操作和现象),则废液中含有 。
。
Ⅱ、回收废液
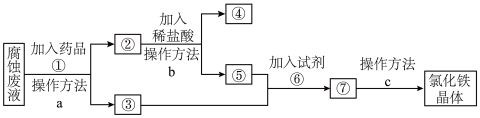
(3)一种从腐蚀废液回收金属铜并获得氯化铁晶体的工艺流程如下。请根据流程,回答下列问题。(提示:为充分除去杂质,所加试剂均为过量)___________ 。
ⅱ、④所代表的物质是___________ (用化学式表示)。
ⅲ、操作方法a、b、c中是过滤的是___________ (填序号)。
ⅳ、若取 溶液⑤加入试管中,然后滴加氢氧化钠溶液,产生白色沉淀,
溶液⑤加入试管中,然后滴加氢氧化钠溶液,产生白色沉淀,___________ (补全实验现象),此过程涉及氧化还原反应的化学方程式是___________ 。
ⅴ、试剂⑥是 时,发生反应的化学方程式是
时,发生反应的化学方程式是___________ 。
Ⅰ、制作电路板
小组同学取一小块覆铜板,用油性笔在铜板上写出“化学”标志,然后浸入
 溶液中,一段时间后,取出覆铜板并用水洗净,获得带有图案的印刷电路板和废液(如下图所示)。
溶液中,一段时间后,取出覆铜板并用水洗净,获得带有图案的印刷电路板和废液(如下图所示)。
(2)取少量废液于试管中,
 。
。Ⅱ、回收废液
(3)一种从腐蚀废液回收金属铜并获得氯化铁晶体的工艺流程如下。请根据流程,回答下列问题。(提示:为充分除去杂质,所加试剂均为过量)
ⅱ、④所代表的物质是
ⅲ、操作方法a、b、c中是过滤的是
ⅳ、若取
 溶液⑤加入试管中,然后滴加氢氧化钠溶液,产生白色沉淀,
溶液⑤加入试管中,然后滴加氢氧化钠溶液,产生白色沉淀,ⅴ、试剂⑥是
 时,发生反应的化学方程式是
时,发生反应的化学方程式是
您最近一年使用:0次
2023-01-06更新
|
671次组卷
|
3卷引用:作业(十八) 铁盐和亚铁盐
名校
解题方法
6 . 铁是人类较早使用的金属之一。运用铁及其化合物的知识,完成下列问题。
(1)所含铁元素既有氧化性又有还原性的物质是_______(填字母代号)。
(2)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板。
①请写出FeCl3溶液与铜反应的离子方程式:_______ 。
②反应后的废液中含有Fe3+,请写出用KSCN溶液检验铁离子的离子方程式_______ 。请问能否用酸性高锰酸钾溶液检验反应后的溶废液中是否含有Fe2+?_______ (填能或不能),并用离子方程式解释原因:_______ 。
③现将反应后的废液采用以下流程进行回收再生,根据流程图完成下列填空。
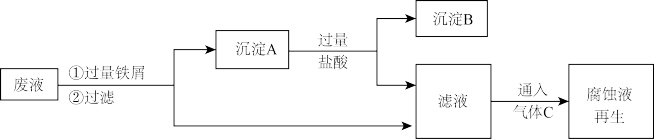
沉淀A中含有的单质:_______ ,气体C可以把滤液转化成FeCl3腐蚀液,写出反应过程中的离子方程式_______ 。加入H2O2溶液也可以到达相同目的,请写出H2O2与滤液反应离子方程式:_______ 。
(1)所含铁元素既有氧化性又有还原性的物质是_______(填字母代号)。
| A.Fe | B.FeCl2 | C.FeSO4 | D.Fe2O3 |
①请写出FeCl3溶液与铜反应的离子方程式:
②反应后的废液中含有Fe3+,请写出用KSCN溶液检验铁离子的离子方程式
③现将反应后的废液采用以下流程进行回收再生,根据流程图完成下列填空。

沉淀A中含有的单质:
您最近一年使用:0次
2023-01-02更新
|
417次组卷
|
2卷引用:章末检测卷(三) 铁 金属材料
名校
解题方法
7 . 某小组同学分别探究FeCl2溶液、FeCl3溶液的性质。
I.探究FeCl2溶液的性质。
(1)从物质类别角度判断FeCl2属于___________ ,因此可以与某些碱反应。
(2)预测FeCl2具有氧化性,因此可以与Zn反应,此时Zn体现___________ 性。
(3)预测FeCl2具有还原性,预测依据是___________ ,因此可以与酸性KMnO4溶液反应。
(4)进行如下实验操作:
①i中的现象是___________ ,用化学方程式表示产生该现象的原因:___________ 、___________ 。
②ii中反应的离子方程式是___________ 。
③iii中的现象是___________ 。
(5)某同学认为iii中现象并不能证明Fe2+具有还原性,他的理由有二:①将酸性高锰酸钾稀释也可能产生该现象、②___________ , 为证实该反应中Fe2+确实被氧化,需要在反应后的溶液中加入试剂___________ ,观察到现象___________ 。
II.探究FeCl3溶液的性质。
小组同学进行如下实验操作并观察到对应现象:
(6)iv中反应的离子方程式是___________ 。
(7)vi 中滴加氯水过程中,氯水反应的离子方程式是___________ 。
III.小组同学探究vi中褪色原因,提出两种假设: a.铁离子被转化,b. SCN被转化。
(8)分别向褪色后的溶液中滴加0.1 mol/L FeCl3溶液和KSCN溶液各1滴,观察到___________ 现象,得出结论:假设b成立。
(9)进一步预测SCN-可能被转化为SO ,通过实验验证了该预测,写出实验操作及现象
,通过实验验证了该预测,写出实验操作及现象___________ 。
I.探究FeCl2溶液的性质。
(1)从物质类别角度判断FeCl2属于
(2)预测FeCl2具有氧化性,因此可以与Zn反应,此时Zn体现
(3)预测FeCl2具有还原性,预测依据是
(4)进行如下实验操作:
 | 序号 | 操作 |
| i | 滴加NaOH溶液 | |
| ii | 加入少量锌粉 | |
| iii | 滴加酸性KMnO4溶液 |
②ii中反应的离子方程式是
③iii中的现象是
(5)某同学认为iii中现象并不能证明Fe2+具有还原性,他的理由有二:①将酸性高锰酸钾稀释也可能产生该现象、②
II.探究FeCl3溶液的性质。
小组同学进行如下实验操作并观察到对应现象:
| 操作 | 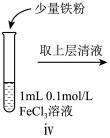 |  | 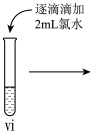 |
| 现象 | 溶液由棕黄色变为浅绿色 | 无明显现象 | 溶液变为红色, 而后红色褪去 |
(7)vi 中滴加氯水过程中,氯水反应的离子方程式是
III.小组同学探究vi中褪色原因,提出两种假设: a.铁离子被转化,b. SCN被转化。
(8)分别向褪色后的溶液中滴加0.1 mol/L FeCl3溶液和KSCN溶液各1滴,观察到
(9)进一步预测SCN-可能被转化为SO
 ,通过实验验证了该预测,写出实验操作及现象
,通过实验验证了该预测,写出实验操作及现象
您最近一年使用:0次
2022-01-12更新
|
721次组卷
|
5卷引用:9.2.1反应的合理选择(课后)-2019苏教版必修2课前课中课后
9.2.1反应的合理选择(课后)-2019苏教版必修2课前课中课后(已下线)3.1.2 铁盐和亚铁盐-2022-2023学年高一化学上学期课后培优分级练(人教版2019必修第一册)河南省郑州市第七高级中学2023-2024学年高一上学期12月考试化学试题北京市昌平区2021-2022学年高一上学期期末考试化学试题 广东省广州市第二中学2022-2023学年高一上学期12月月考化学试题
8 . 现有 和
和 的混合溶液,利用此溶液进行下面的实验。请回答下列问题:
的混合溶液,利用此溶液进行下面的实验。请回答下列问题:
(1)探究 的氧化性:取适量溶液于试管中,滴加几滴淀粉KI溶液,反应现象为
的氧化性:取适量溶液于试管中,滴加几滴淀粉KI溶液,反应现象为________ ,离子方程式为________ 。
(2)探究 的还原性:取适量溶液于试管中,滴加几滴酸性
的还原性:取适量溶液于试管中,滴加几滴酸性 溶液,反应现象为
溶液,反应现象为________ ,反应的离子方程式为________ 。
(3)制取 溶液:取适量溶液于试管中,向该溶液中加入试剂
溶液:取适量溶液于试管中,向该溶液中加入试剂________ (填名称),离子方程式为________ 。
(4)制取 溶液:取适量溶液于试管中,向该溶液中加入试剂
溶液:取适量溶液于试管中,向该溶液中加入试剂________ (填名称),离子方程式为________ 。
 和
和 的混合溶液,利用此溶液进行下面的实验。请回答下列问题:
的混合溶液,利用此溶液进行下面的实验。请回答下列问题:(1)探究
 的氧化性:取适量溶液于试管中,滴加几滴淀粉KI溶液,反应现象为
的氧化性:取适量溶液于试管中,滴加几滴淀粉KI溶液,反应现象为(2)探究
 的还原性:取适量溶液于试管中,滴加几滴酸性
的还原性:取适量溶液于试管中,滴加几滴酸性 溶液,反应现象为
溶液,反应现象为(3)制取
 溶液:取适量溶液于试管中,向该溶液中加入试剂
溶液:取适量溶液于试管中,向该溶液中加入试剂(4)制取
 溶液:取适量溶液于试管中,向该溶液中加入试剂
溶液:取适量溶液于试管中,向该溶液中加入试剂
您最近一年使用:0次
2020-09-23更新
|
241次组卷
|
2卷引用:9.2.1反应的合理选择(课后)-2019苏教版必修2课前课中课后
名校
解题方法
9 . (1)过氧化钙(CaO2·8H2O)是一种在水产养殖中广泛使用的供氧剂。
①Ca(OH)2悬浊液与H2O2溶液反应可制备CaO2·8H2O。Ca(OH)2+H2O2+6H2O=CaO2·8H2O,反应时通常加入过量的Ca(OH)2,其目的________________________________ 。
②向池塘水中加入一定量CaO2·8H2O后,池塘水中浓度增加的离子有________ (填序号)。
A.Ca2+ B.H+ C.CO32- D.OH-
(2)用铝粉和Fe2O3做铝热反应实验,需要的试剂还有________ 。
A.KCl B.KClO3 C.MnO2 D.Mg
取少量铝热反应所得的固体混合物,将其溶于足量稀H2SO4,滴加KSCN溶液无明显现象,________ (填“能”或“不能”)说明固体混合物中无Fe2O3,理由是______________ (用离子方程式说明)。
①Ca(OH)2悬浊液与H2O2溶液反应可制备CaO2·8H2O。Ca(OH)2+H2O2+6H2O=CaO2·8H2O,反应时通常加入过量的Ca(OH)2,其目的
②向池塘水中加入一定量CaO2·8H2O后,池塘水中浓度增加的离子有
A.Ca2+ B.H+ C.CO32- D.OH-
(2)用铝粉和Fe2O3做铝热反应实验,需要的试剂还有
A.KCl B.KClO3 C.MnO2 D.Mg
取少量铝热反应所得的固体混合物,将其溶于足量稀H2SO4,滴加KSCN溶液无明显现象,
您最近一年使用:0次
2020-02-14更新
|
148次组卷
|
2卷引用:9.1.2金属的冶炼(课后)-2019苏教版必修2课前课中课后
解题方法
10 . 如图为铁及其化合物的“价-类”二维图。
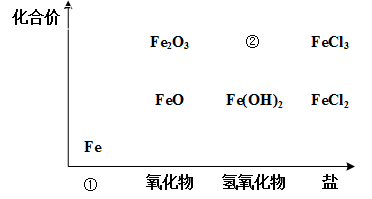
(1)填写二维图缺失的类别①___ 和化学式②___ 。
(2)某同学利用以下试剂研究FeCl3性质,进行了如下预测:
①Cl2②Fe ③NaOH ④H2SO4⑤AgNO3
从物质类别上看,FeCl3属于___ ,可能与___ 发生反应(填序号);
从化合价角度看,Fe3+具有___ 性,可能与___ 发生反应(填序号)。
(3)某工厂用FeCl3溶液腐蚀镀有铜的绝缘板生产印刷电路,其化学原理为如下反应:Cu+2FeCl3=CuCl2+2FeCl2
①用单线桥表示电子转移。___ 。
②反应中FeCl3作___ 剂,理由是___ 。
③写出该反应的离子方程式___ 。

(1)填写二维图缺失的类别①
(2)某同学利用以下试剂研究FeCl3性质,进行了如下预测:
①Cl2②Fe ③NaOH ④H2SO4⑤AgNO3
从物质类别上看,FeCl3属于
从化合价角度看,Fe3+具有
(3)某工厂用FeCl3溶液腐蚀镀有铜的绝缘板生产印刷电路,其化学原理为如下反应:Cu+2FeCl3=CuCl2+2FeCl2
①用单线桥表示电子转移。
②反应中FeCl3作
③写出该反应的离子方程式
您最近一年使用:0次
2019-11-15更新
|
322次组卷
|
3卷引用:微专题(六) ——利用“价—类”二维图认识铁及其化合物的转化



