1 . Fe3S4固体是一种重要的磁性材料,以它为原料实现如下化合物的转化: 的形式存在,溶液呈亮黄色。
的形式存在,溶液呈亮黄色。
请回答:
(1)依据B→C→D的现象,判断Cl-、SCN-、CN-与Fe3+的配位能力由强到弱依次为___________ ,无色酸性溶液F中的含硫阴离子有___________ 。
(2)Fe3S4能与稀硫酸反应,生成一种淡黄色不溶物和一种气体(标准状况下的密度为1.518g∙L-1),写出该反应的离子方程式___________ 。
(3)下列说法正确的是___________。
(4)写出F→G反应的化学方程式___________ 。请设计实验方案确定溶液G中的阴离子___________ 。

 的形式存在,溶液呈亮黄色。
的形式存在,溶液呈亮黄色。请回答:
(1)依据B→C→D的现象,判断Cl-、SCN-、CN-与Fe3+的配位能力由强到弱依次为
(2)Fe3S4能与稀硫酸反应,生成一种淡黄色不溶物和一种气体(标准状况下的密度为1.518g∙L-1),写出该反应的离子方程式
(3)下列说法正确的是___________。
| A.固体A中可能含有FeO | B.无色气体E能完全溶于水 |
| C.溶液C呈酸性,是由于Fe3+水解 | D.溶液B可溶解铜 |
(4)写出F→G反应的化学方程式
您最近一年使用:0次
2022·浙江·模拟预测
解题方法
2 . 化合物A由四种常见元素组成,是一种重要的化工原料。某实验小组按如图所示流程进行相关实验:
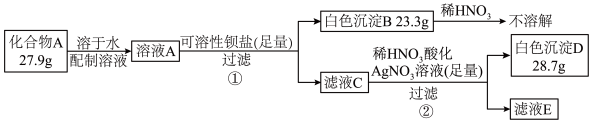
已知化合物A含有两种阴离子和一种阳离子,向溶液A滴加 溶液产生蓝色沉淀。
溶液产生蓝色沉淀。
请回答:
(1)组成A的四种元素为_______ ;A的化学式为_______ 。
(2)滤液C加稀硝酸酸化时产生了无色气体,该反应的离子方程式为_______ 。
(3)①溶液A中加入稍过量的 溶液,生成沉淀的同时有一种气体产生,写出反应的化学方程式:
溶液,生成沉淀的同时有一种气体产生,写出反应的化学方程式:_______ 。
②D可以溶解在 的浓溶液中,沉淀消失变为无色溶液,该反应的离子方程式为
的浓溶液中,沉淀消失变为无色溶液,该反应的离子方程式为_______ 。
(4)设计实验检验化合物A是否变质,在下表中填写检验出化合物A没有变质的方案。

已知化合物A含有两种阴离子和一种阳离子,向溶液A滴加
 溶液产生蓝色沉淀。
溶液产生蓝色沉淀。请回答:
(1)组成A的四种元素为
(2)滤液C加稀硝酸酸化时产生了无色气体,该反应的离子方程式为
(3)①溶液A中加入稍过量的
 溶液,生成沉淀的同时有一种气体产生,写出反应的化学方程式:
溶液,生成沉淀的同时有一种气体产生,写出反应的化学方程式:②D可以溶解在
 的浓溶液中,沉淀消失变为无色溶液,该反应的离子方程式为
的浓溶液中,沉淀消失变为无色溶液,该反应的离子方程式为(4)设计实验检验化合物A是否变质,在下表中填写检验出化合物A没有变质的方案。
| 实验操作 | 实验现象 | 实验结论 |
您最近一年使用:0次
名校
解题方法
3 . 黄色固体X是由四种元素组成的化合物,用作颜料和食品的抗结剂,为测定其组成,进行如下实验。已知气体D能使澄清石灰水变浑浊,溶液F中只含有一种溶质。回答下列问题:
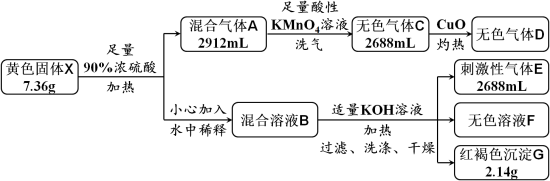
(1)固体X的组成元素是_______ 。
(2)混合气体A中所含物质的化学式为_______ 。
(3)实验中溶液B由X转化而来的溶质与KOH反应的总离子方程式为_______ 。
(4)证明沉淀G中的金属元素已完全沉淀的方法是_______ 。
(5)X与酸性KMnO4溶液反应,可生成一种与X组成元素相同,但式量比其小39的化合物,该反应的化学方程式为_______ 。

(1)固体X的组成元素是
(2)混合气体A中所含物质的化学式为
(3)实验中溶液B由X转化而来的溶质与KOH反应的总离子方程式为
(4)证明沉淀G中的金属元素已完全沉淀的方法是
(5)X与酸性KMnO4溶液反应,可生成一种与X组成元素相同,但式量比其小39的化合物,该反应的化学方程式为
您最近一年使用:0次
2022-12-09更新
|
426次组卷
|
4卷引用:浙江省温州市普通高中2023届高三下学期第二次适应性考试化学试题变式题(无机推断题)
(已下线)浙江省温州市普通高中2023届高三下学期第二次适应性考试化学试题变式题(无机推断题)浙江省诸暨海亮高级中学2021-2022学年高三12月份选考模拟化学试题浙江省舟山中学2022-2023学年高三上学期首考模拟卷(三)化学试题甘肃省两县高中联考2023-2024学年高三上学期12月月考化学试题
4 . 为探究某固体化合物X(仅含两种元素)的组成和性质,设计并完成如下实验,请回答:

(1)X中的非金属元素是_______ 。
(2)红棕色化合物与稀硫酸反应的离子方程式是_______ 。
(3)设计实验方案检验黄色溶液中的金属阳离子_______ 。

(1)X中的非金属元素是
(2)红棕色化合物与稀硫酸反应的离子方程式是
(3)设计实验方案检验黄色溶液中的金属阳离子
您最近一年使用:0次
名校
5 . 酸式盐X由4种元素组成。某兴趣小组按如下流程进行实验:

请回答:
(1)组成X的元素有___________ ,X的化学式为___________ 。
(2)溶液C中溶质的成分是___________ (用化学式表示)。
(3)写出D→E的化学方程式___________ 。
(4)根据D→E的现象,给出相应微粒与阳离子结合由弱到强的排序___________ 。

请回答:
(1)组成X的元素有
(2)溶液C中溶质的成分是
(3)写出D→E的化学方程式
(4)根据D→E的现象,给出相应微粒与阳离子结合由弱到强的排序
您最近一年使用:0次
真题
名校
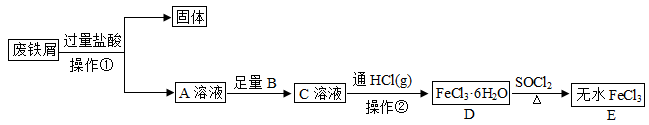
6 . 无水 常作为芳烃氯代反应的催化剂。某研究小组设计了如下流程,以废铁屑(含有少量碳和
常作为芳烃氯代反应的催化剂。某研究小组设计了如下流程,以废铁屑(含有少量碳和 杂质)为原料制备无水
杂质)为原料制备无水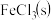 。
。
已知:氯化亚砜(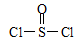 )熔点-101℃,沸点76℃,易水解。
)熔点-101℃,沸点76℃,易水解。
回答问题:
(1)操作①是过滤,用到的玻璃仪器有烧杯、玻璃棒和___________ 。
(2)为避免引入新的杂质,试剂B可以选用___________(填编号)。
(3)操作②是蒸发结晶,加热的同时通入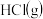 的目的是
的目的是___________ 。
(4)取少量 晶体,溶于水并滴加
晶体,溶于水并滴加 溶液,现象是
溶液,现象是___________ 。
(5)反应 的化学方程式为
的化学方程式为___________ 。
(6)由 转化成
转化成 的过程中可能产生少量亚铁盐,写出一种可能的还原剂
的过程中可能产生少量亚铁盐,写出一种可能的还原剂___________ ,并设计实验验证是该还原剂将 还原
还原___________ 。
 常作为芳烃氯代反应的催化剂。某研究小组设计了如下流程,以废铁屑(含有少量碳和
常作为芳烃氯代反应的催化剂。某研究小组设计了如下流程,以废铁屑(含有少量碳和 杂质)为原料制备无水
杂质)为原料制备无水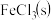 。
。已知:氯化亚砜(
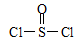 )熔点-101℃,沸点76℃,易水解。
)熔点-101℃,沸点76℃,易水解。
回答问题:
(1)操作①是过滤,用到的玻璃仪器有烧杯、玻璃棒和
(2)为避免引入新的杂质,试剂B可以选用___________(填编号)。
A. 溶液 溶液 | B. 水 水 | C. 水 水 | D. 溶液 溶液 |
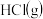 的目的是
的目的是(4)取少量
 晶体,溶于水并滴加
晶体,溶于水并滴加 溶液,现象是
溶液,现象是(5)反应
 的化学方程式为
的化学方程式为(6)由
 转化成
转化成 的过程中可能产生少量亚铁盐,写出一种可能的还原剂
的过程中可能产生少量亚铁盐,写出一种可能的还原剂 还原
还原
您最近一年使用:0次
2021-10-23更新
|
6021次组卷
|
12卷引用:解密06 金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)
(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)考点10 铁及其重要化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)考点14 铁及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点47 无机工艺流程(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)2021年新高考海南化学高考真题2021年海南高考化学试题变式题11-19安徽省黄山市2022-2023学年高二下学期期末考试化学试题(已下线)【知识图鉴】单元讲练测必修第一册第三单元03巩固练黑龙江省七台河市勃利县高级中学2023-2024学年高三上学期9月月考化学试题天津市滨海新区田家炳中学2023-2024学年高三上学期期中考试化学试题山东省菏泽外国语学校2023-2024学年高三上学期第一次月考化学试卷
名校
解题方法
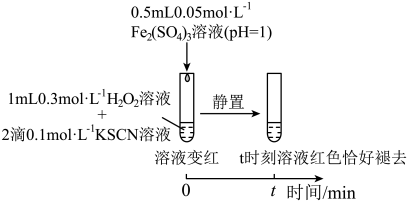
7 . 某小组在验证H2O2氧化Fe2+时发现异常现象,并对其进行深入探究。
实验I:
(1)实验I中溶液变红是因为Fe3+与SCN-发生了反应,其离子方程式是__ 。
(2)探究实验I中红色褪去的原因:取反应后溶液,___ (填实验操作和现象),证明溶液中有Fe3+,而几乎无SCN-。
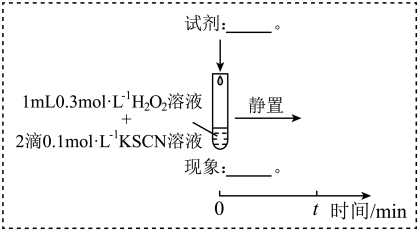
(3)研究发现,酸性溶液中H2O2能氧化SCN-,但反应很慢且无明显现象,而实验I中褪色相对较快,由此推测Fe3+能加快H2O2与SCN-的反应。通过实验II和III得到了证实。参照实验II的图例,在虚线框内补全实验III:__ 。
实验II:
实验III:
(4)查阅资料:Fe3+加快H2O2与SCN-反应的主要机理有
i.Fe3++H2O2=Fe2++HO2·+H+
ii.Fe2++H2O2=Fe3++·OH+OH-
iii.OH(羟基自由基)具有强氧化性,能直接氧化SCN-
为探究Fe2+对H2O2与SCN-反应速率的影响,设计实验如图:
实验IV:

①t′<t,对比实验IV和II可得出结论:在本实验条件下,___ 。
②结合资料和(1)~(4)的研究过程,从反应速率和化学平衡的角度解释实验I中溶液先变红后褪色的原因:____ 。
③实验I~IV中均有O2生成,小组同学推测可能是HO2·与溶液中其他微粒相互作用生成的,这些微粒有___ 。
实验I:
| 装置与操作 | 现象 |
 | 溶液立即变红,继续滴加H2O2溶液,红色变浅并逐渐褪去 |
(2)探究实验I中红色褪去的原因:取反应后溶液,
(3)研究发现,酸性溶液中H2O2能氧化SCN-,但反应很慢且无明显现象,而实验I中褪色相对较快,由此推测Fe3+能加快H2O2与SCN-的反应。通过实验II和III得到了证实。参照实验II的图例,在虚线框内补全实验III:
实验II:

实验III:

(4)查阅资料:Fe3+加快H2O2与SCN-反应的主要机理有
i.Fe3++H2O2=Fe2++HO2·+H+
ii.Fe2++H2O2=Fe3++·OH+OH-
iii.OH(羟基自由基)具有强氧化性,能直接氧化SCN-
为探究Fe2+对H2O2与SCN-反应速率的影响,设计实验如图:
实验IV:

①t′<t,对比实验IV和II可得出结论:在本实验条件下,
②结合资料和(1)~(4)的研究过程,从反应速率和化学平衡的角度解释实验I中溶液先变红后褪色的原因:
③实验I~IV中均有O2生成,小组同学推测可能是HO2·与溶液中其他微粒相互作用生成的,这些微粒有
您最近一年使用:0次
2021-08-13更新
|
633次组卷
|
7卷引用:考点32 化学反应条件的控制-备战2022年高考化学一轮复习考点帮(浙江专用)
2021高三·浙江·专题练习
解题方法
8 . 对于已达平衡的可逆反应,当其他条件不变时,改变反应物或生成物的浓度会对化学平衡有何影响?
[猜想与假设]
假设1:化学反应处于平衡状态时,其他条件不变,增加反应物浓度,使平衡向正反应方向移动。
假设2:化学反应处于平衡状态时,其他条件不变,增加反应物浓度,使平衡向逆反应方向移动。
假设3:化学反应处于平衡状态时,其他条件不变,增加生成物浓度,使平衡向逆反应方向移动。
假设4:化学反应处于平衡状态时,其他条件不变,增加生成物浓度,使平衡向正反应方向移动。
[设计和实施方案]
在已反应平衡的FeCl3和KSCN的混合液中,分别加入:①FeCl3溶液②KSCN溶液③KCl固体④NaF溶液
实验用品:
仪器:烧杯、玻璃棒、胶头滴管
试剂:FeCl3(aq)(0.01mol·L-11.0mol·L-1),KSCN(aq)(0.01mol·L-11.0mol·L-1),KCl(s),NaF(aq)(1.0mol·L-1)。
实验步骤:
Ⅰ.往250mL烧杯中加入100mL蒸馏水,然后加入10mL0.01mol·L-1FeCl3溶液,再加入10mL0.01mol·L-1KSCN溶液,溶液由黄色变成橙红色。
Ⅱ.取5支试管,编号分别为1,2,3,4,5,然后各取步骤(1)中FeCl3和KSCN的混合溶液4mL加到5支试管中。往1号试管滴加2~3滴1.0mol·L-1FeCl3溶液,振荡,观察现象;往2号试管滴加2~3滴1.0mol·L-1KSCN溶液,振荡,观察现象;往3号试管中加入少量KCl固体,振荡,观察现象;往4号试管中滴加2~3滴1.0mol·L-1NaF溶液,振荡,观察现象。
根据你所学的内容完成下列表格,并回答有关问题。
(1)FeCl3与KSCN溶液反应
(2)由①②现象说明假设___ 成立,假设___ 不成立。
(3)根据Fe3++3SCN- Fe(SCN)3,加入KCl固体,颜色不应该有变化,但现象却是变浅了,请你分析变浅的可能原因是
Fe(SCN)3,加入KCl固体,颜色不应该有变化,但现象却是变浅了,请你分析变浅的可能原因是__ 。
(4)根据“4”号试管中的现象,分析在4号试管中发生的变化是___ ,说明了___ (从改变浓度影响平衡移动角度回答)。
[猜想与假设]
假设1:化学反应处于平衡状态时,其他条件不变,增加反应物浓度,使平衡向正反应方向移动。
假设2:化学反应处于平衡状态时,其他条件不变,增加反应物浓度,使平衡向逆反应方向移动。
假设3:化学反应处于平衡状态时,其他条件不变,增加生成物浓度,使平衡向逆反应方向移动。
假设4:化学反应处于平衡状态时,其他条件不变,增加生成物浓度,使平衡向正反应方向移动。
[设计和实施方案]
在已反应平衡的FeCl3和KSCN的混合液中,分别加入:①FeCl3溶液②KSCN溶液③KCl固体④NaF溶液
实验用品:
仪器:烧杯、玻璃棒、胶头滴管
试剂:FeCl3(aq)(0.01mol·L-11.0mol·L-1),KSCN(aq)(0.01mol·L-11.0mol·L-1),KCl(s),NaF(aq)(1.0mol·L-1)。
实验步骤:
Ⅰ.往250mL烧杯中加入100mL蒸馏水,然后加入10mL0.01mol·L-1FeCl3溶液,再加入10mL0.01mol·L-1KSCN溶液,溶液由黄色变成橙红色。
Ⅱ.取5支试管,编号分别为1,2,3,4,5,然后各取步骤(1)中FeCl3和KSCN的混合溶液4mL加到5支试管中。往1号试管滴加2~3滴1.0mol·L-1FeCl3溶液,振荡,观察现象;往2号试管滴加2~3滴1.0mol·L-1KSCN溶液,振荡,观察现象;往3号试管中加入少量KCl固体,振荡,观察现象;往4号试管中滴加2~3滴1.0mol·L-1NaF溶液,振荡,观察现象。
根据你所学的内容完成下列表格,并回答有关问题。
(1)FeCl3与KSCN溶液反应
| 编号 | 混合溶液颜色 | 滴加的溶液 | 溶液颜色的变化 | 平衡移动的方向 |
| 1 | 橙红色 | FeCl3 | ①颜色 | ③向 |
| 2 | 橙红色 | KSCN | ②颜色 | ④向 |
| 3 | 橙红色 | KCl | 颜色变浅了,由橙红色变成了黄色 | ⑤向 |
| 4 | 橙红色 | NaF | 颜色变浅了,由橙红色变成了无色 | ⑥向 |
| 5 | 橙红色 | - | 橙红色 | 不移动 |
(3)根据Fe3++3SCN-
 Fe(SCN)3,加入KCl固体,颜色不应该有变化,但现象却是变浅了,请你分析变浅的可能原因是
Fe(SCN)3,加入KCl固体,颜色不应该有变化,但现象却是变浅了,请你分析变浅的可能原因是(4)根据“4”号试管中的现象,分析在4号试管中发生的变化是
您最近一年使用:0次
解题方法
9 . 实验室由铁泥(主要成分为铁的氧化物,还含有少量 和CaO等)制备软磁性材料
和CaO等)制备软磁性材料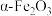 。其主要实验流程如下:
。其主要实验流程如下:

(1)酸浸:用一定浓度的 溶液浸取铁泥中的铁元素。若其他条件不变,实验中能加快铁元素浸出速率的措施有
溶液浸取铁泥中的铁元素。若其他条件不变,实验中能加快铁元素浸出速率的措施有_______ (写出一种方法),酸浸后的滤渣的主要成分是_______ 、_______ 。
(2)还原:向“酸浸”后的滤液中加入过量铁粉,使 完全转化为
完全转化为 。“还原”过程中发生的主要反应的离子方程式为
。“还原”过程中发生的主要反应的离子方程式为_______ ﹔检验 完全被还原的实验方案为
完全被还原的实验方案为_______ 。
(3)除杂:向“还原”后的滤液中加入 溶液,使
溶液,使 转化为
转化为 沉淀除去。若溶液的酸性较强,将会导致
沉淀除去。若溶液的酸性较强,将会导致 沉淀不完全,其原因是
沉淀不完全,其原因是_______ (从平衡移动的角度分析,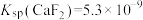 ,
,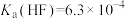 )。
)。
(4)沉铁:将提纯后的 溶液与氨水—
溶液与氨水— 混合溶液反应,生成
混合溶液反应,生成 沉淀。生成
沉淀。生成 沉淀的离子方程式为
沉淀的离子方程式为_______ 。
 和CaO等)制备软磁性材料
和CaO等)制备软磁性材料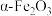 。其主要实验流程如下:
。其主要实验流程如下:
(1)酸浸:用一定浓度的
 溶液浸取铁泥中的铁元素。若其他条件不变,实验中能加快铁元素浸出速率的措施有
溶液浸取铁泥中的铁元素。若其他条件不变,实验中能加快铁元素浸出速率的措施有(2)还原:向“酸浸”后的滤液中加入过量铁粉,使
 完全转化为
完全转化为 。“还原”过程中发生的主要反应的离子方程式为
。“还原”过程中发生的主要反应的离子方程式为 完全被还原的实验方案为
完全被还原的实验方案为(3)除杂:向“还原”后的滤液中加入
 溶液,使
溶液,使 转化为
转化为 沉淀除去。若溶液的酸性较强,将会导致
沉淀除去。若溶液的酸性较强,将会导致 沉淀不完全,其原因是
沉淀不完全,其原因是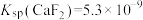 ,
,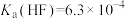 )。
)。(4)沉铁:将提纯后的
 溶液与氨水—
溶液与氨水— 混合溶液反应,生成
混合溶液反应,生成 沉淀。生成
沉淀。生成 沉淀的离子方程式为
沉淀的离子方程式为
您最近一年使用:0次
10 . 某工厂的工业废水中含有大量的FeSO4和CuSO4,为了减少污染并变废为宝,工厂拟定用以下流程从该废水中回收FeSO4和金属Cu。请根据以下流程图,回答相关问题:
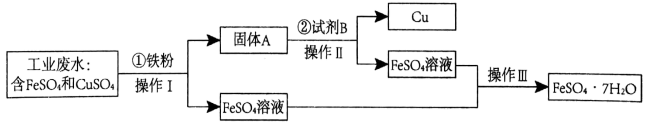
(1)操作Ⅰ和操作Ⅱ的方法是___ 。
(2)为了将CuSO4完全 转化,步骤①加入的铁粉应___ (选填“过量”或“少量”),其对应的化学方程式 为___ 。
(3)固体A的成分是铁和____ (填名称)。
(4)操作Ⅱ加入试剂B的稀溶液,B的化学式为___ ,该物质在该反应中作___ 剂(选填“氧化”或“还原”)。
(5)取1~2mLFeSO4溶液于试管中,滴加几滴NaOH溶液,生成的白色沉淀迅速变为灰绿色,最后变成红褐色,写出该反应中沉淀转化对应的化学反应方程式___ 。
(6)另取1~2mLFeSO4溶液于试管中,滴加几滴氯水,再滴加几滴___ 溶液,溶液变为血红色。

(1)操作Ⅰ和操作Ⅱ的方法是
(2)为了将CuSO4
(3)固体A的成分是铁和
(4)操作Ⅱ加入试剂B的稀溶液,B的化学式为
(5)取1~2mLFeSO4溶液于试管中,滴加几滴NaOH溶液,生成的白色沉淀迅速变为灰绿色,最后变成红褐色,写出该反应中沉淀转化对应的化学反应方程式
(6)另取1~2mLFeSO4溶液于试管中,滴加几滴氯水,再滴加几滴
您最近一年使用:0次
2021-06-24更新
|
574次组卷
|
4卷引用:考点15 铁及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)
(已下线)考点15 铁及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考点15 铁及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)云南省普洱市第一中学天有实验学校2020—2021学年高一下学期 (文科)月考化学试题云南省玉溪市江川区第二中学2020-2021学年高一下学期期末考试化学试卷



