1 . 下列实验中,对应的现象以及结论都正确且两者具有因果关系的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 在空气中点燃氢气,然后把导管伸入盛满氯气的集气瓶中 | 氢气安静地燃烧,发出淡蓝色火焰 | 燃烧反应不一定要有氧气参加 |
| B | 将一小块钠投入盛有 溶液的烧杯中 溶液的烧杯中 | 烧杯底部析出红色固体 | 金属活动性: |
| C | 向 溶液中逐滴加入少量稀 溶液中逐滴加入少量稀 | 溶液导电能力不断减弱 | 生成的 不能发生电离 不能发生电离 |
| D | 向盛有 溶液的试管中滴加无色的维生素C溶液 溶液的试管中滴加无色的维生素C溶液 | 溶液黄色褪去 | 维生素 具有还原性 具有还原性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-02-18更新
|
341次组卷
|
3卷引用:2022年重庆高考真题化学试题变式题(选择题6-10)
名校
解题方法
2 . 化学在医学上起到至关重要的作用。如:小苏打、氢氧化铝等可治疗胃酸(主要成分为稀盐酸)过多;硫酸亚铁可补铁、防治贫血;三价铬用于加强胰岛素的作用。试回答下列问题:
(1)写出小苏打与胃酸作用的离子方程式:_______ ,但该药剂缺点是易导致胃胀气,胃溃疡患者不能使用,而氢氧化铝很好的解决了这个问题,它在中和胃酸的同时,保护溃疡面,写出氢氧化铝与胃酸作用的化学方程式为_______ 。
(2)利用提供试剂设计实验证明补铁剂中铁元素都以+2存在(可选试剂:硫氰化钾、过氧化氢):_______ (填写实验操作、现象和结论)。
(3)三价铬是人体必需的微量元素,六价铬则严重危害人体健康,铬元素化合价循环示意图如下【已知: 可溶于水;
可溶于水; 难溶于水】:
难溶于水】:
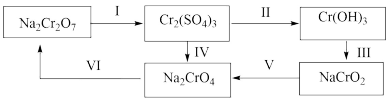
①步骤I所用的试剂是硫酸酸化的 ,请写出该反应的离子方程式;
,请写出该反应的离子方程式;_______
②现有含 和
和 的溶液,逐滴滴加NaOH溶液至过量,由上图信息可知,铁元素、铬元素的存在形态分别是
的溶液,逐滴滴加NaOH溶液至过量,由上图信息可知,铁元素、铬元素的存在形态分别是_______ 、_______ ;
③向50mL0.03mol/L的 溶液中,加入50mL0.2mol/L的NaOH溶液,写出相应离子反应方程式
溶液中,加入50mL0.2mol/L的NaOH溶液,写出相应离子反应方程式_______ 。
(1)写出小苏打与胃酸作用的离子方程式:
(2)利用提供试剂设计实验证明补铁剂中铁元素都以+2存在(可选试剂:硫氰化钾、过氧化氢):
(3)三价铬是人体必需的微量元素,六价铬则严重危害人体健康,铬元素化合价循环示意图如下【已知:
 可溶于水;
可溶于水; 难溶于水】:
难溶于水】:
①步骤I所用的试剂是硫酸酸化的
 ,请写出该反应的离子方程式;
,请写出该反应的离子方程式;②现有含
 和
和 的溶液,逐滴滴加NaOH溶液至过量,由上图信息可知,铁元素、铬元素的存在形态分别是
的溶液,逐滴滴加NaOH溶液至过量,由上图信息可知,铁元素、铬元素的存在形态分别是③向50mL0.03mol/L的
 溶液中,加入50mL0.2mol/L的NaOH溶液,写出相应离子反应方程式
溶液中,加入50mL0.2mol/L的NaOH溶液,写出相应离子反应方程式
您最近一年使用:0次
2023-01-12更新
|
426次组卷
|
2卷引用:重庆市南开中学2022-2023学年高一上期期末考试化学试题
3 . 下列方案设计、现象和结论都正确的是
| 目的 | 方案设计 | 现象和结论 | |
| A | 检验 溶液中 溶液中 是否被氧化 是否被氧化 | 取少量待测液,滴加KSCN溶液,观察溶液颜色变化 | 若溶液呈红色,则说明有 被氧化 被氧化 |
| B | 探究干燥 是否具有漂白性 是否具有漂白性 | 将鲜花投入盛有干燥氯气的集气瓶中 | 鲜花褪色,说明干燥氯气具有漂白性 |
| C | 探究碳酸钠样品是否变质为 | 在稀盐酸中加入少量可能变质的碳酸钠样品 | 立即有气体产生,则说明 已经变质,有一部分转化为 已经变质,有一部分转化为 |
| D | 探究钠是否变质 | 将表面已经变质的钠投入水中 | 产生无色无味的气体,则说明钠已经变质,有一部分被氧化为 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-01-12更新
|
425次组卷
|
2卷引用:重庆市南开中学2022-2023学年高一上期期末考试化学试题
名校
解题方法
4 . 向500mL含等物质的量的FeCl3和FeCl2混合溶液中加入一定量锌粉,反应过程过程中各离子的物质的量与加入锌粉的物质的量关系如图所示。
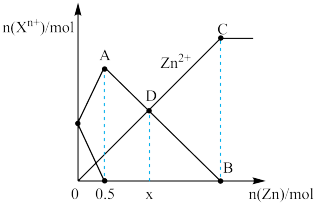
下列说法中正确的是

下列说法中正确的是
| A.线段AB表示溶液中n(Fe3+)的变化趋势 |
| B.起始时,FeCl3溶液和FeCl2溶液的物质的量浓度均为1mol/L |
| C.D点的横坐标x=1.5mol |
| D.反应至B点时,溶液总质量增加50.5g |
您最近一年使用:0次
2022-12-10更新
|
865次组卷
|
7卷引用:重庆市第八中学2022-2023学年高一上学期第二次月考化学试题
名校
解题方法
5 . 根据实验目的,下列方案设计、现象和结论不正确的是
| 选项 | 实验目的 | 方案设计 | 现象和结论 |
| A | 验证NaCl、Na2SO4混合溶液中的Cl- | 取少量混合溶液于试管中,加入过量的Ba(NO3)2溶液,静置,向上层清液中滴加AgNO3溶液 | 若上层清液变浑浊,则混合溶液中含有Cl- |
| B | 探究碳酸钠溶液显碱性是由 水解导致 水解导致 | 取2.0mL0.1 mol∙L-1Na2CO3溶液,滴入3滴酚酞,观察现象,再滴入几滴1mol/L BaCl2溶液 | 滴入酚酞溶液变红,再滴入BaCl2后出现白色沉淀,溶液颜色变浅 |
| C | 探究铝在浓硝酸中会发生钝化 | 将去除氧化膜的铝片放入浓硝酸中,一段时间后取出用水洗净,放入硫酸铜溶液 | 铝片表面未见紫红色固体,说明铝片已钝化 |
| D | 证明氧化性:Cl2>Fe3+> | 向2支盛有FeCl2溶液的试管中分别通入氯气。向其中一支滴加KSCN溶液,向另一支依次滴加H2SO3溶液和BaCl2溶液 | 第一支试管中溶液变成血红色,第二支试管中产生白色沉淀,则证明氧化性:Cl2>Fe3+> |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
6 . 下列物质性质陈述及其应用的描述中,均合理且有对应关系的是
| 选项 | 性质 | 应用 |
| A | 二氧化硫有较强的还原性 | 用于漂白纸浆、毛、丝等 |
| B | 聚乙烯燃烧生成CO2和H2O | 用聚乙烯塑料制作食品保鲜膜 |
| C | 二氧化硅常温下能和强碱溶液反应 | 可用氢氧化钠溶液雕刻玻璃 |
| D | 氯化铁具有一定的氧化性 | 铁制广告牌上的图形可用氯化铁溶液蚀刻而成 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
7 . 铁及其化合物在生产生活中具有重要的应用,高铁酸钾(K2FeO4)是一种高效水处理剂,紫色固体。已知K2FeO4具有下列性质:①可溶于水,溶液为紫色,微溶于浓KOH溶液;②在0℃~5℃、强碱性溶液中比较稳定。某实验小组制备并探究K2FeO4性质,回答下列问题:
(1)制备K2FeO4(夹持装置略):

①A为氯气发生装置,其中仪器a的名称是_______ ,固体甲的化学式为_______ ,浓盐酸在该反应中表现的性质为_______ ;将Cl2通过装置B可除去杂质,以免影响实验,B中的试剂是_______ 。
②C为制备K2FeO4的装置,采用冰水浴的原因是_______ ,KClO与Fe(OH)3在碱性环境中反应生成K2FeO4,该氧化还原反应中氧化剂与还原剂的物质的量之比为_______ 。
③D为尾气处理装置,发生反应的离子方程式为_______ 。
(2)探究K2FeO4的性质:
根据实验1和2的现象,写出K2FeO4在酸性条件下发生反应的离子方程式_______ 。
(1)制备K2FeO4(夹持装置略):

①A为氯气发生装置,其中仪器a的名称是
②C为制备K2FeO4的装置,采用冰水浴的原因是
③D为尾气处理装置,发生反应的离子方程式为
(2)探究K2FeO4的性质:
| 实验1 | 取少量C中紫色溶液,加入过量稀硫酸,迅速产生大量气体,该气体能使带火星的木条复燃。 |
| 实验2 | 取实验1中的溶液,滴加KSCN溶液至过量,溶液呈红色。 |
您最近一年使用:0次
2022-04-04更新
|
648次组卷
|
2卷引用:重庆市第八中学校2021-2022学年高一上学期期末考试化学试题
名校
解题方法
8 . 下列实验操作中,其现象、解释及结论均正确的是
| 序号 | 实验操作 | 实验现象 | 解释或结论 |
| A | 取少量Fe与水蒸气高温反应的固体产物于试管中,加足量的稀硫酸溶解,再滴入硫氰化钾溶液 | 溶液未出现血红色 | 反应后的固体产物没有+3的铁 |
| B | 向含有ZnS的悬浊液中滴入少量的CuSO4溶液 | 出现黑色沉淀 | Ksp(CuS)<Ksp(ZnS) |
| C | 加热乙醇与浓H2SO4的混合溶液,将产生的气体直接通入酸性高锰酸钾溶液中 | 溶液紫色褪去 | 产生的气体一定是乙烯 |
| D | 向BaCl2溶液中通入SO2和X气体 | 产生白色沉淀 | 气体X一定具有强氧化性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
9 . 某工厂的废水中含有较多的 和
和 。为了减少污染并变废为宝, 用如图所示的工艺流程从废水中回收
。为了减少污染并变废为宝, 用如图所示的工艺流程从废水中回收 和金属铜。
和金属铜。
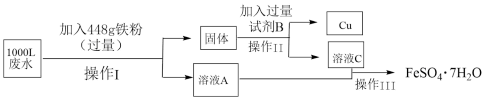
请回答下列问题:
(1)向废水中加入铁粉,所发生的主要反应的离子方程式为___________ 。
(2)操作Ⅰ和操作Ⅱ的名称是___________ ,所用到的玻璃仪器有___________ 。
(3)流程中“固体”的主要成分是___________ (填化学式);加入试剂B所发生反应的化学方程式为___________ 。
(4)操作Ⅲ包括蒸发浓缩、___________ 、过滤、___________ 、干燥。
(5)设计实验方案检验废水中是否含有 :
:___________ 。
(6)若废水中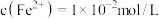 ,
,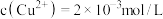 ,上述1000L废水经处理后,理论上可获得
,上述1000L废水经处理后,理论上可获得 的质量是
的质量是___________ g。
 和
和 。为了减少污染并变废为宝, 用如图所示的工艺流程从废水中回收
。为了减少污染并变废为宝, 用如图所示的工艺流程从废水中回收 和金属铜。
和金属铜。
请回答下列问题:
(1)向废水中加入铁粉,所发生的主要反应的离子方程式为
(2)操作Ⅰ和操作Ⅱ的名称是
(3)流程中“固体”的主要成分是
(4)操作Ⅲ包括蒸发浓缩、
(5)设计实验方案检验废水中是否含有
 :
:(6)若废水中
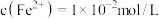 ,
,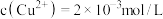 ,上述1000L废水经处理后,理论上可获得
,上述1000L废水经处理后,理论上可获得 的质量是
的质量是
您最近一年使用:0次
名校
10 . 向盛有2mLFeCl3溶液的试管中加入少量铁粉,进行如下实验。下列分析正确的是
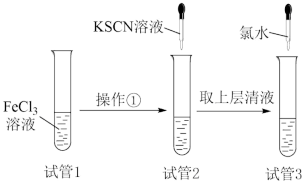

| A.只加入KSCN溶液可检验试管1中是否含有Fe2+ |
| B.试管2中无现象,则表明试管1中溶液不含Fe3+ |
| C.试管3中的离子反应为:Fe2++Cl2=Fe3++2Cl- |
| D.试管3中必定有红色沉淀生成 |
您最近一年使用:0次
2022-01-24更新
|
1650次组卷
|
8卷引用:重庆市南开中学2022-2023学年高一上学期12月定时练习化学试题
重庆市南开中学2022-2023学年高一上学期12月定时练习化学试题四川巴中市巴州区2021-2022学年高一上学期期末教学质量监测化学试题(已下线)2022年广东卷高考真题变式题(11-16)(已下线)第15讲 铁盐和亚铁盐(讲义)-【帮课堂】2022-2023学年高一化学同步精品讲义(人教2019必修第一册 )(已下线)铁 金属材料——课时2 铁盐和亚铁盐黑龙江省海林市朝鲜族中学2022-2023学年高一上学期期末考试化学试题安徽省六安市裕安区新安中学2022-2023学年高一下学期期中考试化学试题河北唐山市开滦第二中学2022-2023学年高一下学期6月月考化学试题



