1 . 实验室用如下装置制取氯气,并进行氯气性质实验。回答下列问题:

已知:E中放置干燥红色布条,F中放置湿润红色布条。
(1)A中盛有浓盐酸,B中盛有 。加热时B中的化学方程式为
。加热时B中的化学方程式为___________ 。
(2)在实验室通过KMnO4与浓盐酸常温下反应也可制取氯气,据此推断KMnO4、Cl2、MnO2三种物质的氧化性由强到弱的顺序为___________ (用化学式表示)。
(3)D中盛放的试剂为___________ 。
(4)对比E和F中现象的差异可得出的结论是___________ 。
(5)实验后观察到G中溶液呈棕黄色,同学们猜测氧化产物可能有以下三种情况:
猜测1:只有Fe3+;
猜测2:只有I2;
猜测3:既有Fe3+又有I2。
于是取上述实验后G中的溶液进行如下实验:
①加入___________ 溶液,溶液未出现红色,证明猜测1和猜测3不正确;
②再加入___________ (填试剂和现象)证明猜测2正确。
由此得出离子的还原性Fe2+___________ I-(填“大于”,“等于”,“小于”)。
(6)H装置可用于模拟工业制造漂白粉的原理,实验后制得产品的有效成分是___________ (填化学式)。

已知:E中放置干燥红色布条,F中放置湿润红色布条。
(1)A中盛有浓盐酸,B中盛有
 。加热时B中的化学方程式为
。加热时B中的化学方程式为(2)在实验室通过KMnO4与浓盐酸常温下反应也可制取氯气,据此推断KMnO4、Cl2、MnO2三种物质的氧化性由强到弱的顺序为
(3)D中盛放的试剂为
(4)对比E和F中现象的差异可得出的结论是
(5)实验后观察到G中溶液呈棕黄色,同学们猜测氧化产物可能有以下三种情况:
猜测1:只有Fe3+;
猜测2:只有I2;
猜测3:既有Fe3+又有I2。
于是取上述实验后G中的溶液进行如下实验:
①加入
②再加入
由此得出离子的还原性Fe2+
(6)H装置可用于模拟工业制造漂白粉的原理,实验后制得产品的有效成分是
您最近一年使用:0次
2 . 电子工业中常用FeCl3溶液做“腐蚀液”,腐蚀覆铜板制作印刷电路板。为使“腐蚀液”能得到循环利用并回收铜的流程图如下:
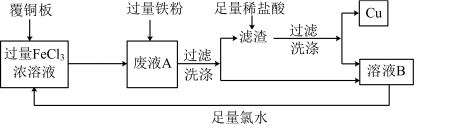
(1)写出FeCl3溶液与铜反应的离子方程式___________ 。
(2)滤渣的成分为___________ (填化学式)。
(3)加足量氯水后反应的离子方程式为___________ 。
(4)将少量溶液B滴入氢氧化钠溶液中,产生的现象是___________ 。
(5)能在酸性环境下将Fe2+氧化为Fe3+的氧化剂有KMnO4、KClO3、H2O2、Cl2等。已知下列四种氧化剂氧化Fe2+后对应的还原产物如下:
①判断等物质的量的四种氧化剂分别与足量的酸性FeSO4溶液反应,得到Fe3+最多的是___________ (填化学式)。
②写出KClO3溶液与酸性FeSO4溶液反应的离子方程式___________ 。
(6)取废液A加入12.6 g铁粉,充分反应后过滤、洗涤、干燥得滤渣 11.0 g,滤渣与足量盐酸反应后过滤、洗涤、干燥得到9.6 g Cu。合并两次的滤液和洗涤液得溶液B 500 mL,则溶液B中含FeCl2的物质的量浓度为___________ mol/L。

(1)写出FeCl3溶液与铜反应的离子方程式
(2)滤渣的成分为
(3)加足量氯水后反应的离子方程式为
(4)将少量溶液B滴入氢氧化钠溶液中,产生的现象是
(5)能在酸性环境下将Fe2+氧化为Fe3+的氧化剂有KMnO4、KClO3、H2O2、Cl2等。已知下列四种氧化剂氧化Fe2+后对应的还原产物如下:
| 氧化剂 | KMnO4 | KClO3 | H2O2 | Cl2 |
| 还原产物 | Mn2+ | Cl- | H2O | Cl- |
②写出KClO3溶液与酸性FeSO4溶液反应的离子方程式
(6)取废液A加入12.6 g铁粉,充分反应后过滤、洗涤、干燥得滤渣 11.0 g,滤渣与足量盐酸反应后过滤、洗涤、干燥得到9.6 g Cu。合并两次的滤液和洗涤液得溶液B 500 mL,则溶液B中含FeCl2的物质的量浓度为
您最近一年使用:0次
3 . 由下列实验操作及现象不能够得出相应结论的是
| 选项 | 操作 | 现象 | 结论 |
| A | 将石墨电极放入NaCl溶液中,连接小灯泡,接通电源 | 小灯泡变亮 | NaCl是电解质 |
| B | 向澄清的苯酚钠溶液中通入CO2气体 | 溶液变浑浊 | 苯酚的酸性比碳酸弱 |
| C | 把水滴入盛有少量Na2O2的试管中,立即把带火星木条放在试管口 | 木条复燃 | 反应生成了O2 |
| D | 向可能含有Fe2+的FeCl3溶液中加入酸性KMnO4溶液 | 酸性 KMnO4溶液褪色 | FeCl3溶液中混有Fe2+杂质离子 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
4 . 高铁酸钾(K2FeO4)是一种新型绿色消毒剂,常用ClO-和Fe3+在KOH溶液中制得,同时生成KCl,下列说法正确的是
| A.随着反应的进行,溶液碱性会增强 |
| B.该反应中,氧化产物和还原产物个数比为3:2 |
| C.检验反应后溶液中的C1-,可加入AgNO3溶液,若产生白色沉淀则有Cl- |
| D.K2FeO4对饮用水杀菌消毒时,自身被还原为Fe(OH)3胶体,可吸附水中悬浮物 |
您最近一年使用:0次
2023-12-04更新
|
235次组卷
|
3卷引用:重庆实验外国语学校2023-2024学年高一上学期11月半期检测化学试题
重庆实验外国语学校2023-2024学年高一上学期11月半期检测化学试题江西省上饶市婺源天佑中学2023-2024学年高一上学期12月考试化学试题(已下线)寒假作业07 铁及其化合物-【寒假分层作业】2024年高一化学寒假培优练(人教版2019必修第一册)
解题方法
5 . 为了保护环境、利用锰资源,可通过如下流程用废旧电池中黑锰粉(含有 、MnOOH、
、MnOOH、 和少量
和少量 、
、 及炭黑等)制备
及炭黑等)制备 。
。
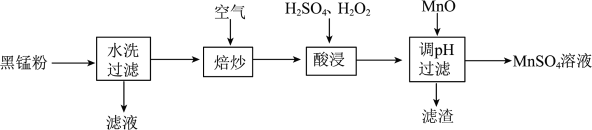
请回答下列问题:
(1)元素Mn在周期表中的位置是_______ , 中含有的化学键类型是
中含有的化学键类型是_______ 。
(2)“焙炒”时 除氧化MnOOH外,还有一个作用是
除氧化MnOOH外,还有一个作用是_______ ;写出 与MnOOH反应的化学方程式
与MnOOH反应的化学方程式_______ 。
(3)加快“酸浸”速率的措施是_______ (写两条即可);“酸浸”时除了固体溶解、溶液颜色变化外,还可能有的现象是_______ ;“酸浸”中加 的目的是
的目的是_______ 。
(4)“滤渣”的主要成分是_______ 。
(5)请设计实验方案检验所得 溶液中无
溶液中无 :
:_______ (写出操作、现象和结论)。
 、MnOOH、
、MnOOH、 和少量
和少量 、
、 及炭黑等)制备
及炭黑等)制备 。
。
请回答下列问题:
(1)元素Mn在周期表中的位置是
 中含有的化学键类型是
中含有的化学键类型是(2)“焙炒”时
 除氧化MnOOH外,还有一个作用是
除氧化MnOOH外,还有一个作用是 与MnOOH反应的化学方程式
与MnOOH反应的化学方程式(3)加快“酸浸”速率的措施是
 的目的是
的目的是(4)“滤渣”的主要成分是
(5)请设计实验方案检验所得
 溶液中无
溶液中无 :
:
您最近一年使用:0次
名校
解题方法
6 . 某小组在验证反应“ ”,实验探究过程如下。结合探究过程回答下列问题。
”,实验探究过程如下。结合探究过程回答下列问题。
向硝酸酸化的 硝酸银溶液中(忽略
硝酸银溶液中(忽略 的水解)加入过量铁粉,搅拌后静置,一段时间后,将烧杯底部黑色固体过滤,滤液呈黄色。
的水解)加入过量铁粉,搅拌后静置,一段时间后,将烧杯底部黑色固体过滤,滤液呈黄色。
(1)检测到滤液中含有 ,可以选用的试剂为
,可以选用的试剂为___________ (填化学式)溶液。 产生的原因可能有以下几种。
产生的原因可能有以下几种。
假设a:可能是铁粉表面有氧化层,能产生 。
。
假设b:空气中存在 ,
, 被氧化为
被氧化为 ,写出反应的离子方程式:
,写出反应的离子方程式:___________ 。
假设c:酸性溶液中的 具有氧化性,可产生
具有氧化性,可产生 。
。
(2)某同学证明上面假设c不成立,向硝酸酸化的___________ 硝酸钠溶液中加入过量铁粉,搅拌后静置,一段时间后,上层清液未变黄色,经检验无 。
。
(3)取过滤后的黑色固体,洗涤后,___________ (填操作和现象),证明黑色固体中含有Ag。
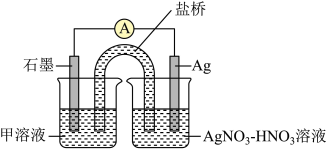
(4)某同学利用原电池证明 可以将
可以将 氧化为
氧化为 ,设计了如图所示的原电池装置。连接装置后,电流表中有电流通过,一段时间后电流表不再偏转(所用溶液均已去除
,设计了如图所示的原电池装置。连接装置后,电流表中有电流通过,一段时间后电流表不再偏转(所用溶液均已去除 )。甲溶液中的溶质为
)。甲溶液中的溶质为___________ 。写出石墨电极上发生的电极反应式:___________ 。电流表指针不再偏转后,向左侧烧杯中加入 固体,发现电流表指针反向偏转,此时石墨电极为
固体,发现电流表指针反向偏转,此时石墨电极为___________ (填“正极”或“负极”),银电极的电极反应式为___________ 。
 ”,实验探究过程如下。结合探究过程回答下列问题。
”,实验探究过程如下。结合探究过程回答下列问题。向硝酸酸化的
 硝酸银溶液中(忽略
硝酸银溶液中(忽略 的水解)加入过量铁粉,搅拌后静置,一段时间后,将烧杯底部黑色固体过滤,滤液呈黄色。
的水解)加入过量铁粉,搅拌后静置,一段时间后,将烧杯底部黑色固体过滤,滤液呈黄色。(1)检测到滤液中含有
 ,可以选用的试剂为
,可以选用的试剂为 产生的原因可能有以下几种。
产生的原因可能有以下几种。假设a:可能是铁粉表面有氧化层,能产生
 。
。假设b:空气中存在
 ,
, 被氧化为
被氧化为 ,写出反应的离子方程式:
,写出反应的离子方程式:假设c:酸性溶液中的
 具有氧化性,可产生
具有氧化性,可产生 。
。(2)某同学证明上面假设c不成立,向硝酸酸化的
 。
。(3)取过滤后的黑色固体,洗涤后,
(4)某同学利用原电池证明
 可以将
可以将 氧化为
氧化为 ,设计了如图所示的原电池装置。连接装置后,电流表中有电流通过,一段时间后电流表不再偏转(所用溶液均已去除
,设计了如图所示的原电池装置。连接装置后,电流表中有电流通过,一段时间后电流表不再偏转(所用溶液均已去除 )。甲溶液中的溶质为
)。甲溶液中的溶质为 固体,发现电流表指针反向偏转,此时石墨电极为
固体,发现电流表指针反向偏转,此时石墨电极为
您最近一年使用:0次
2023-10-26更新
|
610次组卷
|
7卷引用:重庆市百师联盟2024届高三一轮复习联考(二)
解题方法
7 . 铁华粉最早记载于《开宝本草》,为铁粉与醋作用后的锈末,具有养血安神、平肝镇惊的功效,主治血虚、健忘。利用铁华粉进行的实验及其现象如下所示:
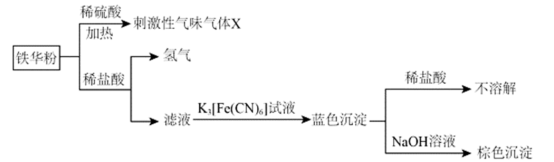
下列相关说法错误的是

下列相关说法错误的是
| A.X为醋酸 |
B.铁华粉中起治疗作用的成分可能为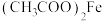 |
C.生成蓝色沉淀的离子方程式为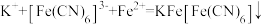 |
D.由上述实验可知, 结合 结合 的能力大于 的能力大于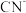 |
您最近一年使用:0次
8 . 某废旧合金材料中主要含Fe、Cu、Al及其氧化物,为节约和充分利用资源,通过如下工艺流程回收Cu、Al,并制取绿矾等。
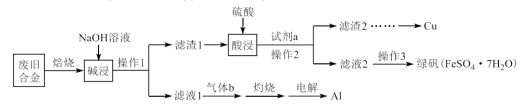
回答下列问题:
(1)写出“碱浸”时发生反应的化学方程式_______ 。
(2)“滤液1”中通入过量“气体b”产生沉淀,写出其反应的离子方程式_______ 。
(3)操作3包括加入少量稀硫酸、_______ 、过滤、洗涤、干燥。
(4)绿矾可用作净水剂,在医学上可用作补血剂,绿矾在空气中易被氧化为硫酸铁等。
①为检验绿矾中是否含有 ,可选择的最佳试剂组合是
,可选择的最佳试剂组合是_______ (填标号)。
a.稀盐酸、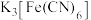 溶液 b.稀硝酸、KSCN溶液
溶液 b.稀硝酸、KSCN溶液
c.稀盐酸、KSCN溶液 d.稀硫酸、NaOH溶液
②现取一定量部分被氧化的绿矾,溶于稀盐酸后,加入足量的 溶液,过滤得9.32g沉淀;再通入标准状况下
溶液,过滤得9.32g沉淀;再通入标准状况下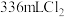 ,恰好将滤液中的
,恰好将滤液中的 完全氧化。则该绿矾中
完全氧化。则该绿矾中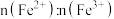 的比值是多少
的比值是多少______ (不要求计算过程)?

回答下列问题:
(1)写出“碱浸”时发生反应的化学方程式
(2)“滤液1”中通入过量“气体b”产生沉淀,写出其反应的离子方程式
(3)操作3包括加入少量稀硫酸、
(4)绿矾可用作净水剂,在医学上可用作补血剂,绿矾在空气中易被氧化为硫酸铁等。
①为检验绿矾中是否含有
 ,可选择的最佳试剂组合是
,可选择的最佳试剂组合是a.稀盐酸、
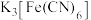 溶液 b.稀硝酸、KSCN溶液
溶液 b.稀硝酸、KSCN溶液c.稀盐酸、KSCN溶液 d.稀硫酸、NaOH溶液
②现取一定量部分被氧化的绿矾,溶于稀盐酸后,加入足量的
 溶液,过滤得9.32g沉淀;再通入标准状况下
溶液,过滤得9.32g沉淀;再通入标准状况下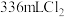 ,恰好将滤液中的
,恰好将滤液中的 完全氧化。则该绿矾中
完全氧化。则该绿矾中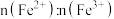 的比值是多少
的比值是多少
您最近一年使用:0次
9 . 铁是人体必需的微量元素。某研究小组通过设计实验以检验菠菜中是否含有铁元素,其实验流程如图所示,下列说法错误的是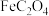 。
。

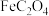 。
。| A.上述实验流程中操作①②都是过滤 |
| B.向溶液2中加入HNO3后再滴入KSCN溶液无现象,说明菠菜中的铁元素不是以水溶性物质存在的 |
| C.向溶液3中滴加KSCN溶液后变红,说明菠菜中存在三价的铁元素 |
D.反应③的离子方程式为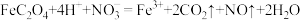 |
您最近一年使用:0次
2023-04-11更新
|
990次组卷
|
6卷引用:重庆市第八中学校2023-2024学年高三上学期入学测试化学试题
重庆市第八中学校2023-2024学年高三上学期入学测试化学试题(已下线)押题卷化学(五)(已下线)题型35 微型成套装置实验流程山东省淄博市张店区2022-2023学年高一下学期5月期中考试化学试题(已下线)专题07 无机物的转化 微型工艺流程-2023年高考化学真题题源解密(全国通用)陕西省咸阳市实验中学2023-2024学年高三下学期适应训练(一)化学试题
名校
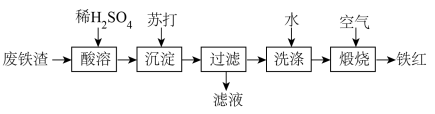
10 . 铁红( )可用于油漆、油墨、橡胶等工业中,可作为玻璃、宝石、金属的抛光剂等。某课外活动小组用废铁渣(含
)可用于油漆、油墨、橡胶等工业中,可作为玻璃、宝石、金属的抛光剂等。某课外活动小组用废铁渣(含 和少量
和少量 )制取铁红,所设计的流程如下:
)制取铁红,所设计的流程如下:
请回答下列问题:
(1)苏打的化学式为_______ ;沉淀的化学式为_______ ;“滤液”中主要溶质的化学式为_______
(2)要检测“酸溶”后,溶液中是否含有 所用的试剂是
所用的试剂是_______ ;若溶液中检测不到 的原因是
的原因是_______ ;
(3)“酸溶”时, 与稀硫酸反应的离子方程式为
与稀硫酸反应的离子方程式为_______
(4)实验室过滤所需的玻璃仪器有_______
(5)煅烧的化学方程式为_______
 )可用于油漆、油墨、橡胶等工业中,可作为玻璃、宝石、金属的抛光剂等。某课外活动小组用废铁渣(含
)可用于油漆、油墨、橡胶等工业中,可作为玻璃、宝石、金属的抛光剂等。某课外活动小组用废铁渣(含 和少量
和少量 )制取铁红,所设计的流程如下:
)制取铁红,所设计的流程如下:
请回答下列问题:
(1)苏打的化学式为
(2)要检测“酸溶”后,溶液中是否含有
 所用的试剂是
所用的试剂是 的原因是
的原因是(3)“酸溶”时,
 与稀硫酸反应的离子方程式为
与稀硫酸反应的离子方程式为(4)实验室过滤所需的玻璃仪器有
(5)煅烧的化学方程式为
您最近一年使用:0次
2023-02-11更新
|
377次组卷
|
2卷引用:重庆市南开中学校2022-2023学年高一上学期期末联合检测化学试题



