名校
1 . 绿矾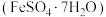 主要用于净水、照相制版及治疗缺铁性贫血等。工业上利用生活废铁(主要成分为
主要用于净水、照相制版及治疗缺铁性贫血等。工业上利用生活废铁(主要成分为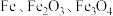 ,以及少量
,以及少量 等)制备绿矾的一种工艺流程如下:
等)制备绿矾的一种工艺流程如下:
(1)“焙烧”的目的是______ 。
(2)提高“酸溶”反应速率的措施是______ (任写一条)。“反应”时发生反应的离子方程式为______ 。
(3)隔绝空气的目的是______ ;一系列操作包括______ 、干燥。
(4)“酸溶”后,若溶液中 为
为 ,为了减少损失,常温下必须控制溶液的
,为了减少损失,常温下必须控制溶液的 小于
小于______  已知:
已知: 。
。
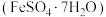 主要用于净水、照相制版及治疗缺铁性贫血等。工业上利用生活废铁(主要成分为
主要用于净水、照相制版及治疗缺铁性贫血等。工业上利用生活废铁(主要成分为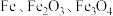 ,以及少量
,以及少量 等)制备绿矾的一种工艺流程如下:
等)制备绿矾的一种工艺流程如下: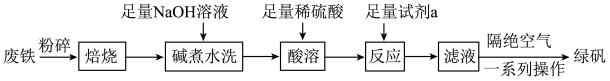
(1)“焙烧”的目的是
(2)提高“酸溶”反应速率的措施是
(3)隔绝空气的目的是
(4)“酸溶”后,若溶液中
 为
为 ,为了减少损失,常温下必须控制溶液的
,为了减少损失,常温下必须控制溶液的 小于
小于 已知:
已知: 。
。
您最近一年使用:0次
名校
2 . 向盛有5mL0.005mol/LFeCl3溶液的试管中加入5mL0.015mol/LKSCN溶液,观察现象。将上述溶液平均分装在a、b、c三支试管中,向试管b中加入少量铁粉,向试管c中滴加vmLxmol/LKSCN溶液,观察试管b、c中溶液颜色的变化,并均与试管a对比。下列说法正确的是
| A.FeCl3溶液和KSCN溶液可以产生红色沉淀 |
| B.b试管中的现象说明:当其他条件不变时,增大生成物浓度平衡向逆反应方向移动 |
| C.为了证明其他条件不变时,增大反应物的浓度平衡向正反应方向移动,则x应该尽可能的大,而v应该尽可能的小 |
| D.若向试管a中加入4滴1mol/L的KCl溶液,溶液颜色会变深 |
您最近一年使用:0次
2023-11-09更新
|
142次组卷
|
2卷引用:湖南省长沙市长郡中学2023-2024学年高二上学期期中考试化学试题
名校
3 . 下列离子方程式正确的是
A.向 溶液中加入过量铁粉: 溶液中加入过量铁粉: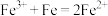 |
B.碳酸钙溶于醋酸: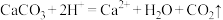 |
C.次氯酸钙溶液通入 : : |
D.向稀硝酸中加入铜片: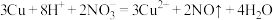 |
您最近一年使用:0次
2023-05-11更新
|
317次组卷
|
3卷引用:湖南省岳阳市岳阳县第一中学2023-2024学年高一下学期4月期中考试化学试题
名校
解题方法
4 . 黄铁矿烧渣(主要成分为Fe2O3、FeO、及少量FeS、SiO2等)是生产硫酸的工业废渣,其综合利用对环境保护具有现实意义。利用黄铁矿烧渣为原料制备高档颜料—铁红(Fe2O3)(主要成分为Fe2O3不考虑其他杂质),并以铁红为原料制备硫酸亚铁晶体(FeSO4·7H2O)的工艺:
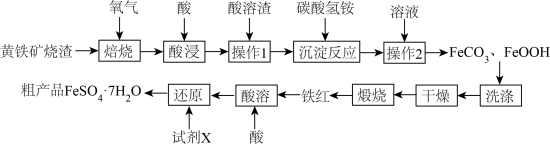
(1)焙烧的过程中采用如图所示的“多层逆流焙烧”,“多层逆流焙烧”的优点是_______ (任答两点)。

(2)“酸浸”时温度比较高,最适合的酸是_______ ,“酸溶渣”的成分是_______ 。
(3)“沉淀反应”中,生成FeCO3的离子方程式是_______ 。
(4)检验FeCO3是否洗涤干净的操作方法_______ 。
(5)从过滤后的滤液中得到产品,应进行的操作是_______ 、_______ 、过滤、洗涤、干燥。
(6)FeSO4·7H2O在医学上常用作补血剂。某课外小组通过以下实验方法测定某补血剂中亚铁离子的含量:
步骤I:取20片补血剂样品除去糖衣、研磨、溶解、过滤,将滤液配成250mL溶液。
步骤Ⅱ:取上述溶液25mL于锥形瓶中,加入少量稀硫酸酸化后,逐渐滴加0.0200 mol/L的KMnO4溶液,至恰好完全反应,记录消耗的KMnO4溶液的体积(假定药品中其他成分不与KMnO4反应,且 )。
)。
步骤Ⅲ:重复“步骤II”2-3次,平均消耗KMnO4溶液10.00mL。
①步骤I中配制溶液时需要的玻璃仪器除烧杯、量筒,玻璃棒外,还需要_______ 、_______ 。
②该补血剂中亚铁离子的含量为_______ mg/片。

(1)焙烧的过程中采用如图所示的“多层逆流焙烧”,“多层逆流焙烧”的优点是

(2)“酸浸”时温度比较高,最适合的酸是
(3)“沉淀反应”中,生成FeCO3的离子方程式是
(4)检验FeCO3是否洗涤干净的操作方法
(5)从过滤后的滤液中得到产品,应进行的操作是
(6)FeSO4·7H2O在医学上常用作补血剂。某课外小组通过以下实验方法测定某补血剂中亚铁离子的含量:
步骤I:取20片补血剂样品除去糖衣、研磨、溶解、过滤,将滤液配成250mL溶液。
步骤Ⅱ:取上述溶液25mL于锥形瓶中,加入少量稀硫酸酸化后,逐渐滴加0.0200 mol/L的KMnO4溶液,至恰好完全反应,记录消耗的KMnO4溶液的体积(假定药品中其他成分不与KMnO4反应,且
 )。
)。步骤Ⅲ:重复“步骤II”2-3次,平均消耗KMnO4溶液10.00mL。
①步骤I中配制溶液时需要的玻璃仪器除烧杯、量筒,玻璃棒外,还需要
②该补血剂中亚铁离子的含量为
您最近一年使用:0次
2022-11-13更新
|
217次组卷
|
2卷引用:浙江省永州市重点中学2022-2023学年高二上学期期中考试化学试题
解题方法
5 . 下列实验中,对应的现象以及结论都正确且两者具有因果关系的是
| 选项 | 实验 | 现象 | 结论 |
| A | 向稀硝酸中加入铁粉,充分反应后滴加KSCN溶液 | 溶液没有呈血红色 | 硝酸只能将铁粉氧化为 |
| B | 将少量 溶液滴加到相同浓度的 溶液滴加到相同浓度的 、 、 的混合溶液 的混合溶液 | 产生黄色沉淀 |  |
| C | 向 溶液中通入 溶液中通入 | 产生白色浑浊 | 非金属性:C>Si |
| D | 压缩装有HI、 、 、 混合气体(已达平衡状态)的容器 混合气体(已达平衡状态)的容器 | 气体颜色变深 | 平衡向生成 方向移动导致其浓度增大 方向移动导致其浓度增大 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-11-23更新
|
212次组卷
|
2卷引用:湖南省天壹名校联盟.宁乡市2021-2022学年高三11月调研考试化学试题
名校
解题方法
6 . 综合利用富钛废渣(含TiO2、ZnO、Fe2O3和少量有机物)制备锂离子电池正极材料中间体,并获得部分副产品的工艺流程如图:
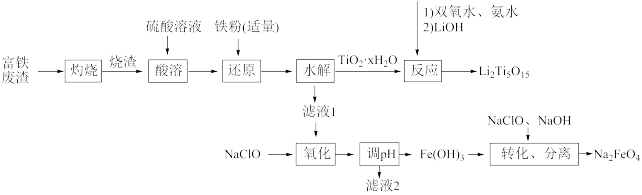
已知:Ksp[Zn(OH)2]=1.0×10-17、Ksp[Fe(OH)2]=1.0×10-16、Ksp[Fe(OH)3]=1.0×10-38,溶液中离子浓度≤10-5mol/L时认为该离子沉淀完全。回答下列问题:
(1)“灼烧”除去的物质为___ 。
(2)“还原”(避免水解产生其他杂质)中发生的主要离子反应为___ 。
(3)“酸溶”后钛以TiO2+形式存在,则“水解”反应的离子方程式为___ 。
(4)若“氧化”后所得溶液中金属离子的浓度均为0.1mol/L,则“调pH”的合理范围为___ 。
(5)“转化、分离”生成Na2FeO4,氧化剂与还原剂的物质的量之比为___ 。

已知:Ksp[Zn(OH)2]=1.0×10-17、Ksp[Fe(OH)2]=1.0×10-16、Ksp[Fe(OH)3]=1.0×10-38,溶液中离子浓度≤10-5mol/L时认为该离子沉淀完全。回答下列问题:
(1)“灼烧”除去的物质为
(2)“还原”(避免水解产生其他杂质)中发生的主要离子反应为
(3)“酸溶”后钛以TiO2+形式存在,则“水解”反应的离子方程式为
(4)若“氧化”后所得溶液中金属离子的浓度均为0.1mol/L,则“调pH”的合理范围为
(5)“转化、分离”生成Na2FeO4,氧化剂与还原剂的物质的量之比为
您最近一年使用:0次
名校
解题方法
7 . FeCl3、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体存在,则下列判断不正确的是
| A.溶液中一定不含Cu2+ | B.溶液中一定含Fe2+ |
| C.加入KSCN溶液一定不变红色 | D.剩余固体中一定含Cu |
您最近一年使用:0次
2021-01-06更新
|
384次组卷
|
7卷引用:湖南省娄底市第一中学2020-2021学年高一下学期期中考试化学(高考班)试题
名校
解题方法
8 . 下列反应的离子方程式书写正确的是
| A.氯化铁与铁粉的反应:Fe3++Fe=2Fe2+ |
| B.氢氧化铜与稀硫酸的反应:OH-+H+=H2O |
| C.金属钠与水的反应:2Na+2H2O=2Na++2OH-+H2↑ |
D.铜与浓硝酸的反应:3Cu+8H++2NO =3Cu2++2NO↑+4H2O =3Cu2++2NO↑+4H2O |
您最近一年使用:0次
2020-11-18更新
|
110次组卷
|
2卷引用:湖南省临澧县第一中学2020-2021学年高二上学期期中考试化学试题(合格考)
名校
9 . 用过量的FeCl3溶液腐蚀铜制线路板,反应是Cu + 2FeCl3= 2FeCl2 + CuCl2 。取少量腐蚀反应完毕后的混合溶液,加入一定量的铁粉充分搅拌,发现仍有固体存在。则下列判断不正确 的是( )
| A.氧化性Fe3+ > Cu2+ | B.剩余固体中一定含Cu |
| C.有固体存在的溶液中一定无Cu2+ | D.有固体存在的溶液中一定含Fe2+ |
您最近一年使用:0次
2019-11-18更新
|
840次组卷
|
6卷引用:湖南省永州市第一中学2022-2023学年高一上学期期末考试化学试题
10 . 下列除杂方法正确的是
| A.用浓硫酸除去H2S中的H2O | B.用饱和碳酸氢钠除去Cl2中的HCl |
| C.用铁粉除去FeCl3溶液中的CuCl2 | D.用灼热的CuO除去CO2中的CO |
您最近一年使用:0次



