名校
1 . 磷酸铁( )主要在食品工业中用作营养增补剂(铁质强化剂),特别用于面包,也用可作饲料添加剂,工业上常以硫铁矿(主要成分是
)主要在食品工业中用作营养增补剂(铁质强化剂),特别用于面包,也用可作饲料添加剂,工业上常以硫铁矿(主要成分是 ,含少量
,含少量 ,
, 和
和 )为原料经过如下步骤制备磷酸铁。
)为原料经过如下步骤制备磷酸铁。

已知:① 溶于盐酸、硫酸,不溶于冷水。
溶于盐酸、硫酸,不溶于冷水。
②几种金属离子沉淀的pH如下表所示:
回答下列问题:
(1)高温“焙烧”时,用于盛放固体的仪器名称是___________ 。
(2)“还原”步骤中,检验反应已完全的实验操作是___________ 。
(3)“除铝”中加入 的作用是
的作用是___________ (用离子方程式表示)。
(4)试剂R可以是___________ 溶液(填化学式)。
(5)“沉铁”过程中,溶液的pH对磷酸铁产品中铁和磷的含量及 比值的影响如图所示[考虑到微量金属杂质,在pH=1时,
比值的影响如图所示[考虑到微量金属杂质,在pH=1时, 为0.973最接近理论值]。
为0.973最接近理论值]。

在pH范围为1~1.5时,随pH增大,产物 明显增大,其原因是
明显增大,其原因是___________ 。
(6)为得到纯净的 ,还应经过洗涤、干燥等系列操作,洗涤沉淀的操作是
,还应经过洗涤、干燥等系列操作,洗涤沉淀的操作是_________ 。
(7)新型镁-锂双离子二次电池的工作原理如图所示。

①充电时阳极的电极反应式为___________ 。
②当 时,则电极材料中
时,则电极材料中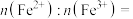
___________ 。
 )主要在食品工业中用作营养增补剂(铁质强化剂),特别用于面包,也用可作饲料添加剂,工业上常以硫铁矿(主要成分是
)主要在食品工业中用作营养增补剂(铁质强化剂),特别用于面包,也用可作饲料添加剂,工业上常以硫铁矿(主要成分是 ,含少量
,含少量 ,
, 和
和 )为原料经过如下步骤制备磷酸铁。
)为原料经过如下步骤制备磷酸铁。
已知:①
 溶于盐酸、硫酸,不溶于冷水。
溶于盐酸、硫酸,不溶于冷水。②几种金属离子沉淀的pH如下表所示:
| 金属氢氧化物 |  |  |  |
| 开始沉淀的pH | 2.3 | 7.5 | 4.0 |
| 完全沉淀的pH | 4.1 | 9.7 | 5.2 |
(1)高温“焙烧”时,用于盛放固体的仪器名称是
(2)“还原”步骤中,检验反应已完全的实验操作是
(3)“除铝”中加入
 的作用是
的作用是(4)试剂R可以是
(5)“沉铁”过程中,溶液的pH对磷酸铁产品中铁和磷的含量及
 比值的影响如图所示[考虑到微量金属杂质,在pH=1时,
比值的影响如图所示[考虑到微量金属杂质,在pH=1时, 为0.973最接近理论值]。
为0.973最接近理论值]。
在pH范围为1~1.5时,随pH增大,产物
 明显增大,其原因是
明显增大,其原因是(6)为得到纯净的
 ,还应经过洗涤、干燥等系列操作,洗涤沉淀的操作是
,还应经过洗涤、干燥等系列操作,洗涤沉淀的操作是(7)新型镁-锂双离子二次电池的工作原理如图所示。

①充电时阳极的电极反应式为
②当
 时,则电极材料中
时,则电极材料中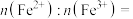
您最近一年使用:0次
名校
解题方法
2 . I.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钠的主要反应为:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中还原剂是___________ (填化学式)。
(2)湿法制备高铁酸钾(K2FeO4)是在碱性环境中进行,反应体系中有六种反应微粒:Fe(OH)3、ClO-、OH-、 、Cl-、H2O。
、Cl-、H2O。
①请依据上述信息,写出并配平湿法制高铁酸钾的离子方程式:___________ 。
②每生成2mol 转移
转移___________ mol电子,若反应过程中转移了0.5mol电子,则还原产物的物质的量为___________ mol。
II.工业上用氯化铁腐蚀铜箔、制造电路板。某工程师为了从使用过的腐蚀废液中回收铜,并获得氯化铁晶体,准备采用下列步骤:

回答下列问题:
(3)试剂a是___________ ,操作I用到的玻璃仪器有烧杯、玻璃棒和___________ 。
(4)滤液X、Z中都有同一种溶质,它们转化为溶液W的离子方程式为___________ 。
(5)上述流程中操作III包括___________ 、___________ 、过滤、洗涤。
(1)干法制备高铁酸钠的主要反应为:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中还原剂是
(2)湿法制备高铁酸钾(K2FeO4)是在碱性环境中进行,反应体系中有六种反应微粒:Fe(OH)3、ClO-、OH-、
 、Cl-、H2O。
、Cl-、H2O。①请依据上述信息,写出并配平湿法制高铁酸钾的离子方程式:
②每生成2mol
 转移
转移II.工业上用氯化铁腐蚀铜箔、制造电路板。某工程师为了从使用过的腐蚀废液中回收铜,并获得氯化铁晶体,准备采用下列步骤:

回答下列问题:
(3)试剂a是
(4)滤液X、Z中都有同一种溶质,它们转化为溶液W的离子方程式为
(5)上述流程中操作III包括
您最近一年使用:0次
2023-07-15更新
|
367次组卷
|
2卷引用:湖南省衡阳市2022-2023学年高一下学期期末检测化学试题
2022·河北·模拟预测
名校
解题方法
3 . 工业上以硼镁矿(主要成分为 ,还含有少量
,还含有少量 、
、 、
、 、
、 和
和 等)为原料生产硼酸晶体的工艺流程如图所示。
等)为原料生产硼酸晶体的工艺流程如图所示。
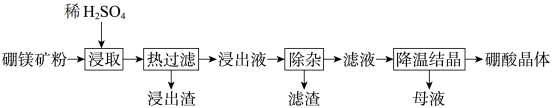
已知:① 的溶解度随温度的升高显著增大;
的溶解度随温度的升高显著增大;
② 、
、 、
、 和
和 以氢氧化物的形式完全沉淀时,溶液的
以氢氧化物的形式完全沉淀时,溶液的 分别为3.2、9.7、5.2和12.4。
分别为3.2、9.7、5.2和12.4。
下列说法错误的是
 ,还含有少量
,还含有少量 、
、 、
、 、
、 和
和 等)为原料生产硼酸晶体的工艺流程如图所示。
等)为原料生产硼酸晶体的工艺流程如图所示。
已知:①
 的溶解度随温度的升高显著增大;
的溶解度随温度的升高显著增大;②
 、
、 、
、 和
和 以氢氧化物的形式完全沉淀时,溶液的
以氢氧化物的形式完全沉淀时,溶液的 分别为3.2、9.7、5.2和12.4。
分别为3.2、9.7、5.2和12.4。下列说法错误的是
| A.“浸取”时要分批慢慢加入稀硫酸 |
B.“热过滤”的目的是防止温度降低时 从溶液中析出 从溶液中析出 |
C.“除杂”时需向“浸出液”中依次加入 和 和 溶液,以除去 溶液,以除去 、 、 、 、 等杂质离子 等杂质离子 |
| D.“母液”中的溶质主要是硫酸镁 |
您最近一年使用:0次
2023-01-20更新
|
656次组卷
|
8卷引用:湖南省衡阳八中2022-2023学年高三第四次月考化学试题
湖南省衡阳八中2022-2023学年高三第四次月考化学试题(已下线)2022年河北省新高考测评卷(一)(已下线)秘籍17 工艺流程的条件控制与计算-备战2022年高考化学抢分秘籍(全国通用)(已下线)专题14 物质的反应和转化-三年(2020-2022)高考真题分项汇编超重点7 金属与非金属交界处的3种重要元素湖南省常德市第一中学2022-2023学年高三下学期第六次月考化学试题湖南省攸县第一中学2023届高三第七次月考化学试题天津经济技术开发区第一中学(泰达一中)2023-2024学年高三上学期期中考试化学试卷
名校
解题方法
4 . 部分氧化的Fe—Cu合金样品(氧化产物为Fe2O3、CuO)共5.76g,经如图处理:

下列说法不正确的是

下列说法不正确的是
| A.样品中Fe元素的质量为2.24 g |
| B.V<896 |
| C.参与反应的n(H2SO4) = 0.04 mol |
| D.滤液A中的阳离子为Fe2+、Cu2+、H+ |
您最近一年使用:0次
名校
解题方法
5 . 以高硫铝土矿(主要成分为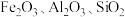 ,少量
,少量 和硫酸盐)为原料制备聚合硫酸铁
和硫酸盐)为原料制备聚合硫酸铁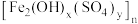 和明矾的部分工艺流程如下,下列说法错误的是
和明矾的部分工艺流程如下,下列说法错误的是
已知:赤泥液的主要成分为
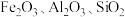 ,少量
,少量 和硫酸盐)为原料制备聚合硫酸铁
和硫酸盐)为原料制备聚合硫酸铁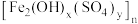 和明矾的部分工艺流程如下,下列说法错误的是
和明矾的部分工艺流程如下,下列说法错误的是
已知:赤泥液的主要成分为

A.赤泥液的作用是吸收“焙烧”阶段中产生的 |
B.聚合硫酸铁可用于净化自来水,与其组成中的 具有氧化性有关 具有氧化性有关 |
C.在“聚合”阶段,若增加 用量,会使 用量,会使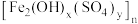 中x变小 中x变小 |
| D.从“滤液”到“明矾”的过程中还应有“除硅”步骤 |
您最近一年使用:0次
2022-05-12更新
|
828次组卷
|
7卷引用:湖南省常宁市第一中学2022届高三下学期第三次模拟考试化学试题
湖南省常宁市第一中学2022届高三下学期第三次模拟考试化学试题河南省大联考2022届高三上学期阶段性测试(一)化学试题(已下线)第二单元 化学物质及其变化(B卷 真题滚动练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)福建省龙岩第一中学2021-2022学年高三上学期第二次月考化学试题山西省怀仁市2021-2022学年高三上学期期中化学试题江西省景德镇市第一中学2021-2022学年高二上学期期末(重点班)化学试题湖南省郴州市第一中学2022届高三下学期期中考试化学试题
名校
解题方法
6 . 钪(Sc)是一种稀土金属。从钛白酸性废水(主要含Ti4+、 Fe2+、微量Sc3+) 中富集钪,并制备氧化钪(Sc2O3) 的工艺流程如下。下列说法不正确的是


| A.酸洗时加入H2O2的目的是将Fe2+氧化为Fe3+ |
| B.“操作 1”需要的玻璃仪器有烧杯、玻璃棒、漏斗 |
| C.“滤渣 1”的主要成分是Ti(OH)4、Fe(OH)3 |
D.草酸钪焙烧时反应的化学方程式: 2Sc2(C2O4)3 + 3O2 2Sc2O3+ 12CO2 2Sc2O3+ 12CO2 |
您最近一年使用:0次
2022-04-29更新
|
1693次组卷
|
8卷引用:湖南省百校联考(衡阳市二模)2022届髙三化学试题
湖南省百校联考(衡阳市二模)2022届髙三化学试题(已下线)专题13 物质的反应和转化-2022年高考真题模拟题分项汇编湖南省株洲市第二中学2022-2023学年高三上学期第五次月考化学试题(已下线)专题14 工艺流程选择题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)学科特色7 工艺流程推断湖南省娄底市部分学校2022-2023学年高三三模化学试题(已下线)T10-物质反应及转化辽宁省沈阳市新民市高级中学2023-2024学年高三上学期10月月考化学试题
名校
解题方法
7 . 工业上以黄铁矿(主要成分为FeS2,含有少量NiS、CuS、SiO2等杂质)为原料制备K4[Fe(CN)6]•3H2O,工艺流程如图:
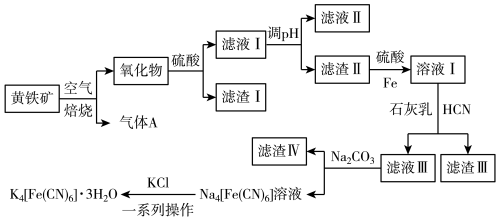
下列说法错误的是

下列说法错误的是
| A.“焙烧”时氧化产物有Fe2O3和SO2 |
| B.“调pH”分离Fe3+与Cu2+、Ni2+是利用了它们氢氧化物Ksp的不同 |
| C.“溶液Ⅰ”中主要反应的离子方程式为6OH-+6HCN+Fe2+=[Fe(CN)6]4-+6H2O |
| D.“一系列操作”为过滤、洗涤、干燥 |
您最近一年使用:0次
2022-03-22更新
|
2185次组卷
|
12卷引用:湖南省衡阳市第一中学2023届高三下学期第四次月考化学试题
湖南省衡阳市第一中学2023届高三下学期第四次月考化学试题山东省济南市2022届高三3月高考模拟考试(一模)化学试题湖北省枣阳市第一中学2022届高三下学期5月第三次模拟考试化学试题(已下线)专题13 物质的反应和转化-2022年高考真题模拟题分项汇编(已下线)2022年山东省高考真题变式题(不定项选择题)山东省济南第一中学2023届高三上学期开学考试化学试题湖南省湘西自治州古丈县第一中学2021-2022学年高三下学期第二次模拟化学试题湖南省邵阳市第二中学2022-2023学年高三上学期第五次月考化学试题湖南省怀化市会同县第一中学2021-2022学年高三下学期第二次调研考试化学试题湖南省怀化市沅陵县第二中学2021-2022学年高三下学期四月第一次调研考试化学试题(已下线)学科特色7 工艺流程推断(已下线)山东省济南市2022届高三3月高考模拟考试(一模)(不定项选择题)
名校
解题方法
8 . 黄铜矿不仅可用于火法炼铜,也可用于湿法炼铜,湿法可同时生产铜、磁性氧化铁和用于橡胶工业的一种固体物质A,流程如下:

(1)黄铜矿中Cu的化合价是______ ,反应I中65gFeC13可氧化________ mol CuFeS2。
(2)工业生产中的过滤操作多采用倾析法分离出固体物质,下列适合用倾析法的有______ 。
(3)在反应Ⅱ中,计算NaHCO3饱和溶液(其中CO32-平衡浓度为1.2×10-3mol/L)可产生FeCO3沉淀时的最小Fe2+浓度是_________ (已知FeCO3的Ksp=3.0×10-11)
(4)反应Ⅲ是在设备底部鼓入空气,高温氧化煅烧法来制备磁性氧化铁,写出对应的化学方程式_________________ 。
(5)固体物质A的成分________ (写名称)。
(6)潮湿的FeCO3固体若不及时灼烧处理会在空气中逐渐变红,写出相关的化学方程式:_______________ 。
(7)本流程中可实现循环使用的物质除了水外,还有_____________

(1)黄铜矿中Cu的化合价是
(2)工业生产中的过滤操作多采用倾析法分离出固体物质,下列适合用倾析法的有
| A.沉淀的颗粒较大B.沉淀容易沉降C.沉淀呈胶状D.沉淀呈絮状 |
(4)反应Ⅲ是在设备底部鼓入空气,高温氧化煅烧法来制备磁性氧化铁,写出对应的化学方程式
(5)固体物质A的成分
(6)潮湿的FeCO3固体若不及时灼烧处理会在空气中逐渐变红,写出相关的化学方程式:
(7)本流程中可实现循环使用的物质除了水外,还有
您最近一年使用:0次
2017-03-15更新
|
918次组卷
|
3卷引用:湖南省衡阳市第八中学2018届高三(实验班)上学期第二次月考理综-化学试题



