解题方法
1 . 实验室可用反应 来制备CuI(CuI受热易被氧化)。下列实验装置和操作
来制备CuI(CuI受热易被氧化)。下列实验装置和操作不能 达到实验目的的是
 来制备CuI(CuI受热易被氧化)。下列实验装置和操作
来制备CuI(CuI受热易被氧化)。下列实验装置和操作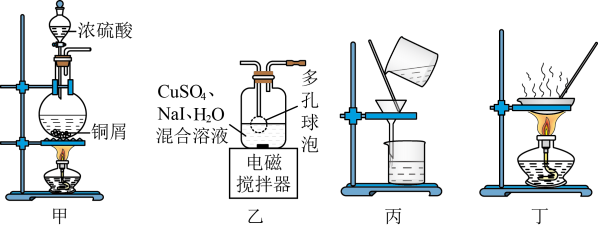
A.用甲装置制备 | B.用乙装置制备CuI |
| C.用丙装置分离出CuI | D.用丁装置干燥CuI固体 |
您最近一年使用:0次
2 . 实验室利用废弃黄铜(主要成分为Zn和Cu)回收Cu并制备ZnO的部分实验过程如图所示:
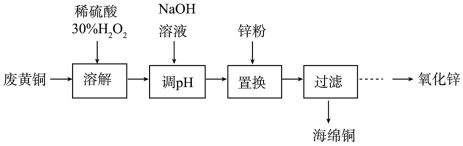
(1)为提高溶解速率,可以采取的措施有_______ (写2种)。
(2)“溶解”操作中一段时间后反应现象突然加剧,同时产生大量气体。
①反应过程中溶液的温度升高,其原因是_______ 。
②产生该现象的原因是(不考虑温度升高的影响)_______ 。
(3)相比用稀硝酸溶解废黄铜,该实验采用稀硫酸和H2O2溶解废黄铜的优点是_______ 。
(4)置换操作置换出铜单质,分离铜和锌。
①加入锌粉发生主要反应的离子方程式为_______ 。
②若没有“调pH”操作,对“置换”操作的影响是_______ 。

(1)为提高溶解速率,可以采取的措施有
(2)“溶解”操作中一段时间后反应现象突然加剧,同时产生大量气体。
①反应过程中溶液的温度升高,其原因是
②产生该现象的原因是(不考虑温度升高的影响)
(3)相比用稀硝酸溶解废黄铜,该实验采用稀硫酸和H2O2溶解废黄铜的优点是
(4)置换操作置换出铜单质,分离铜和锌。
①加入锌粉发生主要反应的离子方程式为
②若没有“调pH”操作,对“置换”操作的影响是
您最近一年使用:0次
3 . 实验室以(NH4)2CO3和Cu(OH)2为原料制备高纯Cu2(OH)2CO3的方法如下:___________ (答两点)。
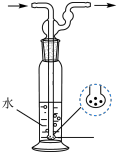
(2)“蒸氨”在如图所示的实验装置中进行。___________ 。
②实验采用三个盛有水的洗气瓶吸收尾气的目的为___________ ;与上图所示洗气瓶相比,采用三个如图所示装置的优点为___________ 。___________ 。
(3)已知:①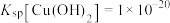 ;
;
②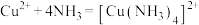
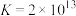 ;
;
③沉淀速率过快时,Cu(OH)2絮状沉淀易裹挟杂质。
以CuSO4∙5H2O固体为原料,补充完整制备纯净Cu(OH)2的实验方案:取一定质量的CuSO4∙5H2O固体分批加入蒸馏水中,搅拌至完全溶解,___________ ,低温烘干。(须使用的试剂:浓氨水、1mol∙L-1 NaOH溶液、0.1mol∙L-1 BaCl2溶液、蒸馏水)
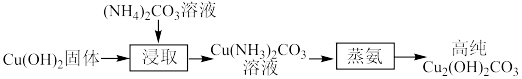
(2)“蒸氨”在如图所示的实验装置中进行。

②实验采用三个盛有水的洗气瓶吸收尾气的目的为
(3)已知:①
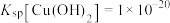 ;
;②
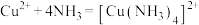
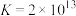 ;
;③沉淀速率过快时,Cu(OH)2絮状沉淀易裹挟杂质。
以CuSO4∙5H2O固体为原料,补充完整制备纯净Cu(OH)2的实验方案:取一定质量的CuSO4∙5H2O固体分批加入蒸馏水中,搅拌至完全溶解,
您最近一年使用:0次
名校
解题方法
4 . 氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业,是难溶于水的白色固体,能溶解于硝酸,在潮湿空气中可被迅速氧化。实验室用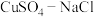 混合液与
混合液与 溶液反应制取CuCl。相关装置及数据如图:
溶液反应制取CuCl。相关装置及数据如图:

回答以下问题:
(1)图甲中仪器1的名称是___________ ;制备过程中 过量会发生副反应生成
过量会发生副反应生成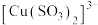 ,为提高产率,仪器2中所加试剂应为
,为提高产率,仪器2中所加试剂应为___________ 。
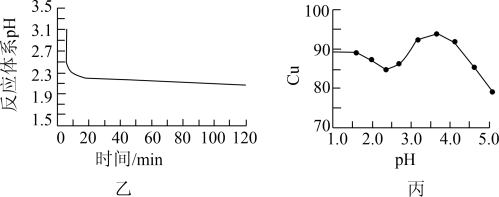
(2)如图乙所示是体系pH随时间变化关系图,写出制备CuCl的离子方程式___________ 。丙图是产率随pH变化关系图,实验过程中往往用 混合溶液代替
混合溶液代替 溶液,其中
溶液,其中 的作用是
的作用是___________ ,为保证较高产率pH应维持在___________ 左右。
(3)反应完成后经抽滤、洗涤、干燥获得产品。洗涤时,用“去氧水”作洗涤剂洗涤产品,作用是___________ 。
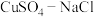 混合液与
混合液与 溶液反应制取CuCl。相关装置及数据如图:
溶液反应制取CuCl。相关装置及数据如图:
回答以下问题:
(1)图甲中仪器1的名称是
 过量会发生副反应生成
过量会发生副反应生成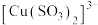 ,为提高产率,仪器2中所加试剂应为
,为提高产率,仪器2中所加试剂应为(2)如图乙所示是体系pH随时间变化关系图,写出制备CuCl的离子方程式
 混合溶液代替
混合溶液代替 溶液,其中
溶液,其中 的作用是
的作用是
(3)反应完成后经抽滤、洗涤、干燥获得产品。洗涤时,用“去氧水”作洗涤剂洗涤产品,作用是
您最近一年使用:0次
解题方法
5 . CuCl2常用作催化剂。实验室用废铜屑(含少量CuO、Fe2O3、油污等杂质)制备CuCl2•2H2O的实验流程如图:
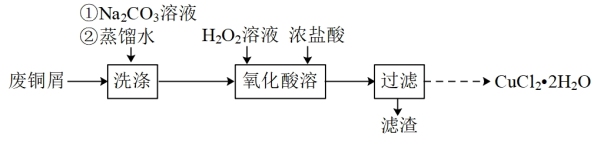
(1)“洗涤”时,Na2CO3溶液的作用是____ 。
(2)“氧化酸溶”在如图所示的装置中进行。
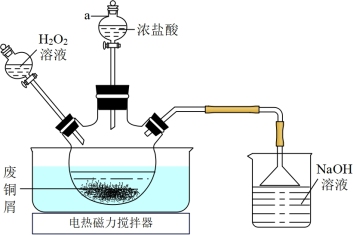
①仪器a的名称为____ 。
②三颈烧瓶中Cu转化为CuCl2的化学方程式为____ 。
(3)以“过滤”后的滤液X为原料制备CuCl2•2H2O晶体。请补充实验方案:向滤液X中____ ,过滤得滤液Y;向滤液Y中____ ,在低温下减压蒸发至____ ,冷却结晶,过滤,将所得固体洗涤、晾干,得到CuCl2•2H2O晶体。(已知该实验中pH=3.2时,Fe3+完全沉淀;pH=4.7时,Cu2+开始沉淀。实验中须用的试剂:CuO粉末,6.0mol·L-1HCl溶液。)
(4)通过下列方法测定CuCl2•2H2O样品的纯度:准确称取0.4800gCuCl2•2H2O样品,加适量水溶解,转移至碘量瓶中,加过量KI溶液,用稀H2SO4酸化,以淀粉溶液为指示剂,用0.1500mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液18.00mL。测定过程中发生下列反应:2Cu2++4I-=2CuI↓+I2;2S2O +I2=S4O
+I2=S4O +2I-。计算样品中CuCl2•2H2O的质量分数
+2I-。计算样品中CuCl2•2H2O的质量分数____ (写出计算过程,计算结果精确到小数点后两位)。

(1)“洗涤”时,Na2CO3溶液的作用是
(2)“氧化酸溶”在如图所示的装置中进行。

①仪器a的名称为
②三颈烧瓶中Cu转化为CuCl2的化学方程式为
(3)以“过滤”后的滤液X为原料制备CuCl2•2H2O晶体。请补充实验方案:向滤液X中
(4)通过下列方法测定CuCl2•2H2O样品的纯度:准确称取0.4800gCuCl2•2H2O样品,加适量水溶解,转移至碘量瓶中,加过量KI溶液,用稀H2SO4酸化,以淀粉溶液为指示剂,用0.1500mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液18.00mL。测定过程中发生下列反应:2Cu2++4I-=2CuI↓+I2;2S2O
 +I2=S4O
+I2=S4O +2I-。计算样品中CuCl2•2H2O的质量分数
+2I-。计算样品中CuCl2•2H2O的质量分数
您最近一年使用:0次
6 . 以印刷线路板的碱性蚀刻废液(主要成分为[Cu(NH3)4]Cl2)或焙烧过的铜精炼炉渣(主要成分为CuO、SiO2少量Fe2O3)为原料均能制备CuSO4·5H2O晶体。
(1)取一定量蚀刻废液和稍过量的NaOH溶液加入到如图所示实验装置的三颈瓶中,在搅拌下加热反应并通入空气,待产生大量的黑色沉淀时停止反应,趁热过滤、洗涤,得到CuO固体;所得固体经酸溶、结晶、过滤等操作,得到CuSO4·5H2O晶体。_______ 。
②检验CuO固体是否洗净的实验操作是_______ 。
③装置图中装置X的作用是_______ 。
(2)以焙烧过的铜精炼炉渣为原料制备CuSO4·5H2O晶体时,请补充完整相应的实验方案:取一定量焙烧过的铜精炼炉渣,_______ ,加热浓缩、冷却结晶、过滤、晾干,得到CuSO4·5H2O晶体。已知:①该实验中pH=3.2时,Fe3+完全沉淀;pH=4.7时,Cu2+开始沉淀。②实验中可选用的试剂:1.0 mol/L H2SO4、1.0 mol/L HCl、1.0 mol/L NaOH。
(3)通过下列方法测定产品纯度:准确称取0.5000g CuSO4·5H2O样品,加适量水溶解,转移至碘量瓶中,加过量KI溶液并用稀H2SO4酸化,以淀粉溶液为指示剂,用0.1000 mol/L Na2S2O3标准溶液滴定至终点,消耗Na2S2O3的溶液19.48mL。测定过程中发生下列反应:2Cu2++4I-=2CuI↓+I2、2S2O +I2= S4O
+I2= S4O +2I-。计算CuSO4·5H2O样品的纯度:
+2I-。计算CuSO4·5H2O样品的纯度:_______ 。
(1)取一定量蚀刻废液和稍过量的NaOH溶液加入到如图所示实验装置的三颈瓶中,在搅拌下加热反应并通入空气,待产生大量的黑色沉淀时停止反应,趁热过滤、洗涤,得到CuO固体;所得固体经酸溶、结晶、过滤等操作,得到CuSO4·5H2O晶体。
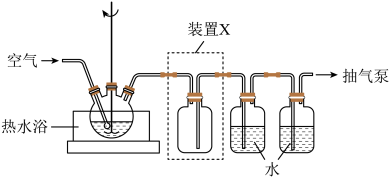
②检验CuO固体是否洗净的实验操作是
③装置图中装置X的作用是
(2)以焙烧过的铜精炼炉渣为原料制备CuSO4·5H2O晶体时,请补充完整相应的实验方案:取一定量焙烧过的铜精炼炉渣,
(3)通过下列方法测定产品纯度:准确称取0.5000g CuSO4·5H2O样品,加适量水溶解,转移至碘量瓶中,加过量KI溶液并用稀H2SO4酸化,以淀粉溶液为指示剂,用0.1000 mol/L Na2S2O3标准溶液滴定至终点,消耗Na2S2O3的溶液19.48mL。测定过程中发生下列反应:2Cu2++4I-=2CuI↓+I2、2S2O
 +I2= S4O
+I2= S4O +2I-。计算CuSO4·5H2O样品的纯度:
+2I-。计算CuSO4·5H2O样品的纯度:
您最近一年使用:0次
2021-07-15更新
|
868次组卷
|
10卷引用:江苏省2021年普通高中学业水平选择考适应性测试化学试题
江苏省2021年普通高中学业水平选择考适应性测试化学试题江苏省苏州市姑苏区第十中学2020-2021学年高一下学期期初化学考试江苏省淮安市高中校协作体2021-2022学年高三上学期期中考试化学试题江苏省苏州市张家港市2021-2022学年高三下学期开学考试化学试题江苏省苏州实验中学2021-2022学年高二下学期期中考试化学试题(已下线)大题03 无机制备类实验题-【考前抓大题】备战2021年高考化学(全国通用)(已下线)培优01 无机制备类实验 基础训练-2021年高考化学大题培优练(新高考地区专用)山东省济南大学城实验高级中学2021届高三4月阶段性测试化学试题黑龙江省哈尔滨师范大学附属中学2020-2021学年高二下学期期末考试化学试题湖南省常宁市第一中学2021-2022学年高三下学期期中考试化学试题
2010高三·江苏南通·专题练习
7 . 孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。以孔雀石为原料可制备CuSO4·5H2O及纳米材料G,步骤如下:
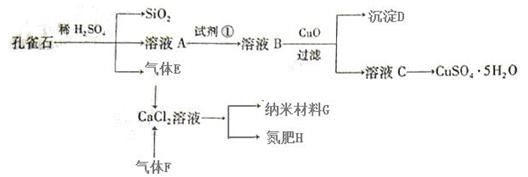
已知:
请回答下列问题:
(1)溶液A中含有Cu2+、Fe2+、Fe3+。根据上述实验过程,可作为试剂①的最合理的是 ▲ (填代号)。
a.KMnO4 b.(NH4)2S c.H2O2 d.KSCN
(2)向溶液B中加入CuO的作用是 ▲ 。
(3)由溶液C获得CuSO4·5H2O,需要经过 ▲ 操作。
(4)制备纳米材料G时,应向CaCl2溶液中先通入 ▲ (填化学式)。写出该反应的化学方程式 ▲ 。
(5)欲测定溶液A中Fe2+的浓度,可取A溶液稀释一定倍数后,用KMnO4标准溶液滴定,滴定时盛放待测液A的玻璃仪器是 ▲ (填名称);滴定达到终点的现象为 ▲ 。

已知:
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 2.7 | 3.7 |
| Fe2+ | 7.6 | 9.6 |
| Cu2+ | 4.7 | 6.7 |
请回答下列问题:
(1)溶液A中含有Cu2+、Fe2+、Fe3+。根据上述实验过程,可作为试剂①的最合理的是 ▲ (填代号)。
a.KMnO4 b.(NH4)2S c.H2O2 d.KSCN
(2)向溶液B中加入CuO的作用是 ▲ 。
(3)由溶液C获得CuSO4·5H2O,需要经过 ▲ 操作。
(4)制备纳米材料G时,应向CaCl2溶液中先通入 ▲ (填化学式)。写出该反应的化学方程式 ▲ 。
(5)欲测定溶液A中Fe2+的浓度,可取A溶液稀释一定倍数后,用KMnO4标准溶液滴定,滴定时盛放待测液A的玻璃仪器是 ▲ (填名称);滴定达到终点的现象为 ▲ 。
您最近一年使用:0次



