填空题
|
较难(0.4)
|
1 . 足量锌与浓H2SO4充分在加热下反应生成会SO2和H2的混合气体;锌和稀硫酸反应只有H2生成。现有甲乙两研究小组分别实验探究:
(1)甲研究小组按下图实验验证锌与浓硫酸反应生成物中SO2和H2,取少量的Zn置于b中,向a中加入100mL18.5mol·L-1的浓硫酸,经过一段时间反应,Zn完全溶解
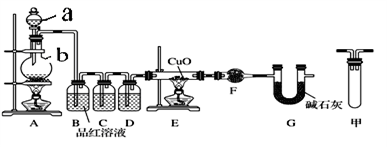
①填写仪器名称:a_____________ 、b_________ 。
②写出装置A中生成能使品红溶液褪色的化学反应方程式:_________________ 。
③装置D中加入的试剂是__________ 。
④U形管G的作用为______________ 。
⑤有同学认为A、B间应增加图中的甲装置,该装置的作用为__________ 。
⑥证明反应生成SO2和H2的实验现象是_________________ 。
⑦若A中生成标准状况下的气体33.6L,将A反应后的溶液稀释到1L,测得溶液中H+的浓度为0.1 mol·L-1,则稀释液中SO42-的物质的量浓度是_________ mol·L-1。
(2)乙研究小组为了探究锌与稀硫酸反应过程中的速率及能量的变化,进行以下实验,分析影响反应速率的因素。

实验时,从断开K开始 ,每间隔1分钟,交替断开或闭合K,并连续计数每1 分钟内从a管流出的水滴数,得到的水滴数如下表所示:
分析反应过程中的水滴数,请回答:
① 由水滴数58>34、81>59,说明在反应初期,闭合K时比断开K时的反应速率快,主要原因是形成原电池反应速度快。
② 由水滴数102>78,说明在反应后期,断开K时的反应速率快于闭合K时的反应速率,主要原因是_____________________________________ 。
③ 从能量转换形式不同的角度,分析水滴数86>81、117>112的主要原因是:_______ 。
(1)甲研究小组按下图实验验证锌与浓硫酸反应生成物中SO2和H2,取少量的Zn置于b中,向a中加入100mL18.5mol·L-1的浓硫酸,经过一段时间反应,Zn完全溶解

①填写仪器名称:a
②写出装置A中生成能使品红溶液褪色的化学反应方程式:
③装置D中加入的试剂是
④U形管G的作用为
⑤有同学认为A、B间应增加图中的甲装置,该装置的作用为
⑥证明反应生成SO2和H2的实验现象是
⑦若A中生成标准状况下的气体33.6L,将A反应后的溶液稀释到1L,测得溶液中H+的浓度为0.1 mol·L-1,则稀释液中SO42-的物质的量浓度是
(2)乙研究小组为了探究锌与稀硫酸反应过程中的速率及能量的变化,进行以下实验,分析影响反应速率的因素。

实验时,
| 1分钟水滴数(断开K) | 34 | 59 | 86 | 117 | … | 102 |
| 1分钟水滴数(闭合K) | 58 | 81 | 112 | 139 | … | 78 |
分析反应过程中的水滴数,请回答:
① 由水滴数58>34、81>59,说明在反应初期,闭合K时比断开K时的反应速率快,主要原因是形成原电池反应速度快。
② 由水滴数102>78,说明在反应后期,断开K时的反应速率快于闭合K时的反应速率,主要原因是
③ 从能量转换形式不同的角度,分析水滴数86>81、117>112的主要原因是:
您最近一年使用:0次
2017-07-01更新
|
1297次组卷
|
2卷引用:四川省广安市2016-2017学年高一下学期期末考试化学试题
解题方法
2 . 某化学兴趣小组发现实验室有多件表面呈灰绿色的金属制品, 经了解其来源并查阅相关资料(如下表),初步确认为铜制品。
针对铜制品表面的灰绿色物质究竟是什么,同学们提出了多种猜想并展开实验探究。
【猜想假设】
(1)小吴同学认为可能是纯铜制品表面涂上了灰绿色的油漆;
小周同学认为可能是青铜(铜锡合金),因为常见的青铜是灰绿色的;
小黄同学认为是纯铜制品,只是表面长出了铜绿[ Cu2(OH)2CO3];
除上述猜想外,其他合理的猜想是____________________ (只写一个)。
【实验验证】三位同学为了验证各自上述的猜想,进行了以下探究:
(2)小吴刮下部分灰绿色物质放入燃烧匙中进行灼烧,发现该物质不能燃烧,证明灰绿色物质不是油漆。 其判断依据是________________________ 。
(3)小周刮下足量的灰绿色物质投入盐酸溶液中,观察到有气体产生,实验表明该气体不能燃烧。将表面刮净后的铜制品也投入盐酸中,并无气体产生。由此证明该铜制品不是青铜,理由是__________________ 。
(4)根据上述实验,小黄认为灰绿色物质可能是铜绿[ Cu2(OH)2CO3]。于是按图5所示装置进行实验。
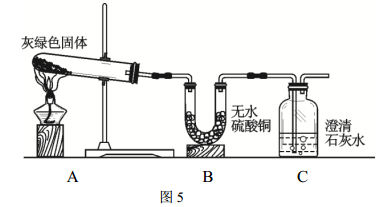
实验证明小黄的猜测是正确的,因为在A中观察到灰绿色物质变黑,B中观察到了___________ 的现象, C中观察到了_____________ 的现象。B中所发生反应的化学方程式为:__________________ 。
如果将实验装置中的B和C进行调换,将无法得出灰绿色物质是铜绿的结论,原因是______________ 。
【实验拓展】
(5)小黄同学还从网上找到了利用氨水擦拭去除铜绿的方法,其原理是氨水与碱式碳酸铜反应生成铜氨络离子[Cu(NH3)42+],其离子方程式可表示为:___________________________ 。
| 紫铜 | 青铜 | 铜绿 | |
| 主要成分 | 纯铜 | 铜锡合金 | Cu2(OH)2CO3 |
| 性质与用途 | 紫红色, 质软,导电性能良好;主要用作电线电缆。 | 多呈灰绿色, 熔点低、硬度大、 可塑性强;可铸造成各种器具。 | 不溶于水的灰绿色粉末,溶于酸, 加热易分解;可作颜料、杀虫剂。 |
针对铜制品表面的灰绿色物质究竟是什么,同学们提出了多种猜想并展开实验探究。
【猜想假设】
(1)小吴同学认为可能是纯铜制品表面涂上了灰绿色的油漆;
小周同学认为可能是青铜(铜锡合金),因为常见的青铜是灰绿色的;
小黄同学认为是纯铜制品,只是表面长出了铜绿[ Cu2(OH)2CO3];
除上述猜想外,其他合理的猜想是
【实验验证】三位同学为了验证各自上述的猜想,进行了以下探究:
(2)小吴刮下部分灰绿色物质放入燃烧匙中进行灼烧,发现该物质不能燃烧,证明灰绿色物质不是油漆。 其判断依据是
(3)小周刮下足量的灰绿色物质投入盐酸溶液中,观察到有气体产生,实验表明该气体不能燃烧。将表面刮净后的铜制品也投入盐酸中,并无气体产生。由此证明该铜制品不是青铜,理由是
(4)根据上述实验,小黄认为灰绿色物质可能是铜绿[ Cu2(OH)2CO3]。于是按图5所示装置进行实验。

实验证明小黄的猜测是正确的,因为在A中观察到灰绿色物质变黑,B中观察到了
如果将实验装置中的B和C进行调换,将无法得出灰绿色物质是铜绿的结论,原因是
【实验拓展】
(5)小黄同学还从网上找到了利用氨水擦拭去除铜绿的方法,其原理是氨水与碱式碳酸铜反应生成铜氨络离子[Cu(NH3)42+],其离子方程式可表示为:
您最近一年使用:0次
3 . 三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。现有一红色粉末可能含有Fe2O3和Cu2O中的一种或两种,设计合理的实验探究样品中Fe2O3、Cu2O的存在。
查阅数据知:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
请完成以下实验探究过程:
(一)提出假设
假设1:红色粉末是Fe2O3;
假设2:红色粉末是__________________;
假设3:红色粉末是___________________。
(二)设计实验方案
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂.
(1)若假设1成立,则实验现象是_________________________。
(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁.你认为这种说法合理吗?______________。简述你的理由________________________。
(3)若固体粉末完全溶解,向所得溶液中滴加KSCN 试剂时溶液不变红色,则证明原固体粉末是_______________。写出实验过程中发生反应的离子方程式________________、_______________、__________________。
(4)若经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物,欲用加热法测定Cu2O的质量分数,取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b>a),则混合物中Cu2O的质量分数为_______。
查阅数据知:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
请完成以下实验探究过程:
(一)提出假设
假设1:红色粉末是Fe2O3;
假设2:红色粉末是__________________;
假设3:红色粉末是___________________。
(二)设计实验方案
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂.
(1)若假设1成立,则实验现象是_________________________。
(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁.你认为这种说法合理吗?______________。简述你的理由________________________。
(3)若固体粉末完全溶解,向所得溶液中滴加KSCN 试剂时溶液不变红色,则证明原固体粉末是_______________。写出实验过程中发生反应的离子方程式________________、_______________、__________________。
(4)若经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物,欲用加热法测定Cu2O的质量分数,取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b>a),则混合物中Cu2O的质量分数为_______。
您最近一年使用:0次
解题方法
4 . 氧化铜(CuO)是一种黑色固体,可溶于稀硫酸中。某同学想知道是稀硫酸中的H2O、H+ 和SO42-中的哪种粒子能使氧化铜溶解。请你和他一起通过如右图所示三个实验来完成这次探究活动。
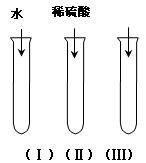
(1)你提出的假设是______________________ ;
(2)通过实验(Ⅰ)可以证明_________________ ;
(3)要证明另外两种粒子能否溶解氧化铜,还需要进行实验(Ⅱ)和( Ⅲ),在( Ⅲ)中应该加入_____ ,实验中观察到的实验现象为___________________________ ;
(4)探究结果为_____________________ 。

(1)你提出的假设是
(2)通过实验(Ⅰ)可以证明
(3)要证明另外两种粒子能否溶解氧化铜,还需要进行实验(Ⅱ)和( Ⅲ),在( Ⅲ)中应该加入
(4)探究结果为
您最近一年使用:0次
5 . 某校化学研究性学习小组在学习了金属的知识后,探究Cu的常见化合物的性质。过程如下:
【提出问题】
①在元素周期表中,Cu、Al位置接近,Cu不如Al活泼,Al(OH)3具有两性,Cu(OH)2也具有两性吗?
②通常情况下,Fe2+的稳定性小于Fe3+的,Cu+的稳定性小于Cu2+的吗?
③CuO有氧化性,能被H2、CO等还原,也能被NH3还原吗?
【实验方案】
(1)解决问题①需用到的药品有CuSO4溶液、_________________________ (填试剂名称,一种或多种),同时进行相关实验。
(2)解决问题②的实验步骤和现象如下:取 98 g Cu(OH)2固体,加热至80~100 ℃ 时,得到80 g黑色固体粉末,继续加热到1000 ℃ 以上,黑色粉末全部变成红色粉末A。冷却后称量,A的质量为72 g,A的化学式为________________ 。向A中加入足量的稀硫酸,得到蓝色溶液,同时观察到容器中还有红色固体存在,则反应的离子方程式为______________________________________________ 。
(3)为解决问题③,设计的实验装置如图所示(夹持及尾气处理装置未画出):实验中观察到CuO变为红色物质。查资料可知,同时生成一种无污染的气体,该气体的化学式为________ 。
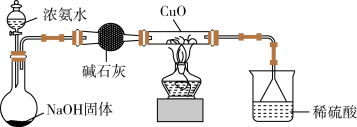
【实验结论】
(4)Cu(OH)2具有两性。证明Cu(OH)2具有两性的实验现象是_________________________ 。
(5)根据实验方案(2),得出的Cu+和Cu2+稳定性大小的结论:在高温时_________________ ;在酸性溶液中____________________________________________________________________ 。
(6)CuO能被NH3还原。有同学认为NH3与CuO反应后生成的红色物质是Cu,也有同学认为NH3与CuO反应后生成的红色物质是Cu和A的混合物。请你设计一个简单的实验方案验证NH3与CuO反应后生成的红色物质中是否含有A:______________________________________________________________________ 。
【提出问题】
①在元素周期表中,Cu、Al位置接近,Cu不如Al活泼,Al(OH)3具有两性,Cu(OH)2也具有两性吗?
②通常情况下,Fe2+的稳定性小于Fe3+的,Cu+的稳定性小于Cu2+的吗?
③CuO有氧化性,能被H2、CO等还原,也能被NH3还原吗?
【实验方案】
(1)解决问题①需用到的药品有CuSO4溶液、
(2)解决问题②的实验步骤和现象如下:取 98 g Cu(OH)2固体,加热至80~100 ℃ 时,得到80 g黑色固体粉末,继续加热到1000 ℃ 以上,黑色粉末全部变成红色粉末A。冷却后称量,A的质量为72 g,A的化学式为
(3)为解决问题③,设计的实验装置如图所示(夹持及尾气处理装置未画出):实验中观察到CuO变为红色物质。查资料可知,同时生成一种无污染的气体,该气体的化学式为

【实验结论】
(4)Cu(OH)2具有两性。证明Cu(OH)2具有两性的实验现象是
(5)根据实验方案(2),得出的Cu+和Cu2+稳定性大小的结论:在高温时
(6)CuO能被NH3还原。有同学认为NH3与CuO反应后生成的红色物质是Cu,也有同学认为NH3与CuO反应后生成的红色物质是Cu和A的混合物。请你设计一个简单的实验方案验证NH3与CuO反应后生成的红色物质中是否含有A:
您最近一年使用:0次
6 . 三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通过实验来探究一红色粉末可能是Fe2O3、Cu2O或二者混合物。探究过程如下:
【查资料】Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
【提出假设】假设1:红色粉末是Fe2O3。假设2:红色粉末是Cu2O。假设3:两者混合物。
【设计探究实验】取少量粉末放入足量稀硫酸中,在所得溶液中再滴加KSCN试剂。
设1成立,则实验现象是__________________________________ 。
(2)若滴加KSCN试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为
这种说法合理吗?____________ ,简述你的理由(不需写出反应的方程式)_______________ 。
(3)若粉末完全溶解无固体存在,滴加KSCN试剂时溶液不变红色,则原固体粉末是_____________ 。
【探究延伸】经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。
(4)实验小组欲用加热法测定Cu2O的质量分数。取a g固体粉末在空气中充分加热,待质量不再
变化时,称其质量为b g(b>a),则混合物中Cu2O的质量分数为____________________ 。
【查资料】Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
【提出假设】假设1:红色粉末是Fe2O3。假设2:红色粉末是Cu2O。假设3:两者混合物。
【设计探究实验】取少量粉末放入足量稀硫酸中,在所得溶液中再滴加KSCN试剂。
设1成立,则实验现象是
(2)若滴加KSCN试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为
这种说法合理吗?
(3)若粉末完全溶解无固体存在,滴加KSCN试剂时溶液不变红色,则原固体粉末是
【探究延伸】经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。
(4)实验小组欲用加热法测定Cu2O的质量分数。取a g固体粉末在空气中充分加热,待质量不再
变化时,称其质量为b g(b>a),则混合物中Cu2O的质量分数为
您最近一年使用:0次
名校
解题方法
7 . 三氧化二铁和氧化亚铜是红色粉末,常作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者的混合物。探究过程如下:
查阅资料知:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
提出假设:假设 l:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计实验:取少量粉末放入足量稀硫酸中,在所得溶液中再滴加KSCN溶液。
(1)若假设1成立,则实验现象是______________________ 。
(2)若滴入 KSCN溶液后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗?__________ 。简述你的理由_____________ .
(3)若固体粉末完全溶解无固体存在,滴加KSCN溶液时溶液不变红色,则证明原固体粉末是Fe2O3和Cu2O的混合物,则其质量比为_________ ,写出其中发生的氧化还原反应的离子方程式____________________________ 。探究延伸:经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。
(4)实验小组欲用加热法测定Cu2O的质量分数。取ag固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg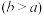 ,则混合物中Cu2O的质量分数为
,则混合物中Cu2O的质量分数为___________ 。
查阅资料知:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
提出假设:假设 l:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计实验:取少量粉末放入足量稀硫酸中,在所得溶液中再滴加KSCN溶液。
(1)若假设1成立,则实验现象是
(2)若滴入 KSCN溶液后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗?
(3)若固体粉末完全溶解无固体存在,滴加KSCN溶液时溶液不变红色,则证明原固体粉末是Fe2O3和Cu2O的混合物,则其质量比为
(4)实验小组欲用加热法测定Cu2O的质量分数。取ag固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg
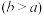 ,则混合物中Cu2O的质量分数为
,则混合物中Cu2O的质量分数为
您最近一年使用:0次
2016-12-09更新
|
322次组卷
|
3卷引用:2016届四川省宜宾三中高三上学期第一次月考化学试卷1
名校
解题方法
8 . 银铜合金广泛应用于航空工业。从银铜合金的切割废料中回收银和制备CuAlO2的流程
如下。
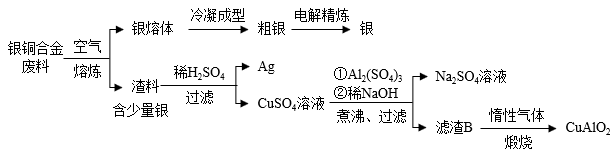
已知:Al(OH) 3和Cu(OH) 2开始分解的温度分别为450℃和 80℃。 下列说法错误的是
如下。

已知:Al(OH) 3和Cu(OH) 2开始分解的温度分别为450℃和 80℃。 下列说法错误的是
| A.电解精炼时,粗银做阳极,纯银做阴极 |
| B.为提高原料利用率,流程中应加过量的稀NaOH |
C.滤渣B煅烧时发生的反应为 4CuO+4Al(OH)3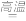 4CuA1O2+ O2↑+6H2O 4CuA1O2+ O2↑+6H2O |
| D.若用 1.0 kg 银铜合金(铜的质量分数为64%) 最多可生成 10.0mol CuA1O2 |
您最近一年使用:0次
2020-06-08更新
|
976次组卷
|
8卷引用:云南省昆明市2020届“三诊一模”高三教学质量检测理科综合化学试题
云南省昆明市2020届“三诊一模”高三教学质量检测理科综合化学试题(已下线)第8讲 金属材料与金属矿物利用-2021年高考化学一轮复习名师精讲练(已下线)小题必刷16 金属元素为载体的化工流程选择题——2021年高考化学一轮复习小题必刷(通用版)(已下线)【浙江新东方】96安徽省蚌埠市第二中学2020-2021学年高二上学期12月月考化学试题(已下线)解密06 金属及其化合物(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密06 金属及其化合物(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)课时19 金属元素为载体的化工流程选择题-2022年高考化学一轮复习小题多维练(全国通用)
名校
解题方法
9 . 氯化亚铜(CuC1)广泛应用于化工、印染、电镀等行业。CuC1难溶于水,可溶于氯离子浓度较大的体系,易水解氧化。以海绵铜(主要成分是Cu和少量CuO)为原料,生产CuC1的工艺如下:
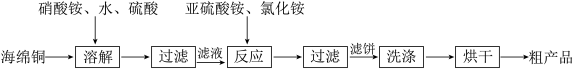
下列说法错误的是

下列说法错误的是
A.“溶解”过程发生氧化还原反应的离子方程式是3Cu+8H++2 =3Cu2++2NO↑+4H2O =3Cu2++2NO↑+4H2O |
B.“反应”过程发生反应的离子方程式是2Cu2++ +2C1-+H2O=2CuC1↓+ +2C1-+H2O=2CuC1↓+ +2H+ +2H+ |
| C.“溶解”过程中硫酸可用浓盐酸代替 |
| D.“烘干”需在隔绝空气的环境中进行 |
您最近一年使用:0次
2020-10-17更新
|
454次组卷
|
3卷引用:山东省高密市2021届高三10月份联考化学试题
名校
10 . C和CuO在一定温度下反应,产物有Cu、Cu2O、CO、CO2。若将2.00 g C跟16.0 g CuO混合,隔绝空气加热,将生成的气体全部通过足量的澄清石灰水,充分反应后共收集到1.12 L气体(标准状况),生成沉淀的质量为5.00 g。下列说法错误的是:
| A.反应后的固体混合物中Cu的质量为9.6 g |
| B.反应后的固体混合物中还含有碳 |
| C.反应后的固体混合物中氧化物的物质的量为0.05 mol |
| D.反应后的固体混合物总质量为14.4 g |
您最近一年使用:0次
2019-02-18更新
|
713次组卷
|
8卷引用:【全国百强校】河南省信阳高级中学2018-2019学年高一上学期期末考试化学试题



