名校
解题方法
1 . 以铜片(含少量杂质铁)为原料制取Cu(NO3)2溶液的实验流程如图:
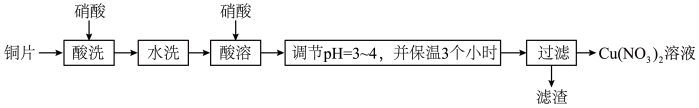
(1)“酸洗”的目的是除去铜片表面难溶的Cu2(OH)2SO4,写出“酸洗”时反应的离子方程式:___ 。
(2)“水洗”后检验铜片表面是否洗涤干净的方法是___ 。
(3)“酸溶”时的装置如图所示,烧杯内所发生的反应为:
NO+NO2+2OH-=2NO2-+H2O
2NO2+2OH-=NO2-+NO3-+H2O
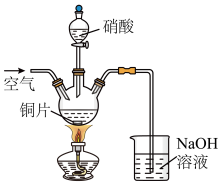
①“酸溶”时为防止反应过于剧烈,可以采取的方法有___ 和___ 。
②通入空气的作用是___ 、___ 。
(4)“调节pH=3~4,并保温3个小时”的目的是___ 。
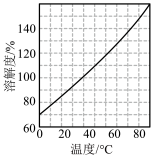
(5)烧杯中所得溶液经多步处理得到NaNO3固体。设计以烧杯中所得溶液为原料,制取NaNO3固体的实验方案:___ 。
[已知3NaNO2+2HNO3=3NaNO3+2NO↑+H2O;NaNO3的溶解度随温度变化如图所示。实验中必须使用的试剂:硝酸和NaOH溶液]。

(1)“酸洗”的目的是除去铜片表面难溶的Cu2(OH)2SO4,写出“酸洗”时反应的离子方程式:
(2)“水洗”后检验铜片表面是否洗涤干净的方法是
(3)“酸溶”时的装置如图所示,烧杯内所发生的反应为:
NO+NO2+2OH-=2NO2-+H2O
2NO2+2OH-=NO2-+NO3-+H2O

①“酸溶”时为防止反应过于剧烈,可以采取的方法有
②通入空气的作用是
(4)“调节pH=3~4,并保温3个小时”的目的是
(5)烧杯中所得溶液经多步处理得到NaNO3固体。设计以烧杯中所得溶液为原料,制取NaNO3固体的实验方案:
[已知3NaNO2+2HNO3=3NaNO3+2NO↑+H2O;NaNO3的溶解度随温度变化如图所示。实验中必须使用的试剂:硝酸和NaOH溶液]。

您最近一年使用:0次
2020-05-09更新
|
139次组卷
|
2卷引用:江苏省如皋中学2020届高三阶段检测化学试题
名校
解题方法
2 . 已知酸性条件下有如下反应:2Cu+=Cu2++Cu。由于反应温度不同,用氢气还原氧化铜时,可能产生Cu或Cu2O,两者都是红色固体。某同学对氢气还原氧化铜实验所得的红色固体产物进行验证,每一次实验操作和实验现象记录如下,由此推出氢气还原氧化铜实验的产物是( ).
| 加入试剂 | 稀硫酸 | 浓硫酸 | 稀硝酸 | 浓硝酸 |
| 实验现象 | 产生红色固体,溶液呈蓝色 | 加热,产生无色气体 | 产生无色气体,溶液呈蓝色 | 产生红棕色气体,溶液呈绿色 |
| A.只有Cu |
| B.只有Cu2O |
| C.一定有Cu,可能有Cu2O |
| D.一定有Cu2O,可能有Cu |
您最近一年使用:0次
2020-03-06更新
|
284次组卷
|
8卷引用:江苏省启东中学2020年人教版高中化学必修1期末复习第二章 化学物质及其变化(三)
江苏省启东中学2020年人教版高中化学必修1期末复习第二章 化学物质及其变化(三)2017届新疆生产建设兵团二中高三上第一次月考化学试卷2018届高三一轮复习化学:考点21-铜及其化合物性质探究福建省厦门双十中学2016-2017学年高一下学期第一次月考化学试题(已下线)2019高考热点题型和提分秘籍 第三章 金属及其化合物 第4讲 金属材料与矿物 铜及其化合物 (题型专练)(已下线)2019年1月17日 《每日一题》高考二轮复习-铜及其化合物(已下线)第三单元 物质的性质与转化(基础过关)-2020-2021学年高一化学必修第一册单元测试定心卷 (鲁科版2019)(已下线)专题05 金属及其重要化合物-备战2021届高考化学二轮复习题型专练
解题方法
3 . 实验室以海绵铜(主要成分为Cu和CuO)为原料制取CuCl的主要流程如图:
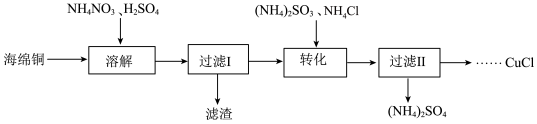
已知:①CuCl为白色固体,难溶于水和乙醇,可溶于氯离子浓度较大的溶液中。
②CuCl有水存在时在空气中易被氧化,在酸性条件下较稳定。
(1)“溶解”时选用约为0.5mol•L-1的硫酸,过程中无气体产生。若硫酸浓度过大,反应会产生NO、NO2等有害气体,NH4NO3的用量会___ (填“增大”或“减小”或“不变”)。
(2)“转化”步骤中发生反应的离子方程式为___ 。加入的(NH4)2SO3需要适当过量的原因是__ 。
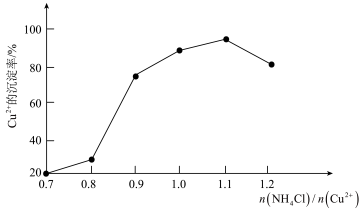
(3)氯化铵用量[ ]与Cu2+沉淀率的关系如图所示。随着氯化铵用量的增多Cu2+沉淀率增加,但当氯化铵用量增加到一定程度后Cu2+的沉淀率减少,其原因是
]与Cu2+沉淀率的关系如图所示。随着氯化铵用量的增多Cu2+沉淀率增加,但当氯化铵用量增加到一定程度后Cu2+的沉淀率减少,其原因是___ 。
(4)检验CuCl沉淀是否洗涤完全的方法是___ 。
(5)若CuCl产品中混有少量CaSO4,设计提纯CuCl的实验方案:__ 。(实验中可选试剂:0.1mol•L-1盐酸、10mol•L-1盐酸、蒸馏水、无水乙醇)

已知:①CuCl为白色固体,难溶于水和乙醇,可溶于氯离子浓度较大的溶液中。
②CuCl有水存在时在空气中易被氧化,在酸性条件下较稳定。
(1)“溶解”时选用约为0.5mol•L-1的硫酸,过程中无气体产生。若硫酸浓度过大,反应会产生NO、NO2等有害气体,NH4NO3的用量会
(2)“转化”步骤中发生反应的离子方程式为
(3)氯化铵用量[
 ]与Cu2+沉淀率的关系如图所示。随着氯化铵用量的增多Cu2+沉淀率增加,但当氯化铵用量增加到一定程度后Cu2+的沉淀率减少,其原因是
]与Cu2+沉淀率的关系如图所示。随着氯化铵用量的增多Cu2+沉淀率增加,但当氯化铵用量增加到一定程度后Cu2+的沉淀率减少,其原因是
(4)检验CuCl沉淀是否洗涤完全的方法是
(5)若CuCl产品中混有少量CaSO4,设计提纯CuCl的实验方案:
您最近一年使用:0次
2020-02-27更新
|
147次组卷
|
2卷引用:江苏省苏州市2020届高三上学期期末学业质量阳光指标调研卷化学试题
名校
解题方法
4 . 在给定条件下,下列选项所示的物质间转化均能实现的是( )
A.CO2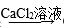 CaCO3 CaCO3 | B.Fe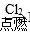 FeCl3 FeCl3 |
C.CuO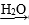 Cu(OH)2 Cu(OH)2 | D.Al Al(OH)3 Al(OH)3 |
您最近一年使用:0次
5 . 工业上由含铜废料(含有Cu、CuS、CuSO4等)制备硝酸铜晶体的流程如图:
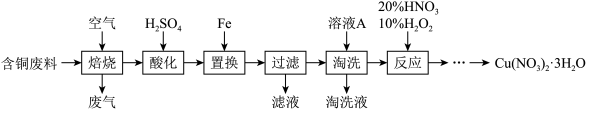
(1)“焙烧”时CuS转化为CuO和SO2,反应的化学方程式为___ 。
(2)“酸化”步骤反应的离子方程式为___ 。
(3)“过滤”所得滤液中溶质的主要成分为___ 。
(4)“淘洗”所用的溶液A应选用___ (填序号)。
a.稀硫酸 b.浓硫酸 c.稀硝酸 d.浓硝酸
(5)“反应”一步的过程中无红棕色气体生成。
①理论上消耗HNO3和H2O2的物质的量之比为___ 。
②若不加10% H2O2,只用浓HNO3,随着反应的进行,容器内持续出现大量红棕色气体,写出该反应的离子方程式____ 。
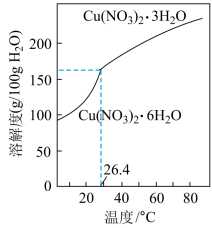
(6)由“反应”所得溶液中尽可能多地析出Cu(NO3)2·3H2O晶体的方法是___ 。(相关物质的溶解度曲线如图所示)

(1)“焙烧”时CuS转化为CuO和SO2,反应的化学方程式为
(2)“酸化”步骤反应的离子方程式为
(3)“过滤”所得滤液中溶质的主要成分为
(4)“淘洗”所用的溶液A应选用
a.稀硫酸 b.浓硫酸 c.稀硝酸 d.浓硝酸
(5)“反应”一步的过程中无红棕色气体生成。
①理论上消耗HNO3和H2O2的物质的量之比为
②若不加10% H2O2,只用浓HNO3,随着反应的进行,容器内持续出现大量红棕色气体,写出该反应的离子方程式
(6)由“反应”所得溶液中尽可能多地析出Cu(NO3)2·3H2O晶体的方法是

您最近一年使用:0次
6 . 氧化亚铜(Cu2O)是一种用途广泛的光电材料,某工厂以硫化铜矿石(含 CuFeS2、Cu2S等)为原料制取Cu2O的工艺流程如下:
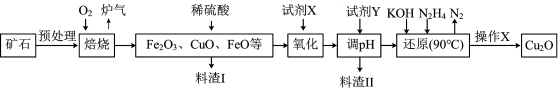
(1) “焙烧”时,提高反应速率的措施有____________ (写一条)。
(2)炉气中的有害气体成分是__________ 。
(3)若试剂X是H2O2溶液,写出相应反应的离子方程式:_________ 。

(1) “焙烧”时,提高反应速率的措施有
(2)炉气中的有害气体成分是
(3)若试剂X是H2O2溶液,写出相应反应的离子方程式:
您最近一年使用:0次
2019-12-25更新
|
116次组卷
|
2卷引用:江苏省太仓市明德高级中学2019-2020学年高二上学期合格性考试模拟化学试题
解题方法
7 . 我国很早就使用青铜器,由于时间久远,其表面有一层“绿锈”,“绿锈”俗称“铜绿”,是铜和空气中的水蒸气、CO2、O2作用产生的,化学式为[Cu2(OH)2CO3],“铜绿”能跟酸反应生成铜盐、CO2和H2O。某同学利用以下反应实现了“铜→铜绿→……→铜”的转化。
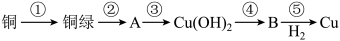
(1)从物质分类标准看,“铜绿”属于___ (填字母)。
A.酸 B.碱 C.盐 D.氧化物
(2)请写出铜绿与盐酸反应的离子方程式:___ 。
(3)上述转化过程中属于氧化还原反应的是___ (填序号)
(4)铜绿在受热时可直接分解生成物质B、CO2和水,其分解的化学方程式为___ 。

(1)从物质分类标准看,“铜绿”属于
A.酸 B.碱 C.盐 D.氧化物
(2)请写出铜绿与盐酸反应的离子方程式:
(3)上述转化过程中属于氧化还原反应的是
(4)铜绿在受热时可直接分解生成物质B、CO2和水,其分解的化学方程式为
您最近一年使用:0次
名校
8 . 将1.60gCuSO4固体在高温下加热,得到0.72g红色固体(纯净物,不含S元素),同时有气体X生成,X可能是SO2、SO3、O2中的两种或三种。下列说法正确的是
| A.所得红色固体是铜 |
| B.将X通入氢氧化钡溶液,若溶液变浑浊,则X中含有SO3 |
| C.X的物质的量最少为0.01mol |
| D.将X缓慢通过足量NaOH溶液,若溶液增重0.72g,则X中含0.005molO2 |
您最近一年使用:0次
名校
解题方法
9 . 从含铜丰富的自然资源黄铜矿(CuFeS2)冶炼铜的工艺流程如下:
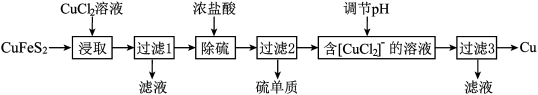
已知:CuFeS2+3CuCl2=4CuCl+FeCl2+2S
(1)浸取时,若改用FeCl3溶液,也能生成CuCl和S,该反应化学方程式为_____ .
(2)若过滤1所得滤液中只含FeCl2,则将其在空气中加热蒸干、灼烧后,所得固体的化学式为_____ .
(3)调节溶液的pH后,除生成Cu外,还能产生一种金属离子,此金属离子是_____ .(填离子符号)
(4)过滤3所得滤液中可以循环使用的物质有_____ ,为保持流程持续循环,每生成1molCu,理论上需补充CuCl2的物质的量为_____ .
(5)冶炼工艺还可以将精选后的黄铜矿砂与空气在高温下煅烧,使其转变为铜,化学方程式为:6CuFeS2+13O2 3Cu2S+2Fe3O4+9SO2、Cu2S+O2
3Cu2S+2Fe3O4+9SO2、Cu2S+O2 2Cu+SO2此工艺与前一工艺相比主要缺点有
2Cu+SO2此工艺与前一工艺相比主要缺点有_____ .

已知:CuFeS2+3CuCl2=4CuCl+FeCl2+2S
(1)浸取时,若改用FeCl3溶液,也能生成CuCl和S,该反应化学方程式为
(2)若过滤1所得滤液中只含FeCl2,则将其在空气中加热蒸干、灼烧后,所得固体的化学式为
(3)调节溶液的pH后,除生成Cu外,还能产生一种金属离子,此金属离子是
(4)过滤3所得滤液中可以循环使用的物质有
(5)冶炼工艺还可以将精选后的黄铜矿砂与空气在高温下煅烧,使其转变为铜,化学方程式为:6CuFeS2+13O2
 3Cu2S+2Fe3O4+9SO2、Cu2S+O2
3Cu2S+2Fe3O4+9SO2、Cu2S+O2 2Cu+SO2此工艺与前一工艺相比主要缺点有
2Cu+SO2此工艺与前一工艺相比主要缺点有
您最近一年使用:0次
2019-11-27更新
|
566次组卷
|
6卷引用:2016届江苏省清江中学高三下学期考前练习化学试卷
2016届江苏省清江中学高三下学期考前练习化学试卷江苏省苏州市2020届高三上学期期初调研化学试题(已下线)2019高考热点题型和提分秘籍 第三章 金属及其化合物 第4讲 金属材料与矿物 铜及其化合物 (题型专练)广东省深圳市龙岗区龙城高级中学2021届高三第一次模拟考试化学试题重庆市永川景圣中学2020-2021学年高三上学期第二次月考化学试题(已下线)考点12 金属材料(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)
10 . 某含铜化合物的化学式为Cux(OH)y(CO3)z(Cu为+2价)。取该样品22.2 g,充分加热后,得到黑色固体氧化铜16.0 g,则该物质的化学式为
| A.Cu2(OH)4CO3 | B.Cu3(OH)4CO3 |
| C.Cu2(OH)2CO3 | D.Cu4(OH)2(CO3)3 |
您最近一年使用:0次
2019-10-31更新
|
101次组卷
|
2卷引用:江苏省如皋市2018-2019学年高一下学期期末调研化学(必修)试题



