1 . 在给定条件下,下列选项所示的物质间转化均能实现的是( )
A.MnO2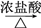 Cl2 Cl2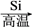 SiCl4 SiCl4 | B.Fe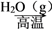 Fe2O3 Fe2O3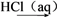 FeCl3 FeCl3 |
C.S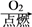 SO2 SO2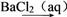 BaSO3 BaSO3 | D.CuSO4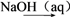 Cu(OH)2 Cu(OH)2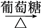 Cu Cu |
您最近一年使用:0次
2 . 某兴趣小组用碱式碳酸铜[CuCO3·Cu(OH)2]制取铜粉并测定铜粉纯度的实验如下:
步骤1:将一定量的碱式碳酸铜置于烧杯中,向烧杯中加入N2H4的水溶液,边搅拌边加热,有大量的气体生成和红色铜析出,将沉淀过滤、低温干燥得红色粉末。
步骤2:称取1.9600 g红色粉末于烧杯中,缓慢加入足量稀硫酸,边加热边通入氧气使粉末完全溶解。冷却,将溶液移入100 mL 容量瓶中,用水稀释至刻度。
书骤3:准确量取20.00mL的溶液,调节溶液呈弱酸性,向其中加入过量的KI.,充分反应后,以淀粉溶液作指示剂,用0.2000mol/LNa2S2O3标准溶液滴定,滴定终点时共消耗Na2S2O3标准溶液30.00 mL.过程中所发生的反应如下:Cu2++I- CuI↓+I3-(未配平),I3-+S2O32-=S4O62-+I-(未配平)。
CuI↓+I3-(未配平),I3-+S2O32-=S4O62-+I-(未配平)。
(1)步骤1中所发生反应的化学方程式为_________________ 。
(2)步骤2 中所发生反应的离子方程式为_________________ 。
(3)步骤3 中加入过量KI的作用是_________________ 。
(4)若铜粉中杂质不参与步骤3 的反应,通过计算确定红色粉末中含铜质量分数(写出计算过程)________ 。
步骤1:将一定量的碱式碳酸铜置于烧杯中,向烧杯中加入N2H4的水溶液,边搅拌边加热,有大量的气体生成和红色铜析出,将沉淀过滤、低温干燥得红色粉末。
步骤2:称取1.9600 g红色粉末于烧杯中,缓慢加入足量稀硫酸,边加热边通入氧气使粉末完全溶解。冷却,将溶液移入100 mL 容量瓶中,用水稀释至刻度。
书骤3:准确量取20.00mL的溶液,调节溶液呈弱酸性,向其中加入过量的KI.,充分反应后,以淀粉溶液作指示剂,用0.2000mol/LNa2S2O3标准溶液滴定,滴定终点时共消耗Na2S2O3标准溶液30.00 mL.过程中所发生的反应如下:Cu2++I-
 CuI↓+I3-(未配平),I3-+S2O32-=S4O62-+I-(未配平)。
CuI↓+I3-(未配平),I3-+S2O32-=S4O62-+I-(未配平)。(1)步骤1中所发生反应的化学方程式为
(2)步骤2 中所发生反应的离子方程式为
(3)步骤3 中加入过量KI的作用是
(4)若铜粉中杂质不参与步骤3 的反应,通过计算确定红色粉末中含铜质量分数(写出计算过程)
您最近一年使用:0次
2017-12-17更新
|
173次组卷
|
2卷引用:江苏省南京市高淳区江苏淮海中学、盐城中学、淳辉高中等97校2018届高三12月联考化学试题
2011·江苏南京·模拟预测
3 . 由黄铜矿为原料(主要成分为CuFeS2)制备99.95%~99.98%精铜的流程如下:

(1)高温焙烧第一反应为2CuFeS2+4O2=Cu2S+2FeO+3SO2,该反应中氧化剂为____________ 。产物Cu2S在1200℃高温下继续反应:2Cu2S+3O2=2Cu2O+2SO2,2Cu2O+Cu2S=6Cu+SO2。6mol CuFeS2和14.25mol O2反应,理论上可得到Cu________ mol(假定各步反应都完全)。
(2)取三份质量均为16.9g的上述粗铜,成分为Cu、Fe、Zn。现在需要分析其中铜的含量,进行如下实验(所有气体体积均为标况下的数据):
① 取一份粗铜放入足量稀硫酸中,共放出氢气1.568L。
② 另取一份粗铜放入稍过量的较浓硝酸中,加热使合金铜完全溶解,收集到了NO和NO2的混合气体8.736L,与3.304LO2混合后,得到的混合气体恰好被水完全吸收。
③ 再取一份粗铜进行电解精炼,阳极完全溶解后阴极增加质量17.28g。
求粗铜中Cu的质量分数_________ (保留一位小数)。

(1)高温焙烧第一反应为2CuFeS2+4O2=Cu2S+2FeO+3SO2,该反应中氧化剂为
(2)取三份质量均为16.9g的上述粗铜,成分为Cu、Fe、Zn。现在需要分析其中铜的含量,进行如下实验(所有气体体积均为标况下的数据):
① 取一份粗铜放入足量稀硫酸中,共放出氢气1.568L。
② 另取一份粗铜放入稍过量的较浓硝酸中,加热使合金铜完全溶解,收集到了NO和NO2的混合气体8.736L,与3.304LO2混合后,得到的混合气体恰好被水完全吸收。
③ 再取一份粗铜进行电解精炼,阳极完全溶解后阴极增加质量17.28g。
求粗铜中Cu的质量分数
您最近一年使用:0次
10-11高三上·江苏南京·阶段练习
4 . 硫酸铜是一种重要的化工原料,工业上常用硫酸为原料来制备硫酸铜。
(1)工业上生产硫酸过程中,焙烧硫铁矿时产生的废渣是一种二次资源。
①为了从废渣中磁选获得品位合格的铁精矿,高温下利用CO使弱磁性Fe2O3转化为强磁性Fe3O4。写出该反应的化学方程式_________ ;实验发现:CO太多或太少都会导致磁铁矿产率降低,原因是___________ 。
②氯化焙烧工艺是将废渣用氯化钙水溶液调和、成球、高温焙烧,废渣中SiO2与CaCl2等在高温下反应放出HCl,HCl与金属氧化物等反应生成氯化物。反应生成的各金属氯化物以气态形式逸出,进而回收有色金属和回返氯化钙溶液。写出氯化焙烧工艺中生成HCl的化学方程式______________________ 。
(2)测定硫酸铜晶体中结晶水含量的实验步骤为:
步骤1:准确称量一个洁净、干燥的坩埚;
步骤2:将一定量的硫酸铜晶体试样研细后,放入坩埚中称重
步骤3:将盛有试样的坩埚加热,待晶体变成白色粉末时,停止加热;
步骤4:将步骤3中的坩埚放入干燥器,冷却至室温后,称重:
步骤5:_________________ ;
步骤6:根据实验数据计算硫酸铜晶体试样中结晶水的质量分数。
请完成实验步骤5。
(3)已知硫酸铜晶体受热可以逐步失去结晶水,温度升高还可以分解生成铜的氧化物。现取25.0g CuSO4·5H2O晶体均匀受热,缓慢升温至1200℃并恒温1小时,实验测得固体残留率(剩余固体的质量/原始固体质量)与温度的关系如下图所示:

在110℃时所得固体的成分为________________ ;在1200℃并恒温1小时,反应所得气态产物除去水后,物质的量为_______________ 。(填字母)
(1)工业上生产硫酸过程中,焙烧硫铁矿时产生的废渣是一种二次资源。
①为了从废渣中磁选获得品位合格的铁精矿,高温下利用CO使弱磁性Fe2O3转化为强磁性Fe3O4。写出该反应的化学方程式
②氯化焙烧工艺是将废渣用氯化钙水溶液调和、成球、高温焙烧,废渣中SiO2与CaCl2等在高温下反应放出HCl,HCl与金属氧化物等反应生成氯化物。反应生成的各金属氯化物以气态形式逸出,进而回收有色金属和回返氯化钙溶液。写出氯化焙烧工艺中生成HCl的化学方程式
(2)测定硫酸铜晶体中结晶水含量的实验步骤为:
步骤1:准确称量一个洁净、干燥的坩埚;
步骤2:将一定量的硫酸铜晶体试样研细后,放入坩埚中称重
步骤3:将盛有试样的坩埚加热,待晶体变成白色粉末时,停止加热;
步骤4:将步骤3中的坩埚放入干燥器,冷却至室温后,称重:
步骤5:
步骤6:根据实验数据计算硫酸铜晶体试样中结晶水的质量分数。
请完成实验步骤5。
(3)已知硫酸铜晶体受热可以逐步失去结晶水,温度升高还可以分解生成铜的氧化物。现取25.0g CuSO4·5H2O晶体均匀受热,缓慢升温至1200℃并恒温1小时,实验测得固体残留率(剩余固体的质量/原始固体质量)与温度的关系如下图所示:

在110℃时所得固体的成分为
| A.0 mol | B.0.1mol | C.0.125mol | D.大于0.125mol |
您最近一年使用:0次
5 . 把质量为mg的铜丝灼烧变成黑色,立即放入下列物质中,使铜丝变成红色,而且质量仍为mg的是
| A.稀H2SO4 | B.C2H5OH | C.CH3COOH溶液 | D.CO |
您最近一年使用:0次
2016-12-09更新
|
1020次组卷
|
4卷引用:江苏省南京市燕子矶中学2016-2017学年高一5月月考化学试题
江苏省南京市燕子矶中学2016-2017学年高一5月月考化学试题(已下线)2010年山东省聊城四中高二第二学期期末考试化学试题(已下线)2010年内蒙古通辽一中高一下学期期末考试化学试题河北省唐山市开滦第一中学2016-2017学年高一6月月考化学试题
12-13高三上·江苏南京·阶段练习
6 . 氯化亚铜(CuCl)是白色粉末,不溶于水、乙醇及稀硫酸,熔点422℃,沸点1366℃,在空气中迅速被氧化成绿色,常用作有机合成工业中的催化剂。以粗盐水(含Ca2+、Mg2+、SO42-等杂质)、Cu、稀硫酸、SO2等为原料合成CuCl的工艺如下:
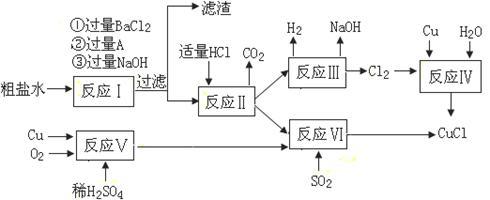
(1)A的化学式为__________________ 。
(2)写出反应V的化学方程式__________________________________________ 。
(3)写出反应VI的离子方程式为________________________________________ 。
(4)本工艺中可以循环利用的物质是(用化学式表示)______________ 。
(5)反应VI后,过滤得到CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70℃干燥2小时,冷却,密封包装即得产品。于70℃真空干燥的目的是_______ 、____________ 。

(1)A的化学式为
(2)写出反应V的化学方程式
(3)写出反应VI的离子方程式为
(4)本工艺中可以循环利用的物质是(用化学式表示)
(5)反应VI后,过滤得到CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70℃干燥2小时,冷却,密封包装即得产品。于70℃真空干燥的目的是
您最近一年使用:0次
10-11高三上·江苏南京·期中
名校
7 . 下列各组物质依次满足如图所示转化关系的是(图中箭头表示一步转化)
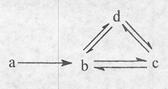

| a | b | c | d | |
| ① | Si | SiO2 | H2SiO3 | Na2SiO3 |
| ② | Al | AlCl3 | NaAlO2 | Al(OH)3 |
| ③ | Cu | CuO | Cu(OH)2 | CuSO4 |
| ④ | Na | NaOH | Na2CO3 | NaHCO3 |
| A.①② | B.②③ | C.③④ | D.②④ |
您最近一年使用:0次
2016-01-08更新
|
246次组卷
|
8卷引用:2010年江苏省南京市金陵中学高三上学期期中考试化学试题
8 . 铜的硫化物可用于冶炼金属铜。为测定某试样中Cu2S、CuS的质量分数,进行如下实验:
步骤1:在0.750 0 g试样中加入100.00 mL 0.120 0 mol·L-1 KMnO4的酸性溶液,加热,硫元素全部转化为SO42-,铜元素全部转化为Cu2+,滤去不溶性杂质。
步骤2:收集步骤1所得滤液至250 mL容量瓶中,定容。取25.00 mL溶液,用0.100 0 mol·L-1FeSO4溶液滴定至终点,消耗16.00 mL。
步骤3:在步骤2滴定所得溶液中滴加氨水至出现沉淀,然后加入适量NH4HF2溶液(使Fe、Mn元素不参与后续反应),加入约1 g KI固体(过量),轻摇使之溶解并发生反应:2Cu2++4I-===2CuI↓+I2。用0.050 00 mol·L-1 Na2S2O3溶液滴定至终点(离子方程式为2S2O32-+I2===2I-+S4O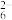 ),消耗14.00 mL。
),消耗14.00 mL。
已知:酸性条件下,MnO4-的还原产物为Mn2+。
(1)若步骤3加入氨水产生沉淀时,溶液的pH=2.0,则溶液中c(Fe3+)=________。
(已知室温下Ksp[Fe(OH)3]=2.6×10-39)
(2)步骤3若未除去Fe3+,则测得的Cu2+的物质的量将________(填“偏高”“偏低”或“不变”)。
(3)计算试样中Cu2S和CuS的质量分数(写出计算过程)。
步骤1:在0.750 0 g试样中加入100.00 mL 0.120 0 mol·L-1 KMnO4的酸性溶液,加热,硫元素全部转化为SO42-,铜元素全部转化为Cu2+,滤去不溶性杂质。
步骤2:收集步骤1所得滤液至250 mL容量瓶中,定容。取25.00 mL溶液,用0.100 0 mol·L-1FeSO4溶液滴定至终点,消耗16.00 mL。
步骤3:在步骤2滴定所得溶液中滴加氨水至出现沉淀,然后加入适量NH4HF2溶液(使Fe、Mn元素不参与后续反应),加入约1 g KI固体(过量),轻摇使之溶解并发生反应:2Cu2++4I-===2CuI↓+I2。用0.050 00 mol·L-1 Na2S2O3溶液滴定至终点(离子方程式为2S2O32-+I2===2I-+S4O
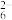 ),消耗14.00 mL。
),消耗14.00 mL。已知:酸性条件下,MnO4-的还原产物为Mn2+。
(1)若步骤3加入氨水产生沉淀时,溶液的pH=2.0,则溶液中c(Fe3+)=________。
(已知室温下Ksp[Fe(OH)3]=2.6×10-39)
(2)步骤3若未除去Fe3+,则测得的Cu2+的物质的量将________(填“偏高”“偏低”或“不变”)。
(3)计算试样中Cu2S和CuS的质量分数(写出计算过程)。
您最近一年使用:0次



