1 . 某实验小组用工业上废弃固体(主要成分Cu2S和Fe2O3)混合物制取粗铜和Fe2(SO4)3晶体,设计的操作流程如下:
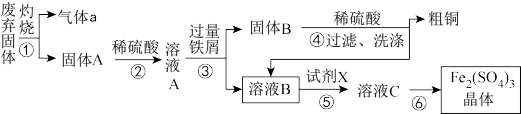
已知:铁屑能将Fe3+还原为Fe2+。
(1)Cu2S中Cu元素的化合价为_______ ,①中涉及的反应有:Cu2S+O2 2Cu+SO2,该反应的氧化剂是
2Cu+SO2,该反应的氧化剂是_______ 。
(2)③的实验操作中用到的玻璃仪器有_______ 。
(3)①试剂X通常选择H2O2,在反应中用作_______ (填氧化剂或还原剂)。
②试剂X若用Cl2,缺点是_______ 。(写出两个)
(4)灼烧过程中会有少量Cu2O生成,已知Cu2O与稀硫酸反应,得到蓝色溶液和红色固体单质,有关离子方程式为_______ 。

已知:铁屑能将Fe3+还原为Fe2+。
(1)Cu2S中Cu元素的化合价为
 2Cu+SO2,该反应的氧化剂是
2Cu+SO2,该反应的氧化剂是(2)③的实验操作中用到的玻璃仪器有
(3)①试剂X通常选择H2O2,在反应中用作
②试剂X若用Cl2,缺点是
(4)灼烧过程中会有少量Cu2O生成,已知Cu2O与稀硫酸反应,得到蓝色溶液和红色固体单质,有关离子方程式为
您最近一年使用:0次
2 . 氯化铜在工农业生产中具有重要的用途。某化学兴趣小组设计如图所示装置,用CuCl2·2H2O晶体和SOCl2获取无水CuCl2并回收过量的SOCl2。回答下列问题:
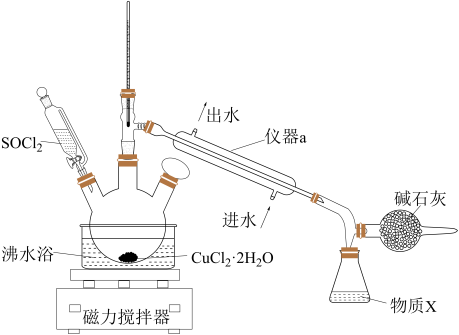
已知:①SOCl2的熔点为-105 ℃,沸点为76 ℃,遇水剧烈水解生成两种酸性气体。②三颈烧瓶中发生反应的化学方程式是CuCl2·2H2O+2SOCl2 CuCl2+2SO2↑+4HCl↑
CuCl2+2SO2↑+4HCl↑
(1)仪器a的名称是______ ,锥形瓶中得到的物质X的化学式为______ 。
(2)碱石灰中含有CaO和NaOH,碱石灰的作用是______ 。
(3)某同学用“间接碘量法”测定无水CuCl2样品中铜元素的百分含量,过程如下:取0.2800 g试样溶于水,加入过量KI固体,充分反应,生成白色CuI沉淀。滴入几滴淀粉溶液作指示剂,用0.1000 mol·L-1Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL(滴定反应为I2+2S2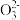 =S4
=S4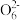 +2I-)。
+2I-)。
①滴定到终点时的现象是______ 。
②该试样中铜元素的百分含量为______ 。

已知:①SOCl2的熔点为-105 ℃,沸点为76 ℃,遇水剧烈水解生成两种酸性气体。②三颈烧瓶中发生反应的化学方程式是CuCl2·2H2O+2SOCl2
 CuCl2+2SO2↑+4HCl↑
CuCl2+2SO2↑+4HCl↑(1)仪器a的名称是
(2)碱石灰中含有CaO和NaOH,碱石灰的作用是
(3)某同学用“间接碘量法”测定无水CuCl2样品中铜元素的百分含量,过程如下:取0.2800 g试样溶于水,加入过量KI固体,充分反应,生成白色CuI沉淀。滴入几滴淀粉溶液作指示剂,用0.1000 mol·L-1Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL(滴定反应为I2+2S2
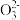 =S4
=S4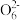 +2I-)。
+2I-)。①滴定到终点时的现象是
②该试样中铜元素的百分含量为
您最近一年使用:0次
2020-12-30更新
|
187次组卷
|
3卷引用:江苏省海安高级中学2020-2021学年高二上学期高中合格性考试化学试题
解题方法
3 . 下列转化关系不能一步实现的是
| A.CuO→Cu(OH)2 | B.NaHCO3→Na2CO3 |
| C.Na2O2→NaOH | D.Na2CO3→NaHCO3 |
您最近一年使用:0次
名校
4 . C 和 CuO 在高温下反应可能生成 Cu、Cu2O、CO2、CO。现将 1g 碳粉跟 8gCuO 混合,在硬质试管中隔绝空气高温加热,生成的气体全部通过足量 NaOH 溶液,收集残余气体。测得溶液增重 1.1g,残余气体在标准状况下的体积为 0.025L。下列说法不正确的是
| A.在硬质试管中高温加热固体混合物时,有 0.6g 碳参加了反应 |
| B.试管中的所有氧化还原反应共转移电子 0.15mol |
| C.反应生成铜和氧化亚铜的总物质的量为 0.1mol |
| D.反应后的试管中固体混合物总质量为 7.2g |
您最近一年使用:0次
名校
解题方法
5 . 下列变化不能通过一步化学反应实现的是( )
| A.BaCl2→BaSO4 | B.CuO→Cu(OH)2 | C.NaOH→Na2SO3 | D.MgSO4→Mg(OH)2 |
您最近一年使用:0次
2020-09-10更新
|
2512次组卷
|
31卷引用:江苏省启东中学2020-2021学年高一上学期期初考试化学试题
江苏省启东中学2020-2021学年高一上学期期初考试化学试题贵州省桐梓县育才中学2019-2020学年高二上学期开学考试化学试题辽宁省阜新市海州高级中学2019-2020学年高一10月月考化学试题2020年春季苏教版高中化学必修1专题一《化学家眼中的物质世界》测试卷云南省昭通市巧家县第四中学2019-2020学年高一上学期期末考试化学试题人教版(2019)高一必修第一册第一章 物质及其变化 第一节 物质的分类及转化课时2 物质的转化(已下线)1.1.2 物质的转化(重点练)-2020-2021学年高一化学上学期十分钟同步课堂专练(人教版2019必修第一册)高一必修第一册(苏教2019版)专题1 第一单元 物质及其反应的分类(已下线)【浙江新东方】hzomo化学001云南省昆明师范专科学校附属中学2020-2021学年高一上学期期中考试化学试题广西岑溪市2020-2021学年高二上学期期中考试化学(理)试题(已下线)【浙江新东方】【2020】【高一上】【期中】【hd-lp414】【化学】黑龙江省海林市朝鲜族中学2020-2021学年高一上学期第一次月考化学试题新疆维吾尔族自治区哈密市第十五中学2020-2021学年高一上学期期末考试化学试题辽宁省庄河市高级中学2021-2022学年高一10月月考化学试题山东省济南市平阴县第一中学2021-2022学年高一上学期10月阶段检测化学试题福建省南安市侨光中学2021-2022学年高一上学期第一次阶段考化学试题甘肃省甘南舟曲县第一中学2021-2022学年高一上学期第一次月考化学试卷新疆维吾尔自治区疏勒县2022 届高三第一次调研测试化学试题(已下线)专题05元素及其化合物-2022年高考真题+模拟题汇编(全国卷)(已下线)专题05元素及其化合物-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题05元素及其化合物-五年(2018~2022)高考真题汇编(全国卷)(已下线)衔接点05 物质间的相互转化-2022年初升高化学无忧衔接青海省西宁市湟中区多巴高级中学2021-2022学年高一下学期第一次月考化学试题江苏省淮安市涟水县第一中学2022-2023学年高一上学期第二次阶段检测化学试题河南省许昌市鄢陵县职业教育中心2021—2022学年高一上学期升学班第一次月考化学试题广西梧州市藤县第七中学2021-2022学年高一10月月考化学试题黑龙江省佳木斯市第八中学2021-2022学年高一上学期期中考试化学试题吉林省舒兰市第十八中学校2022-2023学年高一上学期期中考试化学试题(已下线)第2讲 物质的转化-【暑假自学课】2023年新高一暑假精品课(苏教版2019必修第一册)广东省梅州市大埔县虎山中学2023-2024学年高一上学期11月期中化学试题
名校
解题方法
6 . 现有 与
与 的混合溶液,为了分析混合溶液中
的混合溶液,为了分析混合溶液中 与
与 的质量分数,设计如下实验方案:取四份混合溶液各
的质量分数,设计如下实验方案:取四份混合溶液各 ,分别缓慢加入到
,分别缓慢加入到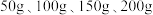 某
某 溶液中,测得四组实验数据如表:
溶液中,测得四组实验数据如表:
(1) 混合溶液与
混合溶液与 溶液完全反应生成沉淀的质量为
溶液完全反应生成沉淀的质量为______ g。
(2)试求出混合溶液中 的溶质质量分数是
的溶质质量分数是______ ?(写出计算过程)
(3)混合溶液中 的溶质质量分数为
的溶质质量分数为______ 。
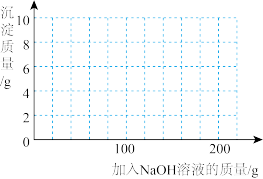
(4)若在 混合溶液中不断加入上述
混合溶液中不断加入上述 的溶液,请画出加入
的溶液,请画出加入 溶液的质量与所产生沉淀质量的关系图
溶液的质量与所产生沉淀质量的关系图______ 。(在答题卡的坐标图中作图)
 与
与 的混合溶液,为了分析混合溶液中
的混合溶液,为了分析混合溶液中 与
与 的质量分数,设计如下实验方案:取四份混合溶液各
的质量分数,设计如下实验方案:取四份混合溶液各 ,分别缓慢加入到
,分别缓慢加入到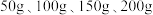 某
某 溶液中,测得四组实验数据如表:
溶液中,测得四组实验数据如表: | 第Ⅰ组 | 第Ⅱ组 | 第Ⅲ组 | 第Ⅳ组 | |
 溶液的质量 溶液的质量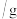 | 50 | 100 | 150 | 200 |
生成沉淀的质量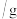 | 0 | 2.45 | 7.35 | 9.8 |
(1)
 混合溶液与
混合溶液与 溶液完全反应生成沉淀的质量为
溶液完全反应生成沉淀的质量为(2)试求出混合溶液中
 的溶质质量分数是
的溶质质量分数是(3)混合溶液中
 的溶质质量分数为
的溶质质量分数为(4)若在
 混合溶液中不断加入上述
混合溶液中不断加入上述 的溶液,请画出加入
的溶液,请画出加入 溶液的质量与所产生沉淀质量的关系图
溶液的质量与所产生沉淀质量的关系图
您最近一年使用:0次
7 . 氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业。CuCl微溶于水,不溶于稀酸,可溶于Cl-浓度较大的体系,在潮湿的空气中易水解氧化。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如下:
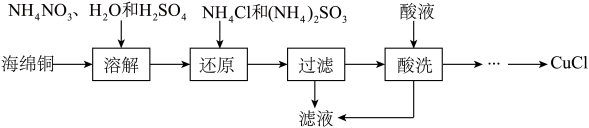
(1)基态铜原子核外电子排布式为:________ 。
(2)为了提高溶解速率,可以适当加热到60~70℃,还可以采用的措施为________ 。
(3)溶解步骤的温度控制在60~70℃,温度不宜过高的原因是________ 。该步骤中Cu 与NH4NO3反应的离子方程式为 (N元素被还原到最低价)_________________ 。
(4)还原步骤发生反应的离子方程式为______________________ 。
(5)滤液的主要成分为__________ (写化学式)。
(6)酸洗时,可选用稀硫酸或稀盐酸,但不能用浓盐酸的原因是_________________ 。

(1)基态铜原子核外电子排布式为:
(2)为了提高溶解速率,可以适当加热到60~70℃,还可以采用的措施为
(3)溶解步骤的温度控制在60~70℃,温度不宜过高的原因是
(4)还原步骤发生反应的离子方程式为
(5)滤液的主要成分为
(6)酸洗时,可选用稀硫酸或稀盐酸,但不能用浓盐酸的原因是
您最近一年使用:0次
名校
解题方法
8 . 以铜片(含少量杂质铁)为原料制取Cu(NO3)2溶液的实验流程如图:
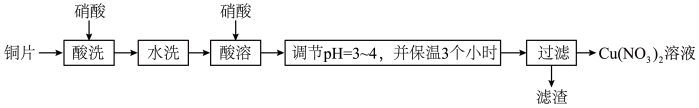
(1)“酸洗”的目的是除去铜片表面难溶的Cu2(OH)2SO4,写出“酸洗”时反应的离子方程式:___ 。
(2)“水洗”后检验铜片表面是否洗涤干净的方法是___ 。
(3)“酸溶”时的装置如图所示,烧杯内所发生的反应为:
NO+NO2+2OH-=2NO2-+H2O
2NO2+2OH-=NO2-+NO3-+H2O
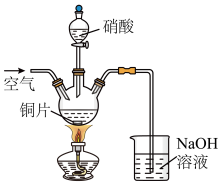
①“酸溶”时为防止反应过于剧烈,可以采取的方法有___ 和___ 。
②通入空气的作用是___ 、___ 。
(4)“调节pH=3~4,并保温3个小时”的目的是___ 。
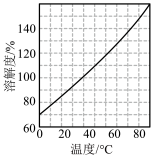
(5)烧杯中所得溶液经多步处理得到NaNO3固体。设计以烧杯中所得溶液为原料,制取NaNO3固体的实验方案:___ 。
[已知3NaNO2+2HNO3=3NaNO3+2NO↑+H2O;NaNO3的溶解度随温度变化如图所示。实验中必须使用的试剂:硝酸和NaOH溶液]。

(1)“酸洗”的目的是除去铜片表面难溶的Cu2(OH)2SO4,写出“酸洗”时反应的离子方程式:
(2)“水洗”后检验铜片表面是否洗涤干净的方法是
(3)“酸溶”时的装置如图所示,烧杯内所发生的反应为:
NO+NO2+2OH-=2NO2-+H2O
2NO2+2OH-=NO2-+NO3-+H2O

①“酸溶”时为防止反应过于剧烈,可以采取的方法有
②通入空气的作用是
(4)“调节pH=3~4,并保温3个小时”的目的是
(5)烧杯中所得溶液经多步处理得到NaNO3固体。设计以烧杯中所得溶液为原料,制取NaNO3固体的实验方案:
[已知3NaNO2+2HNO3=3NaNO3+2NO↑+H2O;NaNO3的溶解度随温度变化如图所示。实验中必须使用的试剂:硝酸和NaOH溶液]。

您最近一年使用:0次
2020-05-09更新
|
133次组卷
|
2卷引用:江苏省如皋中学2020届高三阶段检测化学试题
名校
解题方法
9 . 已知酸性条件下有如下反应:2Cu+=Cu2++Cu。由于反应温度不同,用氢气还原氧化铜时,可能产生Cu或Cu2O,两者都是红色固体。某同学对氢气还原氧化铜实验所得的红色固体产物进行验证,每一次实验操作和实验现象记录如下,由此推出氢气还原氧化铜实验的产物是( ).
| 加入试剂 | 稀硫酸 | 浓硫酸 | 稀硝酸 | 浓硝酸 |
| 实验现象 | 产生红色固体,溶液呈蓝色 | 加热,产生无色气体 | 产生无色气体,溶液呈蓝色 | 产生红棕色气体,溶液呈绿色 |
| A.只有Cu |
| B.只有Cu2O |
| C.一定有Cu,可能有Cu2O |
| D.一定有Cu2O,可能有Cu |
您最近一年使用:0次
2020-03-06更新
|
281次组卷
|
8卷引用:江苏省启东中学2020年人教版高中化学必修1期末复习第二章 化学物质及其变化(三)
江苏省启东中学2020年人教版高中化学必修1期末复习第二章 化学物质及其变化(三)2017届新疆生产建设兵团二中高三上第一次月考化学试卷2018届高三一轮复习化学:考点21-铜及其化合物性质探究福建省厦门双十中学2016-2017学年高一下学期第一次月考化学试题(已下线)2019高考热点题型和提分秘籍 第三章 金属及其化合物 第4讲 金属材料与矿物 铜及其化合物 (题型专练)(已下线)2019年1月17日 《每日一题》高考二轮复习-铜及其化合物(已下线)第三单元 物质的性质与转化(基础过关)-2020-2021学年高一化学必修第一册单元测试定心卷 (鲁科版2019)(已下线)专题05 金属及其重要化合物-备战2021届高考化学二轮复习题型专练
名校
解题方法
10 . 在给定条件下,下列选项所示的物质间转化均能实现的是( )
A.CO2 CaCO3 CaCO3 | B.Fe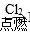 FeCl3 FeCl3 |
C.CuO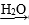 Cu(OH)2 Cu(OH)2 | D.Al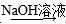 Al(OH)3 Al(OH)3 |
您最近一年使用:0次



