解题方法
1 . 广安代市镇火力发电厂需要燃烧大量的煤,产生大量CO2和SO2等,并留下大量煤渣,对环境有较大影响。其中一种不能继续燃烧的煤渣成分俗名叫“铁甲石”,主要成分为:Al2O3(15%~24%)、SiO2(40%~50%)、Fe2O3(0.5%~3.0%)、FeO(0.9%~2.0%)、CuO(8.5%~11.0%)以及其他不溶性杂质,铁甲石中的氧化铝难溶于酸,可以通过煅烧改变铁甲石结构,使其溶于酸。铁甲石经过下列化工工艺,可以制取无水CuCl2。

已知Cu2+、Fe2+、Fe3+、Al3+生成沉淀pH范围如下:
(1)第一次过滤的滤渣为___________ 。
(2)加H2O2后发生反应的离子方程式为___________ 。
(3)调节溶液pH需要控制的范围是___________ ,“调节溶液pH”的过程中除添加试剂,还需借助于___________ 测定溶液pH值。
(4)调节pH值用到的试剂或物质是___________(填下列字母)。
(5)从滤液2中得到无水CuCl2的操作为___________ 。

已知Cu2+、Fe2+、Fe3+、Al3+生成沉淀pH范围如下:
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 |
| 开始沉淀pH | 5.8 | 5.8 | 2.0 | 4.0 |
| 沉淀完成pH | 7.5 | 8.3 | 3.1 | 5.4 |
(1)第一次过滤的滤渣为
(2)加H2O2后发生反应的离子方程式为
(3)调节溶液pH需要控制的范围是
(4)调节pH值用到的试剂或物质是___________(填下列字母)。
| A.氢氧化钠 | B.氨水 | C.CuO | D.AlCl3 |
(5)从滤液2中得到无水CuCl2的操作为
您最近一年使用:0次
解题方法
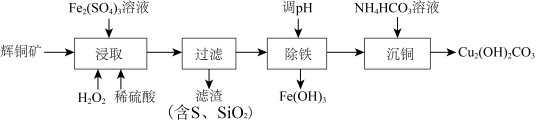
2 . 用辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)制备难溶于水的碱式碳酸铜的流程如下:
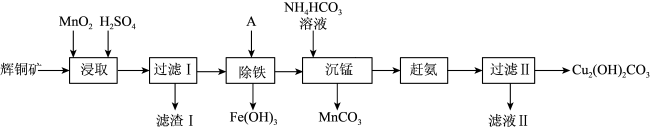
(1)下列措施能加快浸取速率的是___________ 。(填字母)
A.适当增大硫酸浓度 B.将辉铜矿粉碎 C.延长浸取时间
(2)滤渣I中的主要成分是MnO2、S、SiO2,写出“浸取”反应中生成S的离子方程式:___________ 。
(3)“除铁”的方法是通过调节溶液pH,使Fe3+转化为Fe(OH)3,则加入的试剂A最好是___________。
(4)“沉锰”(除Mn2+)过程中有关反应的离子方程式为___________ 。
(5)滤液Ⅱ所含溶质主要是___________ (填化学式)。

(1)下列措施能加快浸取速率的是
A.适当增大硫酸浓度 B.将辉铜矿粉碎 C.延长浸取时间
(2)滤渣I中的主要成分是MnO2、S、SiO2,写出“浸取”反应中生成S的离子方程式:
(3)“除铁”的方法是通过调节溶液pH,使Fe3+转化为Fe(OH)3,则加入的试剂A最好是___________。
| A.CO2 | B.CuO | C.氨水 | D.HCl |
(4)“沉锰”(除Mn2+)过程中有关反应的离子方程式为
(5)滤液Ⅱ所含溶质主要是
您最近一年使用:0次
3 . 燃煤火电厂产生的尾气(主要成分为 、NO)可以按如图所示流程脱除或利用。
、NO)可以按如图所示流程脱除或利用。
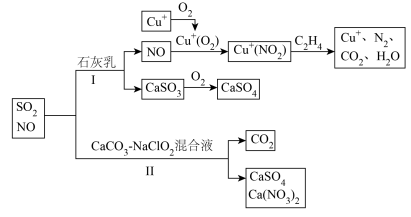
(1)写出途径Ⅰ中 转化成
转化成 的总反应化学方程式:
的总反应化学方程式:___________ 。
(2)途径Ⅰ中 的作用是
的作用是___________ ,途径Ⅰ中 的作用是
的作用是___________ 。
(3)写出途径Ⅱ中 与
与 、
、 混合液反应的化学方程式:
混合液反应的化学方程式:________ 。
(4)下列物质有可能代替途径Ⅱ中 的是______(填序号)。
的是______(填序号)。
(5)设计实验验证固体 有还原性(可供选择的试剂有:酸性
有还原性(可供选择的试剂有:酸性 溶液、
溶液、 溶液、
溶液、 溶液、
溶液、 溶液)
溶液)____ ;写出实验过程中涉及的离子反应方程式:________ 。
 、NO)可以按如图所示流程脱除或利用。
、NO)可以按如图所示流程脱除或利用。
(1)写出途径Ⅰ中
 转化成
转化成 的总反应化学方程式:
的总反应化学方程式:(2)途径Ⅰ中
 的作用是
的作用是 的作用是
的作用是(3)写出途径Ⅱ中
 与
与 、
、 混合液反应的化学方程式:
混合液反应的化学方程式:(4)下列物质有可能代替途径Ⅱ中
 的是______(填序号)。
的是______(填序号)。A. | B. | C. | D. |
(5)设计实验验证固体
 有还原性(可供选择的试剂有:酸性
有还原性(可供选择的试剂有:酸性 溶液、
溶液、 溶液、
溶液、 溶液、
溶液、 溶液)
溶液)
您最近一年使用:0次
名校
解题方法
4 . 俗名往往反映了物质的组成、性质或用途。下列对物质俗名的理解不正确的是
A.纯碱: 去油污 去油污 | B.胆矾: 净水 净水 |
C.酒精: 消毒杀菌 消毒杀菌 | D.葡萄糖: 营养成分 营养成分 |
您最近一年使用:0次
2024-01-12更新
|
209次组卷
|
2卷引用: 江苏省盐城市2023-2024学年高二学业水平合格性考试模拟预测化学试题
5 . 氯化铜晶体(CuCl2·2H2O)常用作玻璃、陶瓷着色剂和饲料添加剂等。工业上用粗制氧化铜粉(含杂质FeO和SiO2)制备无水氯化铜,制取流程如下:

已知:氯化亚砜( 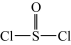 )熔点-101℃,沸点76℃,易水解。回答下列问题:
)熔点-101℃,沸点76℃,易水解。回答下列问题:
(1)为避免引入杂质,试剂x可选用___________ (填字母)
a.KMnO4溶液 b.Cl2水 c.Br2水 d.H2O2溶液
(2)溶液C中加入试剂y可以调节溶液pH,控制pH的取值范围为______~________________ ,从而除去Fe3+而不引入杂质。试剂y可选用下列物质中的___________ (填字母)
a.Cu b.CuO c.Cu2(OH)2CO3 d.NaOH
(3)SOCl2与水反应的化学方程式为___________ 。
(4)SOCl2与CuCl2·2H2O混合并加热,可得到无水CuCl2的原因是__________________ 。

| Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | |
| 开始沉淀的pH | 1.9 | 7.0 | 4.7 |
| 沉淀完全的pH | 3.2 | 9.0 | 6.7 |
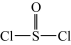 )熔点-101℃,沸点76℃,易水解。回答下列问题:
)熔点-101℃,沸点76℃,易水解。回答下列问题:(1)为避免引入杂质,试剂x可选用
a.KMnO4溶液 b.Cl2水 c.Br2水 d.H2O2溶液
(2)溶液C中加入试剂y可以调节溶液pH,控制pH的取值范围为______~_____
a.Cu b.CuO c.Cu2(OH)2CO3 d.NaOH
(3)SOCl2与水反应的化学方程式为
(4)SOCl2与CuCl2·2H2O混合并加热,可得到无水CuCl2的原因是
您最近一年使用:0次
名校
解题方法
6 . 碱式碳酸铜[ ,相对分子质量为222]可用作有机催化剂。工业上以辉铜矿(主要成分为
,相对分子质量为222]可用作有机催化剂。工业上以辉铜矿(主要成分为 ,含
,含 及少量
及少量 )为原料制备碱式碳酸铜,工业流程如下:
)为原料制备碱式碳酸铜,工业流程如下:
(1)“浸取”时能提高辉铜矿Cu浸取率的措施有___________ (填2条)
(2)某小组测得Cu浸取率随 浓度及温度影响的变化曲线如下:
浓度及温度影响的变化曲线如下:

①由图一可知 适宜的浓度范围为
适宜的浓度范围为___________ ;
②由图一中的a点分析,浸取时 也起到了氧化辉铜矿的作用,该反应的离子方程式为
也起到了氧化辉铜矿的作用,该反应的离子方程式为___________ 。
③图二中高于85℃时Cu浸取率下降的原因是___________ 。
(3)①“除铁”步骤调pH可加入试剂___________ (填选项字母);
a.HCl b.NaOH c.CuO d.
②常温下,“过滤”后的滤液中 ,则“除铁”步骤调pH应小于
,则“除铁”步骤调pH应小于___________ 。[常温下,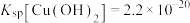 ]。
]。
(4)某实验小组为测定碱式碳酸铜的纯度,取制得的碱式碳酸铜产品5.0g,加适量硫酸,再加100mL水,加热溶解,冷却后配成250mL溶液。量取配成的25.00mL溶液于碘量瓶中,加入适量缓冲溶液控制溶液的pH在3~4之间,以及过量的碘化钾,摇匀,于暗处放置5分钟。用 的
的 溶液进行滴定,至临近滴定终点时再加入1mL淀粉溶液做指示剂,继续滴入
溶液进行滴定,至临近滴定终点时再加入1mL淀粉溶液做指示剂,继续滴入 溶液至滴定终点。平行测定3次,实验数据如下表所示。
溶液至滴定终点。平行测定3次,实验数据如下表所示。
已知: ,
,
①判断滴定到达终点的现象是___________ ;
②根据表中数据计算实验小组制得的碱式碳酸铜的纯度为___________ 。
(5)对下列几种假定情况进行讨论(填“偏高”、“偏低”或“无影响”);
①装 溶液的滴定管,滴定前尖嘴处有气泡,滴定后气泡消失,对测定结果的影响是
溶液的滴定管,滴定前尖嘴处有气泡,滴定后气泡消失,对测定结果的影响是___________ ;
②读 溶液体积时,若滴定前仰视,滴定后俯视,对测定结果的影响是
溶液体积时,若滴定前仰视,滴定后俯视,对测定结果的影响是___________ 。
 ,相对分子质量为222]可用作有机催化剂。工业上以辉铜矿(主要成分为
,相对分子质量为222]可用作有机催化剂。工业上以辉铜矿(主要成分为 ,含
,含 及少量
及少量 )为原料制备碱式碳酸铜,工业流程如下:
)为原料制备碱式碳酸铜,工业流程如下:
(1)“浸取”时能提高辉铜矿Cu浸取率的措施有
(2)某小组测得Cu浸取率随
 浓度及温度影响的变化曲线如下:
浓度及温度影响的变化曲线如下:
①由图一可知
 适宜的浓度范围为
适宜的浓度范围为②由图一中的a点分析,浸取时
 也起到了氧化辉铜矿的作用,该反应的离子方程式为
也起到了氧化辉铜矿的作用,该反应的离子方程式为③图二中高于85℃时Cu浸取率下降的原因是
(3)①“除铁”步骤调pH可加入试剂
a.HCl b.NaOH c.CuO d.

②常温下,“过滤”后的滤液中
 ,则“除铁”步骤调pH应小于
,则“除铁”步骤调pH应小于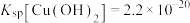 ]。
]。(4)某实验小组为测定碱式碳酸铜的纯度,取制得的碱式碳酸铜产品5.0g,加适量硫酸,再加100mL水,加热溶解,冷却后配成250mL溶液。量取配成的25.00mL溶液于碘量瓶中,加入适量缓冲溶液控制溶液的pH在3~4之间,以及过量的碘化钾,摇匀,于暗处放置5分钟。用
 的
的 溶液进行滴定,至临近滴定终点时再加入1mL淀粉溶液做指示剂,继续滴入
溶液进行滴定,至临近滴定终点时再加入1mL淀粉溶液做指示剂,继续滴入 溶液至滴定终点。平行测定3次,实验数据如下表所示。
溶液至滴定终点。平行测定3次,实验数据如下表所示。已知:
 ,
,
| 实验编号 | 滴定前 溶液的体积读数/mL 溶液的体积读数/mL | 滴定后 溶液的体积读数/mL 溶液的体积读数/mL |
| 1 | 0.10 | 20.12 |
| 2 | 1.20 | 23.21 |
| 3 | 1.50 | 21.48 |
②根据表中数据计算实验小组制得的碱式碳酸铜的纯度为
(5)对下列几种假定情况进行讨论(填“偏高”、“偏低”或“无影响”);
①装
 溶液的滴定管,滴定前尖嘴处有气泡,滴定后气泡消失,对测定结果的影响是
溶液的滴定管,滴定前尖嘴处有气泡,滴定后气泡消失,对测定结果的影响是②读
 溶液体积时,若滴定前仰视,滴定后俯视,对测定结果的影响是
溶液体积时,若滴定前仰视,滴定后俯视,对测定结果的影响是
您最近一年使用:0次
名校
7 . 柠檬酸因具有酸性和较好的络合性,可用于浸出金属离子并得到柠檬酸浸出液。下图是从柠檬酸浸出液中分离出铜并制备碱式碳酸铜: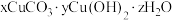 的流程
的流程

实验:(1)调pH值分离铜时,理论上铜离子完全沉淀时pH为6.67,本实验中测得pH=8时铜的沉淀率仅为7.2%,远小干理论分析结果
(2)“还原法沉铜”的步骤中,利用抗坏血酸C6H8O6能有效的将Cu(OH)2还原成金属Cu,抗坏血酸C6H8O6易被氧化为脱氢抗坏血酸C6H6O6;且受热易分解。
(3)相同条件下温度对Cu沉淀率的影响是:随着温度的升高,相同时间内Cu的沉淀率先逐渐增加,在80℃时达到最高点,后略有下降。
(4)实验称取9.55g碱式碳酸铜 产品,通入氢气充分加热反应后,得到4.8g固体残留物,同时生成2.2g二氧化碳和2.7g水。
产品,通入氢气充分加热反应后,得到4.8g固体残留物,同时生成2.2g二氧化碳和2.7g水。
则下列说法不正确的是
 的流程
的流程
实验:(1)调pH值分离铜时,理论上铜离子完全沉淀时pH为6.67,本实验中测得pH=8时铜的沉淀率仅为7.2%,远小干理论分析结果
(2)“还原法沉铜”的步骤中,利用抗坏血酸C6H8O6能有效的将Cu(OH)2还原成金属Cu,抗坏血酸C6H8O6易被氧化为脱氢抗坏血酸C6H6O6;且受热易分解。
(3)相同条件下温度对Cu沉淀率的影响是:随着温度的升高,相同时间内Cu的沉淀率先逐渐增加,在80℃时达到最高点,后略有下降。
(4)实验称取9.55g碱式碳酸铜
 产品,通入氢气充分加热反应后,得到4.8g固体残留物,同时生成2.2g二氧化碳和2.7g水。
产品,通入氢气充分加热反应后,得到4.8g固体残留物,同时生成2.2g二氧化碳和2.7g水。则下列说法不正确的是
A.经过计算碱式碳酸铜的化学式组成为 |
| B.调pH分离铜时,因Cu2+与柠檬酸根形成配合物,则与OH-形成Cu(OH)2减少 |
C.抗坏血酸还原Cu(OH)2的化学反应方程式为: |
| D.温度超过80℃时,因抗坏血酸受热易分解,使浓度降低,还原铜的能力减弱 |
您最近一年使用:0次
名校
8 . 铜是历史上最早使用的金属,铜有许多化合物: 、
、 、
、 、
、 、
、 ,
, 、
、 、
、 、
、 等。下列物质间转化正确的是
等。下列物质间转化正确的是
 、
、 、
、 、
、 、
、 ,
, 、
、 、
、 、
、 等。下列物质间转化正确的是
等。下列物质间转化正确的是| 原料 | 条件(或反应物) | 产物 | |
| A | 新制 | 葡萄糖,加热 |  |
| B |  | 水 |  |
| C |  | 氢氧化钠溶液 |  |
| D |  | 硫酸铁 |  |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
9 . 工业上,处理低品位黄铜矿[二硫化亚铁铜( )含量较低]常采用生物堆浸法。堆浸所得的溶液可用于制备绿矾(
)含量较低]常采用生物堆浸法。堆浸所得的溶液可用于制备绿矾( )和胆矾(
)和胆矾( ),相关流程如下图。
),相关流程如下图。
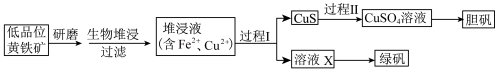
资料:①生物堆浸使用的氧化亚铁硫杆菌(T。f细菌)在pH1.0~6.0范围内可保持活性。
②金属离子沉淀的pH如下表。
(1)生物堆浸前,需先将矿石进行研磨,目的是___________ 。
(2)生物堆浸过程的反应在T。f细菌的作用下进行,主要包括两个阶段,第一阶段的反应为: 。第二阶段反应为
。第二阶段反应为 继续被氧化转变成
继续被氧化转变成 ,反应的离子方程式为
,反应的离子方程式为___________ 。
(3)生物堆浸过程中,应控制溶液的pH在___________ 范围内。
(4) 在过程Ⅰ中被还原为
在过程Ⅰ中被还原为 。
。
①若过程Ⅰ中只加入一种试剂,在下列常见还原剂中可选择___________ 。
a. b.
b. c.
c. d.Cu
d.Cu
② 做还原剂时,通常被氧化为
做还原剂时,通常被氧化为 。过程Ⅰ中若加入
。过程Ⅰ中若加入 固体,则发生反应的离子方程式有
固体,则发生反应的离子方程式有___________ 、___________ (忽略该过程中所有涉及配合物的反应)。
③为判断堆浸液中 是否被完全还原,可取少量溶液X,向其中加入
是否被完全还原,可取少量溶液X,向其中加入___________ (填试剂的化学式),观察溶液颜色变化。
(5)向过程Ⅰ所得固体中加入___________ (填试剂的化学式),过滤,可得CuS固体。然后加 和稀硫酸,CuS
和稀硫酸,CuS完全溶解 ,用离子方程式表示 的作用是
的作用是___________ 。
 )含量较低]常采用生物堆浸法。堆浸所得的溶液可用于制备绿矾(
)含量较低]常采用生物堆浸法。堆浸所得的溶液可用于制备绿矾( )和胆矾(
)和胆矾( ),相关流程如下图。
),相关流程如下图。
资料:①生物堆浸使用的氧化亚铁硫杆菌(T。f细菌)在pH1.0~6.0范围内可保持活性。
②金属离子沉淀的pH如下表。
 |  |  | |
| 开始沉淀时的pH | 1.5 | 4.2 | 6.3 |
| 完全沉淀时的pH | 2.8 | 6.7 | 8.3 |
(1)生物堆浸前,需先将矿石进行研磨,目的是
(2)生物堆浸过程的反应在T。f细菌的作用下进行,主要包括两个阶段,第一阶段的反应为:
 。第二阶段反应为
。第二阶段反应为 继续被氧化转变成
继续被氧化转变成 ,反应的离子方程式为
,反应的离子方程式为(3)生物堆浸过程中,应控制溶液的pH在
(4)
 在过程Ⅰ中被还原为
在过程Ⅰ中被还原为 。
。①若过程Ⅰ中只加入一种试剂,在下列常见还原剂中可选择
a.
 b.
b. c.
c. d.Cu
d.Cu②
 做还原剂时,通常被氧化为
做还原剂时,通常被氧化为 。过程Ⅰ中若加入
。过程Ⅰ中若加入 固体,则发生反应的离子方程式有
固体,则发生反应的离子方程式有③为判断堆浸液中
 是否被完全还原,可取少量溶液X,向其中加入
是否被完全还原,可取少量溶液X,向其中加入(5)向过程Ⅰ所得固体中加入
 和稀硫酸,CuS
和稀硫酸,CuS 的作用是
的作用是
您最近一年使用:0次
10 . 硫酸铜既是一种肥料,又是一种普遍应用的杀菌剂。电子工业上常用氯化铁溶液做印刷电路铜板的“腐蚀液”,使用过的腐蚀废液中的金属离子主要有 、
、 和
和 。化学兴趣小组设计如下流程利用废液制备
。化学兴趣小组设计如下流程利用废液制备 并回收氯化铁溶液。
并回收氯化铁溶液。
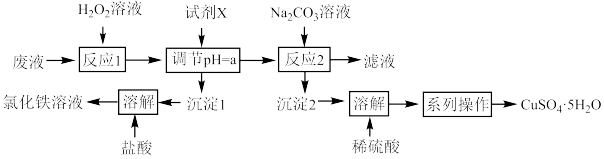
已知:①硫酸铜易溶于水,不溶于乙醇。
②常温下部分阳离子以氢氧化物形式沉淀时溶液的 如表所示。
如表所示。
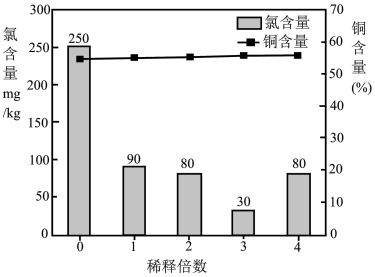
(溶液中的离子浓度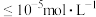 视为完全沉淀)
视为完全沉淀)
回答下列问题:
(1)配制“腐蚀液”时,将 固体溶于
固体溶于______________ ,再加水稀释。
(2)反应1中加入 溶液的目的是
溶液的目的是____________________________________
(3)试剂X的最佳选择为____________ ;a的取值范围是____________ 。
A. B.
B. C.氨水
C.氨水
(4)沉淀2为碱式碳酸铜 ,同时有气泡产生。反应2的离子方程式为
,同时有气泡产生。反应2的离子方程式为____________
(5)实验测定沉淀2中含有碱式氯化铜 杂质。处理前对废液进行稀释,不同稀释倍数沉淀2中铜元素含量和氯元素含量如图所示,废液的最佳稀释倍数为
杂质。处理前对废液进行稀释,不同稀释倍数沉淀2中铜元素含量和氯元素含量如图所示,废液的最佳稀释倍数为____________ 。
(6)系列操作的步骤包括________________________ 、过滤、乙醇洗涤、干燥。
 、
、 和
和 。化学兴趣小组设计如下流程利用废液制备
。化学兴趣小组设计如下流程利用废液制备 并回收氯化铁溶液。
并回收氯化铁溶液。
已知:①硫酸铜易溶于水,不溶于乙醇。
②常温下部分阳离子以氢氧化物形式沉淀时溶液的
 如表所示。
如表所示。(溶液中的离子浓度
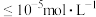 视为完全沉淀)
视为完全沉淀)| 沉淀物 |  |  |  |
开始沉淀 | 5.4 | 2.7 | 5.8 |
完全沉淀 | 6.7 | 3.2 | 8.8 |
(1)配制“腐蚀液”时,将
 固体溶于
固体溶于(2)反应1中加入
 溶液的目的是
溶液的目的是(3)试剂X的最佳选择为
A.
 B.
B. C.氨水
C.氨水(4)沉淀2为碱式碳酸铜
 ,同时有气泡产生。反应2的离子方程式为
,同时有气泡产生。反应2的离子方程式为(5)实验测定沉淀2中含有碱式氯化铜
 杂质。处理前对废液进行稀释,不同稀释倍数沉淀2中铜元素含量和氯元素含量如图所示,废液的最佳稀释倍数为
杂质。处理前对废液进行稀释,不同稀释倍数沉淀2中铜元素含量和氯元素含量如图所示,废液的最佳稀释倍数为
(6)系列操作的步骤包括
您最近一年使用:0次
2023-12-05更新
|
121次组卷
|
2卷引用:辽宁省部分学校2023-2024学年高二上学期11月期中考试化学试题



