1 . 铜与浓硫酸在如图所示装置中发生反应,实验中观察到的现象为 试管中溶液变为绿色,试管底部出现黑色和灰白色沉淀;
试管中溶液变为绿色,试管底部出现黑色和灰白色沉淀; 试管中先出现气泡,短时间内品红溶液无变化,之后溶液的红色逐渐变浅直至褪去。试回答下列问题:
试管中先出现气泡,短时间内品红溶液无变化,之后溶液的红色逐渐变浅直至褪去。试回答下列问题:
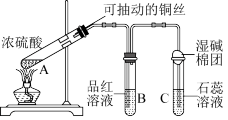
(1) 试管中发生反应的化学方程式为
试管中发生反应的化学方程式为______ 。
(2) 试管中先出现的气泡为
试管中先出现的气泡为______ (填名称)。
(3)实验完毕后取下 试管,
试管,______ ,若溶液______ ,可证明使品红溶液褪色的物质为 。
。
(4) 试管中的现象是
试管中的现象是______ 。
(5)湿碱棉团的作用是______ 。
(6)实验完毕后,待溶液冷却后,取 试管中上层清液加入水中,发现溶液温度升高。试解释溶液温度升高的原因:
试管中上层清液加入水中,发现溶液温度升高。试解释溶液温度升高的原因:____________ 。
(7)将反应后的沉淀加入水中,黑色沉淀不溶解,灰白色沉淀大部分溶解,溶液变为蓝色,则灰白色沉淀的主要成分为____________ 。
(8)黑色沉淀可能为 、
、 或
或 ,根据所学知识,设计实验验证黑色沉淀中是否含有
,根据所学知识,设计实验验证黑色沉淀中是否含有 (已知
(已知 、
、 均为黑色固体,不溶于水和稀硫酸):
均为黑色固体,不溶于水和稀硫酸):____________ 。
 试管中溶液变为绿色,试管底部出现黑色和灰白色沉淀;
试管中溶液变为绿色,试管底部出现黑色和灰白色沉淀; 试管中先出现气泡,短时间内品红溶液无变化,之后溶液的红色逐渐变浅直至褪去。试回答下列问题:
试管中先出现气泡,短时间内品红溶液无变化,之后溶液的红色逐渐变浅直至褪去。试回答下列问题:
(1)
 试管中发生反应的化学方程式为
试管中发生反应的化学方程式为(2)
 试管中先出现的气泡为
试管中先出现的气泡为(3)实验完毕后取下
 试管,
试管, 。
。(4)
 试管中的现象是
试管中的现象是(5)湿碱棉团的作用是
(6)实验完毕后,待溶液冷却后,取
 试管中上层清液加入水中,发现溶液温度升高。试解释溶液温度升高的原因:
试管中上层清液加入水中,发现溶液温度升高。试解释溶液温度升高的原因:(7)将反应后的沉淀加入水中,黑色沉淀不溶解,灰白色沉淀大部分溶解,溶液变为蓝色,则灰白色沉淀的主要成分为
(8)黑色沉淀可能为
 、
、 或
或 ,根据所学知识,设计实验验证黑色沉淀中是否含有
,根据所学知识,设计实验验证黑色沉淀中是否含有 (已知
(已知 、
、 均为黑色固体,不溶于水和稀硫酸):
均为黑色固体,不溶于水和稀硫酸):
您最近一年使用:0次
2020-03-04更新
|
493次组卷
|
3卷引用:2015-2016学年北京市怀柔区高一上学期期末化学试卷
10-11高一下·吉林长春·期中
名校
解题方法
2 . 铜和镁的合金4.6 g完全溶于浓硝酸,若反应中硝酸被还原只产生4 480 mL NO2气体和336 mL的N2O4气体(气体的体积已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为 ( )
| A.9.02 g | B.8.51 g | C.8.26 g | D.7.04 g |
您最近一年使用:0次
2020-02-25更新
|
1132次组卷
|
38卷引用:2015届北京市重点中学高三上学期第一次月考化学试卷
(已下线)2015届北京市重点中学高三上学期第一次月考化学试卷(已下线)2010-2011学年吉林省长春十一中高一下学期期中考试化学试卷(已下线)2012届河南省洛阳市高三上学期期中考试化学试卷(已下线)2013届辽宁省东北育才学校高三第一次模拟考试化学试卷(已下线)2012-2013学年陕西省西安市高陵县第三中学高一第三次月考化学试卷(已下线)2013届辽宁省东北育才学校高三第一次模拟考试化学试卷 (已下线)2015届山东省聊城市第一中学高三上学期第一次阶段性测试化学试卷2014-2015安徽省淮南市第二中学高一下学期期中考试化学试卷2016届陕西省西北农林科技大学附属中学高三上学期期中化学试卷2015-2016学年河北省武邑中学高一下周考化学试卷2015-2016学年吉林省实验中学高一下期中化学试卷河北省石家庄市第一中学2016-2017学年高一下学期学情反馈(一)化学试题2016-2017学年湖北省七校(荆州中学、襄阳五中、襄阳四中等)高一下学期期中联考化学试卷湖北省鄂东南省级示范高中教育教学改革联盟学校2018届高三上学期期中联考化学试题(已下线)2019高考备考一轮复习精品资料 第一章 从实验学化学 第3讲 化学计算中常用的几种方法【押题专练】(已下线)2019年8月26日 《每日一题》2020年高考一轮复习-金属与HNO3反应的规律和相关计算甘肃省武威市第六中学2020届高三上学期第四次阶段性复习过关考试化学试题甘肃省武威第十八中学2020届高三上学期第三次月考诊断化学试题浙江省宁波市慈溪中学2019届高三化学二轮复习:化学计算专题5.3 化学计算(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升山东省日照市五莲县2020届高三上学期10月模块诊断性测试化学试题湖北省武汉市蔡甸区汉阳一中2019-2020学年高一下学期期中联考化学试题陕西省延安市吴起高级中学2019-2020学年高二下学期第四次质量检测(期末)化学试题浙江省东阳中学2020-2021学年高二上学期10月阶段考试化学试题内蒙古自治区乌兰察布市四子王旗第一中学2021届高三上学期期中考试化学试题安徽省马鞍山市和县2020-2021学年高一上学期期中联考化学试题甘肃省武威第六中学2021届高三上学期第四次过关考试化学试题(已下线)练习14 硝酸 酸雨及防治-2020-2021学年【补习教材·寒假作业】高一化学(人教版2019)云南省玉溪市三中2021-2022学年高一下学期3月份入学考试 化学试题(已下线)微专题04 以物质的量为中心的计算-备战2023年高考化学一轮复习考点微专题浙江省浦江中学、长兴中学、余杭高中2021-2022学年高一下学期三校联考(3月)化学试题浙江省湖州市长兴县等三县2019-2020学年高二上学期期中考试化学试题 新疆石河子第一中学2021-2022学年高二5月月考化学试题甘肃省武威第七中学2022-2023学年高三上学期第一次质量检测化学试题湖北省恩施州高中教育联盟2020-2021学年高一下学期期末考试化学试题湖南省长沙市雅礼中学2022-2023学年高二上学期入学考试化学试题(已下线)微专题 化学计算的思想方法天津市滨海新区2023-2024学年塘沽第一中学高三上学期第二次月考化学试题
13-14高一上·浙江杭州·期末
名校
解题方法
3 . 3.2g铜与过量硝酸(8mol·L-1、30mL)充分反应,硝酸的还原产物为二氧化氮和一氧化氮,反应后溶液中含amol氢离子,则此时溶液中所含硝酸根离子的物质的量为( )
| A.(0.2+a)mol | B.(0.1+a)mol |
| C.(0.05+a)mol | D.amol |
您最近一年使用:0次
2019-12-05更新
|
1316次组卷
|
24卷引用:北京清华大学附属中学2022-2023学年高一上学期期末考试化学试卷
北京清华大学附属中学2022-2023学年高一上学期期末考试化学试卷(已下线)2012-2013学年浙江省杭州十四中高一上学期期末考试化学试卷(已下线)2013届福建省清流一中高三第三阶段考试化学试卷2014-2015海南省海南中学高一上学期期末化学试卷2016届甘肃会宁第一中学高三上第三次月考理化学试卷2015-2016学年山东省淄博市高青一中高一下4月月考化学试卷2015-2016学年山东省淄博市高青一中高一4月月考化学试卷2015-2016学年内蒙古杭锦后旗奋斗中学高一下期中化学卷人教版化学必修一.4.4氨 硝酸 硫酸同步测试卷浙江省台州市书生中学2019-2020学年高二年级上学期第一次月考化学试题鲁科版必修一2019—2020学年第三章检测试题云南省昭通市彝良县一中2019—2020学年高一上学期期末考试化学试题2020年春季鲁教版高中化学必修1第3章《自然界中的元素》测试卷2020届高三化学无机化学二轮专题复习——铜的性质【选择精编26题】广西壮族自治区南宁市第二十六中学2019-2020学年高一下学期3月线上考试化学试题重庆市黔江新华中学校2019-2020高一下学期期中考试化学试题(已下线)考点16 常见非金属元素单质及其重要化合物4——氮-2020年【衔接教材·暑假作业】新高三一轮复习化学四川省仁寿第一中学校南校区2019-2020学年高一下学期开学考试化学试题(已下线)第三单元 物质的性质与转化(能力提升)-2020-2021学年高一化学必修第一册单元测试定心卷 (鲁科版2019)湖北省武汉市外国语学校2019-2020学年高一下学期期中考试化学试题河北省张家口市宣化第一中学2020-2021学年高一下学期期中考试化学试题云南省玉溪市江川区第二中学2020-2021学年高一下学期期中考试化学试题山西省大同市第一中学2022-2023学年高一下学期3月考试化学试题 吉林省实验中学2023-2024学年高一上学期12月期中化学试题
名校
4 . 研究铜和铁与浓硫酸的反应,实验如下:
下列说法正确的是
| ① | ② |
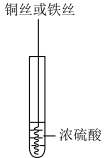 | 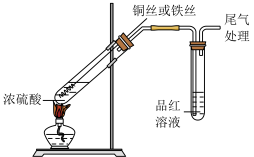 |
| 铜丝表面无明显现象 铁丝表面迅速变黑,之后无明显现象 | 铜丝或铁丝逐渐溶解,产生大量气体, 品红溶液褪色 |
| A.常温下不能用铁制容器盛放浓硫酸,可用铜制容器盛放浓硫酸 |
| B.②中铜丝或铁丝均有剩余时,产生气体的物质的量相等 |
| C.依据②,可推断出铜和铁与浓硫酸反应可生成SO2 |
| D.①②中现象的差异仅是由于温度改变了化学反应速率 |
您最近一年使用:0次
2019-05-28更新
|
2428次组卷
|
18卷引用:【区级联考】北京市通州区2019届高三下学期第三次模拟考试理科综合化学试题
【区级联考】北京市通州区2019届高三下学期第三次模拟考试理科综合化学试题北京市朝阳区2023届高三下学期三模化学试题(已下线)第4章 非金属及其化合物 单元测试(测)——2020年高考化学一轮复习讲练测(已下线)小题必刷15 铁、铜及其化合物——2021年高考化学一轮复习小题必刷(通用版)(已下线)小题必刷19 硫及其化合物——2021年高考化学一轮复习小题必刷(通用版)山西省实验中学2021届高三9月月考化学试题(已下线)易错19 实验装置类选择题-备战2021年高考化学一轮复习易错题(人教版2019)必修第二册 第五章 化工生产中的重要非金属元素 第一节 硫及其化合物四川省成都龙泉二中2021届高三下学期3月月考理综化学试题(已下线)第10讲 金属材料及金属矿物的开发利用(精练)-2022年高考化学一轮复习讲练测(已下线)考点11 硫及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点11 硫及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考点10 硫及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)山西省实验中学2020-2021学年高三上学期第一次月考化学试题(已下线)专题七实验装置图(讲)(已下线)第5讲 金属材料与金属的冶炼(已下线)考点10 硫及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)山东省青岛第五十八中学2023-2024学年高一上学期1月月考化学试题
5 . 某学习小组利用下图装置探究铜与浓H2SO4的反应(夹持装置和A中加热装置已略,气密性已检验)。
资料:微量Cu2+与过量NaOH溶液发生反应:Cu2++4OH− =[Cu(OH)4]2−,[Cu(OH)4]2−溶于甘油形成特征的绛蓝色溶液。
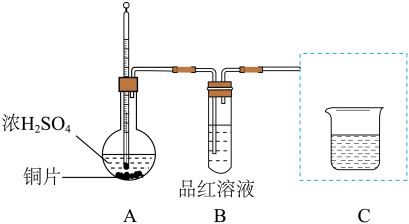
(1)A中反应的化学方程式是________ 。
(2)将装置C补充完整并标明所用试剂________ 。
(3)实验I中,铜片表面的黑色沉淀可能含CuO、Cu2S或CuS。为探究黑色沉淀的成分,取出反应后的铜片,用水小心冲洗后,进行下列操作:
甲认为通过上述两个实验证明黑色沉淀不含CuO,理由是________ 。
②乙同学认为仅通过颜色判断不能得出上述结论,理由是______ 。需要增加实验iii,说明黑色沉淀不含CuO,实验iii的操作和现象是_______ 。
(4)甲同学对黑色沉淀成分继续探究,补全实验方案:
(5)用仪器分析黑色沉淀的成分,数据如下:
230℃时黑色沉淀的成分是__________ 。
(6)为探究黑色沉淀消失的原因,取230℃时的黑色沉淀,加入浓H2SO4,加热至250℃时,黑色沉淀溶解,有刺激性气味的气体生成,试管底部出现淡黄色固体,溶液变蓝。用化学方程式解释原因____ 。
(7)综合上述实验过程,说明Cu和浓H2SO4除发生主反应外,还发生着其他副反应,为了避免副反应的发生,Cu和浓H2SO4反应的实验方案是______ 。
资料:微量Cu2+与过量NaOH溶液发生反应:Cu2++4OH− =[Cu(OH)4]2−,[Cu(OH)4]2−溶于甘油形成特征的绛蓝色溶液。

| 编号 | 实验用品 | 实验现象 | |
| I | 10mL 15mol/L 浓H2SO4溶液 | 过量铜片 | 剧烈反应,品红溶液褪色,150℃时铜片表面产生大量黑色沉淀,继续加热,250℃时黑色沉淀消失。 |
| II | 10mL 15mol/L 浓H2SO4溶液 | 适量铜片 | 剧烈反应,品红溶液褪色,150℃时铜片表面产生少量黑色沉淀,继续加热,250℃时黑色沉淀消失。 |
(1)A中反应的化学方程式是
(2)将装置C补充完整并标明所用试剂
(3)实验I中,铜片表面的黑色沉淀可能含CuO、Cu2S或CuS。为探究黑色沉淀的成分,取出反应后的铜片,用水小心冲洗后,进行下列操作:
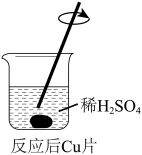 |  |
| i. 黑色沉淀脱落,一段时间后,上层溶液呈无色。 | ii. 开始时,上层溶液呈无色,一段时间后,上层溶液呈淡蓝色。 |
甲认为通过上述两个实验证明黑色沉淀不含CuO,理由是
②乙同学认为仅通过颜色判断不能得出上述结论,理由是
(4)甲同学对黑色沉淀成分继续探究,补全实验方案:
| 编号 | 实验操作 | 实验现象 |
| iv | 取洗净后的黑色沉淀,加入适量 | 黑色沉淀全部溶解,试管上部出现红棕色气体,底部有淡黄色固体生成。 |
(5)用仪器分析黑色沉淀的成分,数据如下:
| 150℃取样 | 230℃取样 |
| 铜元素3.2g,硫元0.96g。 | 铜元素1.28g,硫元0.64g。 |
230℃时黑色沉淀的成分是
(6)为探究黑色沉淀消失的原因,取230℃时的黑色沉淀,加入浓H2SO4,加热至250℃时,黑色沉淀溶解,有刺激性气味的气体生成,试管底部出现淡黄色固体,溶液变蓝。用化学方程式解释原因
(7)综合上述实验过程,说明Cu和浓H2SO4除发生主反应外,还发生着其他副反应,为了避免副反应的发生,Cu和浓H2SO4反应的实验方案是
您最近一年使用:0次
13-14高一上·陕西宝鸡·期末
名校
6 . 一定量的Cu粉与浓H2SO4共热产生SO2气体的体积为2.24 L(标准状况下),则下列情况不可能的是( )
| A.加入Cu的质量为6.4 g |
| B.加入的浓H2SO4中含溶质0.2 mol |
| C.加入Cu的质量大于6.4 g |
| D.加入浓H2SO4中含溶质多于0.2 mol |
您最近一年使用:0次
2018-09-12更新
|
719次组卷
|
16卷引用:北京五中2019-2020学年度高一第二学期第一次阶段性考试试卷化学试题
北京五中2019-2020学年度高一第二学期第一次阶段性考试试卷化学试题(已下线)2012-2013学年陕西省宝鸡中学高一上学期期末考试化学试卷(已下线)2012-2013广西柳州铁一中高一上学期段考化学试卷(已下线)2019高考备考一轮复习精品资料 第四章 常见的非金属及其化合物 第3讲 硫及其化合物【押题专练】(已下线)2019高考热点题型和提分秘籍 第四章 常见的非金属及其化合物 第3讲 硫及其化合物 (教学案)安徽省亳州市黉学高级中学2019-2020学年高一上学期期中考试化学试题(英才班)陕西省宝鸡市渭滨区2019—2020学年高一上学期期末考试化学试题安徽省安庆市怀宁县第二中学2020届高三下学期线上测试化学试题安徽省安庆市怀宁县第二中学2021届高三上学期第五次月考化学试题(已下线)5.1.2 硫酸(练好题)(能力提升)-2020-2021学年高一化学新教材新理念新设计同步课堂(人教2019必修第二册)(已下线)课时22 硫及其化合物-2022年高考化学一轮复习小题多维练(全国通用)(已下线)专题07 常见非金属及其化合物-备战2022年高考化学学霸纠错(全国通用)黑龙江省双鸭山市集贤县2021-2022学年高一下学期期中考试化学试题上海市长宁区2022-2023学年高一上学期学业综合评价化学试题(已下线)第四章 非金属及其化合物 第21练 硫酸 含硫物质的转化(已下线)专题03 硫酸和硝酸专讲(专题过关)-2022-2023学年高一化学下学期期中期末考点大串讲(人教版2019必修第二册)
7 . 室温下,某兴趣小组用下图装置在通风橱中进行如下实验:

下列说法正确的是

下列说法正确的是
| A.试管 I 中浅红棕色气体为 NO2,由硝酸还原生成 |
| B.等质量的 Cu 完全溶解时, I 中消耗的 HNO3 更多 |
| C.换成 Fe 之后重复实验,依然是试管 II 中反应更剧烈 |
| D.试管 II 中反应后溶液颜色与试管 I 中的不同, 是由于溶有 NO2 |
您最近一年使用:0次
名校
8 . 铜粉放入稀硫酸溶液中,加热后无明显变化,但加入某盐一段时间后,发现铜粉溶解,溶液呈蓝色,且无气体逸出,该盐可能是
| A.FeC13 | B.Na2CO3 | C.KNO3 | D.FeSO4 |
您最近一年使用:0次
2018-01-27更新
|
205次组卷
|
6卷引用:北京市昌平临川育人学校2018届高三上学期期末考试化学试题
北京市昌平临川育人学校2018届高三上学期期末考试化学试题2015-2016学年山东寿光现代中学高一上12月月考化学卷2017届河北省定州中学高三上期末化学试卷(已下线)2019高考备考一轮复习精品资料 第四章 常见的非金属及其化合物 第4讲 氮及其化合物【押题专练】甘肃省武威市第一中学2019-2020学年高一下学期期中考试化学试题四川省达州市第一中学校2021-2022学年高一下学期第一次月考化学试题
10-11高三上·江苏盐城·期中
名校
9 . 下列化学实验事实及其解释都正确的是
| A.过量的铜屑与稀硝酸作用,反应停止后,再加入1 mol/L稀硫酸,铜屑又逐渐溶解是因为铜可直接与1 mol/L稀硫酸反应 |
| B.粗锌与稀硫酸反应制氢气比纯锌快,是因为粗锌比纯锌还原性强 |
| C.铁钉放在浓硝酸中浸泡后,再用蒸馏水冲洗,然后放入CuSO4溶液中不反应,说明铁钉表面 形成了一层致密稳定的氧化膜 |
| D.工业制玻璃的主要反应之一:Na2CO3+SiO2高温Na2SiO3+CO2↑,该反应原理可用“强酸H2CO3制弱酸H2SiO3”来解释 |
您最近一年使用:0次
2017-11-02更新
|
463次组卷
|
7卷引用:北京市平谷区第五中学2019-2020学年高一下学期4月月考化学试题
北京市平谷区第五中学2019-2020学年高一下学期4月月考化学试题(已下线)2011届江苏省盐城中学高三上学期期中考试化学试卷(已下线)2012届江苏省苏州市苏苑高级中学高三上学期10月份月考化学试卷(已下线)2011-2012学年江苏省泰州中学高三化学期中化学试卷湖北省沙市中学2018届高三上学期第二次双周考试化学试题(已下线)考点25 高三化学一轮成果检测卷A——《备战2020年高考精选考点专项突破题集》2020届高三化学二轮冲刺新题专练——影响化学反应速率的因素(提升练)
名校
解题方法
10 . 课外小组的同学利用下图装置研究铜与稀硝酸的反应。
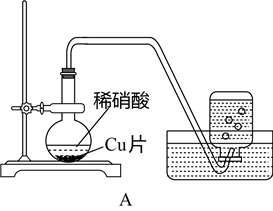
(1)铜与稀硝酸反应的离子方程式________________________________________ 。
(2)实验过程中水槽中的集气瓶收集到无色气体,甲同学由此认为铜与稀硝酸反应生成了NO。乙同学认为上述理由不完备,原因是________________________________________ (用化学方程式表示)。
(3)同学们经过讨论,决定改用装置B进行反应,实验步骤①~③如下图所示。

步骤③拔去注射器的橡胶帽,拉动活塞吸入少量的空气后,迅速盖上橡胶帽。如果观察到____________________ 的现象,就能证明铜与稀硝酸反应生成了NO。

(1)铜与稀硝酸反应的离子方程式
(2)实验过程中水槽中的集气瓶收集到无色气体,甲同学由此认为铜与稀硝酸反应生成了NO。乙同学认为上述理由不完备,原因是
(3)同学们经过讨论,决定改用装置B进行反应,实验步骤①~③如下图所示。

步骤③拔去注射器的橡胶帽,拉动活塞吸入少量的空气后,迅速盖上橡胶帽。如果观察到
您最近一年使用:0次



