10-11高三上·江西南昌·阶段练习
名校
1 . 在100mL混合溶液中,HNO3和H2SO4物质的量浓度分别为0.4mol·L-1和0.1mol·L-1,向该溶液中加入1.92g铜粉,待充分反应后,所得溶液中Cu2+物质的量浓度(mol·L-1)为(溶液体积变化忽略不计)
| A.0.3 | B.0.225 | C.0.6 | D.0.45 |
您最近一年使用:0次
2023-05-10更新
|
756次组卷
|
57卷引用:北京市第五中学2021-2022学年高一下学期期中考试化学试题
北京市第五中学2021-2022学年高一下学期期中考试化学试题湖北省宜昌市示范高中协作体2016-2017学年高一下学期期中联考化学试题福建省莆田市第一中学2016-2017学年高一下学期期中考试化学试题河北省邯郸市馆陶县第一中学2019-2020学年高一下学期期中考试化学试卷安徽省马鞍山市和县2020-2021学年高一上学期期中联考化学试题吉林省“BEST合作体”2020-2021学年高一下学期期中化学试题(已下线)【浙江新东方】在线化学93高一下广东省广州市第六中学2021-2022学年高一下学期期中考试化学试题广东省广州市第六中学2021-2022学年高一下学期期中考试化学试题吉林省长春市第二实验中学 2021-2022 学年高一下学期期中考试化学试题(已下线)【2022】【高一下】【长河】【期中考】【高中化学】【张明涛收集】辽宁省 大连育明高级中学2022-2023学年高一下学期期中考试化学试题(已下线)2011届江西省南昌市铁路一中高三12月月考化学试卷(已下线)2011届安徽省阜阳三中高三上学期期末考试化学试卷(已下线)2011-2012学年天津市耀华中学高一上学期期末考试化学试卷(已下线)2012届陕西省西安中学高三第三次月考化学试卷(已下线)2012年苏教版高中化学必修1 4.2生产生活中的含氮化合物练习卷(已下线)2014-2015学年湖南省衡阳八中高三上学期第二次月考化学试卷(已下线)2015届山东省莱州市第一中学高三10月月考化学试卷(已下线)2015届山东省莱州市一中高三10月月考化学试卷2015届陕西省宝鸡中学高三上学期12月月考理综化学试卷(A)2015-2016学年黑龙江大庆实验中学高二下期末化学试卷2016-2017学年山东省济南市历城区第二中学高一下学期开学考试化学试卷2016-2017学年四川省绵阳南山中学高一下学期3月月考化学试卷河北省邢台市第一中学2017-2018学年高一下学期开学考试化学试题内蒙古杭锦后旗奋斗中学2017-2018学年高一下学期第一次月考化学试题黑龙江省哈尔滨市第三中学2017-2018学年高一下学期第一次月考化学试题内蒙古鄂尔多斯市第一中学2017-2018学年高一下学期第一次月考化学试题山东省莒县第一中学2018-2019学年高一上学期12月月考化学试题新疆维吾尔自治区生产建设兵团第一师高级中学2018-2019学年高一上学期期末考试化学试题云南省玉溪市江川区第二中学2018-2019学年高一下学期开学考试化学试题河南省郑州第四十七中2019-2020学年高一上学期第二次月考化学试题2020届高三化学二轮冲刺新题专练——金属及金属化合物的性质(选择专练)人教版(2019)必修第二册第五章第二节 易错疑难集训重庆市育才中学2019-2020学年高一下学期3月月考化学试题四川省绵阳南山中学实验学校2019-2020学年高一下学期开学考试化学试题黑龙江省海林市朝鲜族中学2019-2020学年高二下学期期末考试化学试题湖南省长沙市雨花区2017-2018学年高一下学期期末考试化学试题鲁科版(2019)高一必修第一册第三章易错疑难集训(三)必修第二册RJ第5章第二节 氮及其化合物 易错疑难集训(二)(已下线)小题必刷20 氮及其化合物——2021年高考化学一轮复习小题必刷(通用版)山西省实验中学2019届高三上学期第二次月考化学试题(已下线)【浙江新东方】高中化学20210429—009【2021】【高一下】黑龙江省牡丹江市海林市朝鲜族中学 2020-2021学年高二5月月考化学试题(苏教版2019)必修第二册专题7 氮与社会可持续发展 易错疑难集训黑龙江省绥化市肇东四中2020-2021学年高一下学期期末考试化学试题甘肃省嘉峪关市第一中学2021届高三上学期三模考试化学试题(已下线)【苏州新东方】园区星海2020-2021学年高一下学期月考上海市实验学校2021-2022学年高三下学期4月月考化学试题浙江省舟山市普陀中学2023届高三返校考试化学试题浙江省舟山市舟山中学2022-2023学年国庆返校检测高三化学试题(已下线)题型62 金属与HNO3反应的规律和相关计算湖南省永州市东安县第一中学2022-2023学年高一下学期开年摸底联考化学试题山西省大同市第一中学2022-2023学年高一下学期3月考试化学试题四川省眉山市仁寿县第一中学2022-2023学年高一下学期3月月考化学试题四川省仁寿第一中学校南校区2022-2023学年高一下学期3月月考化学试题河南省商丘市第一高级中学2022-2023学年高二下学期期末考试化学试题
解题方法
2 . 某学习小组探究铜与稀 、浓
、浓 的反应。
的反应。
(1)Ⅰ中 与稀
与稀 反应的化学方程式是
反应的化学方程式是___________ 。
(2)Ⅱ中反应的速率比Ⅰ中快的原因是___________ 。
(3)针对Ⅱ中“溶液呈绿色”的原因,小组同学提出假设,并进行实验探究
假设1:___________ ;
假设2: 的浓度较大所致。
的浓度较大所致。
探究如下:取Ⅱ中绿色溶液,分为两等份。
①甲同学取一份溶液于下图所示试管中,___________ (填“实验现象”),证实假设1成立。
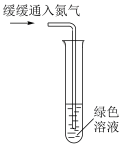
②乙同学向另一份溶液中加水稀释,溶液变为蓝色。乙同学的操作___________ (填“能”或“否”)证实假设2成立,结合化学用语说明理由___________ 。
(4)为了进一步解释Ⅰ和Ⅱ现象不同的原因,小组同学查阅资料:浓 氧化性强于稀
氧化性强于稀 。小组同学推测浓
。小组同学推测浓 能将
能将 氧化成
氧化成 ,稀
,稀 不能氧化
不能氧化 。并设计如下实验(实验前封闭装置内空气已除净)。
。并设计如下实验(实验前封闭装置内空气已除净)。
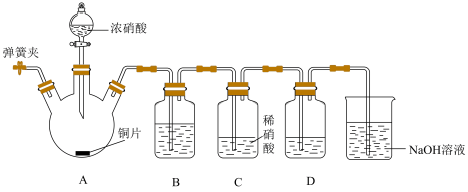
①装置B的作用是___________ 。
②装置D中盛放 和
和___________ 。
③小组同学若要证实推测成立,预计的实验现象是___________ 。
 、浓
、浓 的反应。
的反应。| 装置(尾气处理装置略) | 现象 |
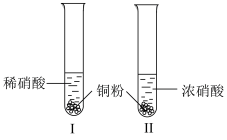 | Ⅰ中开始无明显现象,随后有小气泡生成,越来越剧烈,液面上方出现浅红棕色气体,溶液呈蓝色。 |
| Ⅱ中反应剧烈,迅速生成大量红棕色气体,溶液呈绿色。 |
 与稀
与稀 反应的化学方程式是
反应的化学方程式是(2)Ⅱ中反应的速率比Ⅰ中快的原因是
(3)针对Ⅱ中“溶液呈绿色”的原因,小组同学提出假设,并进行实验探究
假设1:
假设2:
 的浓度较大所致。
的浓度较大所致。探究如下:取Ⅱ中绿色溶液,分为两等份。
①甲同学取一份溶液于下图所示试管中,

②乙同学向另一份溶液中加水稀释,溶液变为蓝色。乙同学的操作
(4)为了进一步解释Ⅰ和Ⅱ现象不同的原因,小组同学查阅资料:浓
 氧化性强于稀
氧化性强于稀 。小组同学推测浓
。小组同学推测浓 能将
能将 氧化成
氧化成 ,稀
,稀 不能氧化
不能氧化 。并设计如下实验(实验前封闭装置内空气已除净)。
。并设计如下实验(实验前封闭装置内空气已除净)。
①装置B的作用是
②装置D中盛放
 和
和③小组同学若要证实推测成立,预计的实验现象是
您最近一年使用:0次
解题方法
3 . 某小组同学用如下图所示装置进行铜与浓硫酸的反应,并探究产物的性质(气密性已检验、夹持装置已略去)。
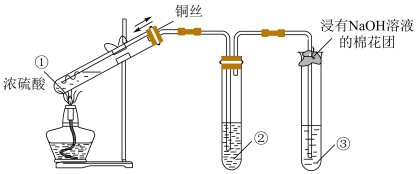
(1)试管①中反应的化学方程式是___________ ;浓硫酸表现出的性质是___________ 、___________ 。
(2)若试管②中的试剂为品红溶液,实验中观察到的现象是___________ ;若试管②中的试剂为酸性 溶液,实验时②中溶液褪色,则说明①中生成的气体具有
溶液,实验时②中溶液褪色,则说明①中生成的气体具有___________ 性;若试管②中的试剂为 溶液,实验中观察到的现象是
溶液,实验中观察到的现象是___________ ,从化合价和物质性质的角度分析该反应发生的原因___________ 。
(3)试管③中的试剂为 溶液,其作用是吸收尾气,反应的离子方程式是
溶液,其作用是吸收尾气,反应的离子方程式是___________ 。
(4)为确认试管①中含铜物质的生成,小组同学需要进行的实验操作 是___________ 。

(1)试管①中反应的化学方程式是
(2)若试管②中的试剂为品红溶液,实验中观察到的现象是
 溶液,实验时②中溶液褪色,则说明①中生成的气体具有
溶液,实验时②中溶液褪色,则说明①中生成的气体具有 溶液,实验中观察到的现象是
溶液,实验中观察到的现象是(3)试管③中的试剂为
 溶液,其作用是吸收尾气,反应的离子方程式是
溶液,其作用是吸收尾气,反应的离子方程式是(4)为确认试管①中含铜物质的生成,小组同学需要进行的实验
您最近一年使用:0次
解题方法
4 . 下列反应的离子方程式或化学方程式不正确 的是
A.硝酸银溶液与盐酸反应: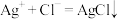 |
B.浓硝酸见光分解: |
C.铜与稀硝酸反应: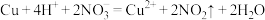 |
D.浓硫酸与红热的木炭反应: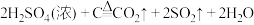 |
您最近一年使用:0次
名校
5 . 根据如图所示装置进行实验,能得到相应结论的是。
| 试剂a、b | 现象 | 结论 | 装置 | |
| A |  、稀 、稀 | 产生的无色气体在导管口变红棕色 |  和稀 和稀 反应生成 反应生成 |
|
| B | 漂白粉、浓 | 导管口放置的湿润蓝色石蕊试纸先变红后褪色。 | 漂白粉和浓 反应生成 反应生成 | |
| C |  、75%酒精溶液 、75%酒精溶液 | 收集产生的气体,移近火焰,发出爆鸣声 |  和 和 反应生成 反应生成 | |
| D | 电石、饱和食盐水 | 产生的气体使酸性高锰酸钾溶液褪色 | 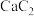 和 和 反应生成 反应生成 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-04-06更新
|
459次组卷
|
4卷引用:北京市海淀区2022-2023学年高三下学期期中练习化学试题
名校
解题方法
6 . 下列关于铜腐蚀的说法及方程式书写正确的是
A.铜在潮湿空气中被腐蚀: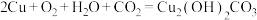 |
B.铜在 环境中被腐蚀: 环境中被腐蚀: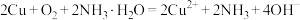 |
C. 浓度越大,腐蚀反应 浓度越大,腐蚀反应 速率越大 速率越大 |
D.利用 对铜的腐蚀制作印刷线路板: 对铜的腐蚀制作印刷线路板: |
您最近一年使用:0次
2023-03-30更新
|
631次组卷
|
4卷引用:北京市第五中学2023-2024学年高三上学期期中考试化学试题
名校
解题方法
7 . 在标准状况下将3.2g铜粉投入一定量浓 中,随着铜粉的溶解,反应生成的气体颜色逐渐变浅,当铜粉完全溶解后共收集到由
中,随着铜粉的溶解,反应生成的气体颜色逐渐变浅,当铜粉完全溶解后共收集到由 和NO组成的混合气体1.344L(已转化为标况下的体积),则混合气体中NO的体积为
和NO组成的混合气体1.344L(已转化为标况下的体积),则混合气体中NO的体积为
 中,随着铜粉的溶解,反应生成的气体颜色逐渐变浅,当铜粉完全溶解后共收集到由
中,随着铜粉的溶解,反应生成的气体颜色逐渐变浅,当铜粉完全溶解后共收集到由 和NO组成的混合气体1.344L(已转化为标况下的体积),则混合气体中NO的体积为
和NO组成的混合气体1.344L(已转化为标况下的体积),则混合气体中NO的体积为| A.112mL | B.224mL | C.448mL | D.1008mL |
您最近一年使用:0次
2023-03-21更新
|
444次组卷
|
8卷引用:北京师范大学附属中学2020-2021学年高一下学期期中考试化学(选考班)试题
北京师范大学附属中学2020-2021学年高一下学期期中考试化学(选考班)试题北京师范大学附属中学2021-2022学年高一下学期期中考试化学试题北京师范大学附属中学2022-2023学年高一下学期期中考试化学试题(已下线)专题01 金属及其化合物(知识串讲+专题过关)-2022-2023学年高一化学下学期期中期末考点大串讲(沪科版2020必修第二册)(已下线)期中模拟题(一)-2022-2023学年高一化学下学期期中期末考点大串讲(沪科版2020必修第二册)北京市东直门中学2023-2024学年高一下学期3月学情监测化学试题江西省南昌市第十中学2022—2023学年高一下学期第一次月考化学试题天津市滨海新区塘沽第一中学2023-2024学年高一下学期第一次月考化学试卷
名校
解题方法
8 . 对于1 L  和
和 的混合溶液,若
的混合溶液,若 和
和 物质的量浓度存在如下关系:
物质的量浓度存在如下关系: ,理论上最多能溶解铜的物质的量为
,理论上最多能溶解铜的物质的量为
 和
和 的混合溶液,若
的混合溶液,若 和
和 物质的量浓度存在如下关系:
物质的量浓度存在如下关系: ,理论上最多能溶解铜的物质的量为
,理论上最多能溶解铜的物质的量为| A.0.9 mol | B.0.8 mol | C.0.45 mol | D.0.40 mol |
您最近一年使用:0次
9 . 用如下方法回收废旧CPU中的单质Au(金)、Ag和Cu。
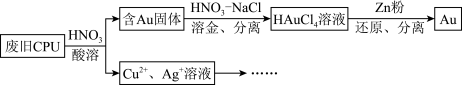
已知:①浓硝酸不能单独将Au溶解。
② 。
。
(1)酸溶后经_______ 操作,将混合物分离。
(2)浓、稀HNO3均可作酸溶试剂,浓硝酸被还原成NO2,稀硝酸被还原成NO。溶解等量的Cu消耗HNO3的物质的量不同,写出消耗HNO3物质的量少的反应的化学方程式:_______ 。
(3)HNO3-NaCl与王水[V(浓硝酸):V(浓盐酸)=1∶3]溶金原理相同,Cl-与Au3+形成配离子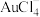 ,促进了金溶解。
,促进了金溶解。
①将溶金反应的化学方程式补充完整:_______ 。
 _______
_______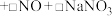
②关于溶金的下列说法正确的是_______ 。
A.用到了HNO3的氧化性
B.王水中浓盐酸的主要作用是增强溶液的酸性
C.用浓盐酸与NaNO3也可使Au溶解
(4)若用Zn粉将溶液中的1 mol HAuCl4完全还原,则参加反应的Zn的物质的量是_____ mol。
(5)用适当浓度的盐酸、NaCl溶液、氨水与铁粉,可按照如下方法从酸溶后的溶液中回收Cu和Ag(图中标注的试剂和物质均不同)。
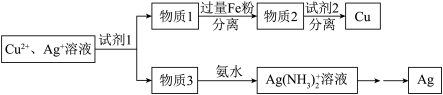
试剂1是_______ ,物质2是_______ ,物质3是_______ 。

已知:①浓硝酸不能单独将Au溶解。
②
 。
。(1)酸溶后经
(2)浓、稀HNO3均可作酸溶试剂,浓硝酸被还原成NO2,稀硝酸被还原成NO。溶解等量的Cu消耗HNO3的物质的量不同,写出消耗HNO3物质的量少的反应的化学方程式:
(3)HNO3-NaCl与王水[V(浓硝酸):V(浓盐酸)=1∶3]溶金原理相同,Cl-与Au3+形成配离子
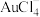 ,促进了金溶解。
,促进了金溶解。①将溶金反应的化学方程式补充完整:
 _______
_______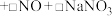
②关于溶金的下列说法正确的是
A.用到了HNO3的氧化性
B.王水中浓盐酸的主要作用是增强溶液的酸性
C.用浓盐酸与NaNO3也可使Au溶解
(4)若用Zn粉将溶液中的1 mol HAuCl4完全还原,则参加反应的Zn的物质的量是
(5)用适当浓度的盐酸、NaCl溶液、氨水与铁粉,可按照如下方法从酸溶后的溶液中回收Cu和Ag(图中标注的试剂和物质均不同)。

试剂1是
您最近一年使用:0次
10 . 用如图方法回收废旧CPU中的单质Au(金),Ag和Cu。
(1)酸溶后经_______ 操作,将混合物分离。
(2)浓、稀 均可作酸溶试剂。溶解等量的Cu消耗
均可作酸溶试剂。溶解等量的Cu消耗 的物质的量不同,写出消耗
的物质的量不同,写出消耗 物质的量少的反应的化学方程式:
物质的量少的反应的化学方程式:_______ 。
(3)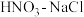 与王水[V(浓硝酸)∶V(浓盐酸)=1∶3]溶金原理相同。
与王水[V(浓硝酸)∶V(浓盐酸)=1∶3]溶金原理相同。
①将溶金反应的化学方程式补充完整:_________________ 。

②关于溶金的下列说法正确的是_______ 。
A.用到了HNO3的氧化性
B.王水中浓盐酸的主要作用是增强溶液的酸性
C.用浓盐酸与NaNO3也可使Au溶解
(4)若用Zn粉将溶液中的1 mol HAuCl4完全还原,则参加反应的Zn的物质的量是____ mol。
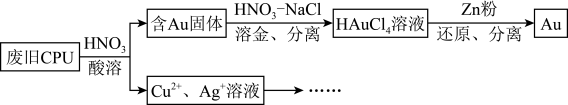

(1)酸溶后经
(2)浓、稀
 均可作酸溶试剂。溶解等量的Cu消耗
均可作酸溶试剂。溶解等量的Cu消耗 的物质的量不同,写出消耗
的物质的量不同,写出消耗 物质的量少的反应的化学方程式:
物质的量少的反应的化学方程式:(3)
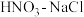 与王水[V(浓硝酸)∶V(浓盐酸)=1∶3]溶金原理相同。
与王水[V(浓硝酸)∶V(浓盐酸)=1∶3]溶金原理相同。①将溶金反应的化学方程式补充完整:

②关于溶金的下列说法正确的是
A.用到了HNO3的氧化性
B.王水中浓盐酸的主要作用是增强溶液的酸性
C.用浓盐酸与NaNO3也可使Au溶解
(4)若用Zn粉将溶液中的1 mol HAuCl4完全还原,则参加反应的Zn的物质的量是
您最近一年使用:0次
2022-05-27更新
|
342次组卷
|
3卷引用:北京市第一六一中学2021-2022学年高一下学期期中阶段(选考班)化学试题