名校
1 . 2022年1月24日,习近平总书记在十九届中共中央政治局第三十六次集中学习时强调,实现碳达峰碳中和是贯彻新发展理念、构建新发展格局、推动高质量发展的内在要求。因此,二氧化碳的合理利用成为研究热点。
研究证明,CO2可作为合成低碳烯烃的原料,目前利用CO2合成乙烯相关的热化学方程式如下:
反应i:CO2(g)+3H2(g)═CH3OH(g)+H2O(g) △H1═﹣49.0kJ•mol﹣1
反应ii:2CH3OH═CH3OCH3(g)+H2O(g) △H2=﹣24.52kJ•mol﹣1
反应iii:CH3OCH3═C2H4(g)+H2O(g) △H3=﹣5.46kJ•mol﹣1
反应iv:2CO2(g)+6H2(g)═C2H4(g)+4H2O(g) △H4
(1)反应i为反应_______ (填“放热”或“吸热”),能正确表示该反应的图示是_______ (填标号)。

(2)二甲醚(CH3OCH3)被誉为“21世纪的清洁燃料,以CO2、H2为原料制备二甲醚涉及的主要反应如下:
I.2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g) ΔH1=﹣122.5kJ/mol
II.CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH2=+41.1kJ/mol
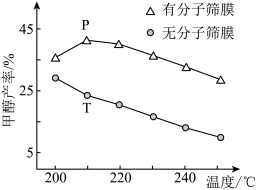
①在压强、CO2和H2的起始投料一定的条件下,发生反应I、II,实验测得CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图所示。(已知:CH3OCH3的选择性=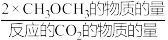 ×100%)
×100%)

其中表示平衡时CH3OCH3的选择性的曲线是_______ (填“①”或“②”);温度高于300℃时,曲线②随温度升高而升高的原因是_______ 。
②对于反应II的反应速率v=v正﹣v逆=k正p(CO2)•p(H2)﹣k逆p(CO)•p(H2O),其中k正、k逆分别为正、逆反应速率常数,p为气体的分压(分压=总压×物质的量分数)。
a.降低温度,k正﹣k逆_______ (填“增大”、“减小”或”不变”);
b.在一定温度和压强下的反应II,按照n(H2):n(CO2)=1:1投料,CO2转化率为50%时,v(正):v(逆)=3:4,用气体分压表示的平衡常数Kp=_______ 。
(3)用H2还原CO2可以合成CH3OH:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)。恒压下,CO2和H2的起始物质的量之比为1:3时,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜(能选择性分离出H2O)时甲醇的产率随温度的变化如图所示。P点甲醇产率高于T点的原因为_______ 。
研究证明,CO2可作为合成低碳烯烃的原料,目前利用CO2合成乙烯相关的热化学方程式如下:
反应i:CO2(g)+3H2(g)═CH3OH(g)+H2O(g) △H1═﹣49.0kJ•mol﹣1
反应ii:2CH3OH═CH3OCH3(g)+H2O(g) △H2=﹣24.52kJ•mol﹣1
反应iii:CH3OCH3═C2H4(g)+H2O(g) △H3=﹣5.46kJ•mol﹣1
反应iv:2CO2(g)+6H2(g)═C2H4(g)+4H2O(g) △H4
(1)反应i为反应

(2)二甲醚(CH3OCH3)被誉为“21世纪的清洁燃料,以CO2、H2为原料制备二甲醚涉及的主要反应如下:
I.2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g) ΔH1=﹣122.5kJ/mol
II.CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH2=+41.1kJ/mol
①在压强、CO2和H2的起始投料一定的条件下,发生反应I、II,实验测得CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图所示。(已知:CH3OCH3的选择性=
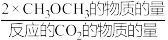 ×100%)
×100%)
其中表示平衡时CH3OCH3的选择性的曲线是
②对于反应II的反应速率v=v正﹣v逆=k正p(CO2)•p(H2)﹣k逆p(CO)•p(H2O),其中k正、k逆分别为正、逆反应速率常数,p为气体的分压(分压=总压×物质的量分数)。
a.降低温度,k正﹣k逆
b.在一定温度和压强下的反应II,按照n(H2):n(CO2)=1:1投料,CO2转化率为50%时,v(正):v(逆)=3:4,用气体分压表示的平衡常数Kp=
(3)用H2还原CO2可以合成CH3OH:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)。恒压下,CO2和H2的起始物质的量之比为1:3时,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜(能选择性分离出H2O)时甲醇的产率随温度的变化如图所示。P点甲醇产率高于T点的原因为

您最近一年使用:0次
名校
解题方法
2 . “低碳经济”已成为全世界科学家研究的重要课题。为减小和消除 对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对
对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对 创新利用的研究。
创新利用的研究。
(1)已知:①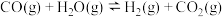

②

③

写出 与
与 反应生成
反应生成 和
和 的热化学方程式:
的热化学方程式:_______ 。
(2)目前工业上有一种方法是用 来生产燃料甲醇。为探究该反应原理,在容积为2 L的密闭容器中,充入
来生产燃料甲醇。为探究该反应原理,在容积为2 L的密闭容器中,充入
 和
和
 在一定条件下发生反应,测得
在一定条件下发生反应,测得 、
、 和
和 的物质的量(n)随时间的变化如图所示:
的物质的量(n)随时间的变化如图所示:

①从反应开始到平衡, 的平均反应速率
的平均反应速率
_______ 。
②下列措施能使 的转化率增大的是
的转化率增大的是_______ (选填编号)。
A.在原容器中再充入

B.在原容器中再充入

C.在原容器中再充入 氦气
氦气
D.使用更有效的催化剂
E.缩小容器的容积
F.将水蒸气从体系中分离
(3)煤化工通常研究不同条件下CO转化率以解决实际问题。已知在催化剂存在条件下反应: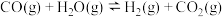 中CO的平衡转化率随
中CO的平衡转化率随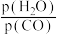 及温度变化关系如图所示:
及温度变化关系如图所示:

①上述反应的逆反应方向是_______ 反应(填“吸热”或“放热”);
②对于气相反应,用某组分(B)的平衡分压( )代替平衡浓度(
)代替平衡浓度( )也可以表示平衡常数(记作
)也可以表示平衡常数(记作 ),则该反应的
),则该反应的 的表达式为
的表达式为_______ ,提高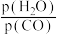 ,则
,则
_______ (填“变大”、“变小”或“不变”)。使用铁镁催化剂的实际工业流程中,一般采用400℃左右,采用此温度条件的原因可能是_______ 。
 对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对
对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对 创新利用的研究。
创新利用的研究。(1)已知:①
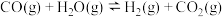

②


③


写出
 与
与 反应生成
反应生成 和
和 的热化学方程式:
的热化学方程式:(2)目前工业上有一种方法是用
 来生产燃料甲醇。为探究该反应原理,在容积为2 L的密闭容器中,充入
来生产燃料甲醇。为探究该反应原理,在容积为2 L的密闭容器中,充入
 和
和
 在一定条件下发生反应,测得
在一定条件下发生反应,测得 、
、 和
和 的物质的量(n)随时间的变化如图所示:
的物质的量(n)随时间的变化如图所示:
①从反应开始到平衡,
 的平均反应速率
的平均反应速率
②下列措施能使
 的转化率增大的是
的转化率增大的是A.在原容器中再充入


B.在原容器中再充入


C.在原容器中再充入
 氦气
氦气D.使用更有效的催化剂
E.缩小容器的容积
F.将水蒸气从体系中分离
(3)煤化工通常研究不同条件下CO转化率以解决实际问题。已知在催化剂存在条件下反应:
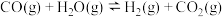 中CO的平衡转化率随
中CO的平衡转化率随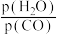 及温度变化关系如图所示:
及温度变化关系如图所示:
①上述反应的逆反应方向是
②对于气相反应,用某组分(B)的平衡分压(
 )代替平衡浓度(
)代替平衡浓度( )也可以表示平衡常数(记作
)也可以表示平衡常数(记作 ),则该反应的
),则该反应的 的表达式为
的表达式为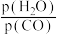 ,则
,则
您最近一年使用:0次
2023-01-14更新
|
419次组卷
|
2卷引用:宁夏六盘山高级中学2022-2023学年高三上学期期末考试化学试题
名校
解题方法
3 . CO2的的回收及综合利用越来越受到国际社会的重视,将CO2转化为高附加值化学品已成为有吸引力的解决方案。
例如可以用CO2、H2为原料合成CH3OH反应:CO2(g) + 3H2(g)=CH3OH(g) + H2O(g) ΔH
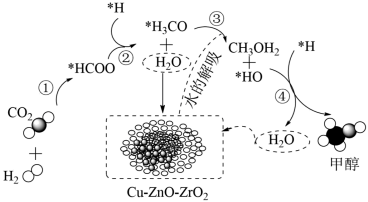
(1)CO2和H2在某催化剂表面上合成甲醇的反应历程如图所示,其中吸附在催化剂表面上的物种用*标注。
反应的ΔH_____ 0(填“>”或“<”):该历程中最小能垒(活化能)步骤的化学方程式为___________
(2)CO2加氢制甲醇也可在Cu-ZnO-ZrO2催化剂表面进行,其反应历程如图所示(催化剂表面吸附的物种用*标注),下列说法正确的是___________。
(3)在K℃下,分别将0.20 mol CO2、0.40 mol H2充入2 L和1 L的2个刚性容器中,发生反应:CO2(g)+2H2(g)  C(s)+2H2O(g)
C(s)+2H2O(g)  。实验测得CO2的体积分数随时间变化如图所示:
。实验测得CO2的体积分数随时间变化如图所示:

①比较a、d两点对应的v(CO2)大小:va(正)___________ vd(逆)(填“大于”“小于”或“等于”),反应从开始进行到d点,用 浓度变化表示的反应速率为v(H2)=
浓度变化表示的反应速率为v(H2)=__________ mol·L-1·min-1。
②在温度一定,压强P0 MPa时,在2 L密闭容器中按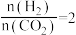 投料进行反应,达到平衡时体系的压强为初始压强的0.8倍,该温度下反应平衡常数Kp=
投料进行反应,达到平衡时体系的压强为初始压强的0.8倍,该温度下反应平衡常数Kp=___________ 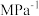 (用含P0的表达式表示,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(用含P0的表达式表示,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
例如可以用CO2、H2为原料合成CH3OH反应:CO2(g) + 3H2(g)=CH3OH(g) + H2O(g) ΔH
(1)CO2和H2在某催化剂表面上合成甲醇的反应历程如图所示,其中吸附在催化剂表面上的物种用*标注。

反应的ΔH
(2)CO2加氢制甲醇也可在Cu-ZnO-ZrO2催化剂表面进行,其反应历程如图所示(催化剂表面吸附的物种用*标注),下列说法正确的是___________。

| A.若该方法实现工业生产,气体以一定流速通过Cu-ZnO-ZrO2,催化剂对反应物的转化率无影响 |
| B.催化剂可以降低反应活化能和反应热 |
| C.反应②中存在共价键的断裂和共价键的形成 |
| D.水的吸附和解吸在整个反应过程中实现了循环利用,原子利用率为100% |
 C(s)+2H2O(g)
C(s)+2H2O(g)  。实验测得CO2的体积分数随时间变化如图所示:
。实验测得CO2的体积分数随时间变化如图所示:
①比较a、d两点对应的v(CO2)大小:va(正)
 浓度变化表示的反应速率为v(H2)=
浓度变化表示的反应速率为v(H2)=②在温度一定,压强P0 MPa时,在2 L密闭容器中按
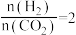 投料进行反应,达到平衡时体系的压强为初始压强的0.8倍,该温度下反应平衡常数Kp=
投料进行反应,达到平衡时体系的压强为初始压强的0.8倍,该温度下反应平衡常数Kp=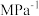 (用含P0的表达式表示,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(用含P0的表达式表示,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
您最近一年使用:0次
2022-11-21更新
|
287次组卷
|
2卷引用:宁夏回族自治区银川一中2022-2023学年高二上学期期中考试化学试题
名校
4 . 氮及其化合物的研究对于生态环境保护和工农业生产发展非常重要。请回答下列问题:
(1)煤燃烧产生的烟气中含有氮的氧化物NOx,用CH4催化还原NOx可消除氮氧化物的污染。
已知:
①CH4(g)+ 2NO2(g)= N2(g)+CO2(g)+ 2H2O(g) △H=-865.0 kJ·mol-l
②2NO(g)+O2(g)= 2NO2(g) △H=-112.5 kJ·mol-1
③适量的N2和O2完全反应,每生成2.24 L(标准状况下)NO时,吸收8.9 kJ的热量。
则CH4(g)+4NO(g)= 2N2(g)+ CO2(g)+ 2H2O(g)△H=___________ kJ·mol-1
(2)已知合成氨反应N2(g)+ 3H2(g) 2NH3(g) △H= -92 kJ·mol-l,科研小组模拟不同条件下的合成氨反应,向刚性容器中充入10.0 mol N2和20.0 molH2,不同温度下平衡混合物中氨气的体积分数与总压强(p)的关系如图,T1、T2、T3由小到大的排序为
2NH3(g) △H= -92 kJ·mol-l,科研小组模拟不同条件下的合成氨反应,向刚性容器中充入10.0 mol N2和20.0 molH2,不同温度下平衡混合物中氨气的体积分数与总压强(p)的关系如图,T1、T2、T3由小到大的排序为___________ ;在T2、50MPa条件下,A点v正___________ v逆(填“>”“<”或“=”);在温度T2压强50MPa时,平衡常数Kp=___________ MPa-2(列出表达式,分压=总压×物质的量分数)。

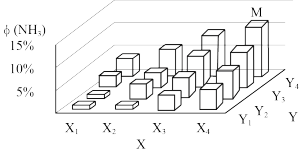
(3)将1mol的N2和3mol的H2通入密闭容器中进行反应,在一定温度和压强下达到平衡时氨气的体积分数ϕ (NH3)的变化趋势如图所示(其中X1→X4逐渐减小,Y1→Y4逐渐增大):图中X轴表示的外界条件为___________ ,判断的理由是____ 。
(4)利用反应6NO2 + 8NH3 = 7N2+ 12H2O构成电池,能实现有效消除氮氧化物的排放,减轻环境污染,装置如下图所示:

写出电极B的电极反应式:___________ 。
(1)煤燃烧产生的烟气中含有氮的氧化物NOx,用CH4催化还原NOx可消除氮氧化物的污染。
已知:
①CH4(g)+ 2NO2(g)= N2(g)+CO2(g)+ 2H2O(g) △H=-865.0 kJ·mol-l
②2NO(g)+O2(g)= 2NO2(g) △H=-112.5 kJ·mol-1
③适量的N2和O2完全反应,每生成2.24 L(标准状况下)NO时,吸收8.9 kJ的热量。
则CH4(g)+4NO(g)= 2N2(g)+ CO2(g)+ 2H2O(g)△H=
(2)已知合成氨反应N2(g)+ 3H2(g)
 2NH3(g) △H= -92 kJ·mol-l,科研小组模拟不同条件下的合成氨反应,向刚性容器中充入10.0 mol N2和20.0 molH2,不同温度下平衡混合物中氨气的体积分数与总压强(p)的关系如图,T1、T2、T3由小到大的排序为
2NH3(g) △H= -92 kJ·mol-l,科研小组模拟不同条件下的合成氨反应,向刚性容器中充入10.0 mol N2和20.0 molH2,不同温度下平衡混合物中氨气的体积分数与总压强(p)的关系如图,T1、T2、T3由小到大的排序为
(3)将1mol的N2和3mol的H2通入密闭容器中进行反应,在一定温度和压强下达到平衡时氨气的体积分数ϕ (NH3)的变化趋势如图所示(其中X1→X4逐渐减小,Y1→Y4逐渐增大):图中X轴表示的外界条件为

(4)利用反应6NO2 + 8NH3 = 7N2+ 12H2O构成电池,能实现有效消除氮氧化物的排放,减轻环境污染,装置如下图所示:

写出电极B的电极反应式:
您最近一年使用:0次
5 . 氯胺是一种长效缓释水消毒剂,主要包括一氯胺、二氯胺和三氯胺 其作饮用水消毒剂是因为水解生成的HClO具有强烈杀菌作用,回答下列问题:
其作饮用水消毒剂是因为水解生成的HClO具有强烈杀菌作用,回答下列问题:
(1)二氯胺与水反应的化学方程式为________________________ 。
(2)工业上可利用
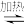
 ∆H制备一氯胺,已知该反应化学反应能量变化如图所示,则该反应的
∆H制备一氯胺,已知该反应化学反应能量变化如图所示,则该反应的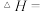
______________ 

(3)在密闭容器中反应
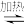
 ∆H达到平衡,据此反应通过热力学定律计算理论上
∆H达到平衡,据此反应通过热力学定律计算理论上 的体积分数随
的体积分数随 (氨氯比)的变化曲线如图所示。
(氨氯比)的变化曲线如图所示。

①a、b、c三点对应平衡常数 、
、 、
、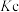 的大小关系为
的大小关系为_____________________ 理由是______________________ ;  温度下该反应的平衡常数为
温度下该反应的平衡常数为______________________________ (保留2位有效数字)。
②在 温度下,Q点对应的速率:
温度下,Q点对应的速率:
_____________________  (填“大于”“小于”或“等于”);
(填“大于”“小于”或“等于”);
③在 温度下,当
温度下,当 
______________________________ 时,平衡时  的体积分数最大;
的体积分数最大;
④若产物都是气体,实验测得 的体积分数始终比理论值低,原因可能是
的体积分数始终比理论值低,原因可能是_________________ 。
 其作饮用水消毒剂是因为水解生成的HClO具有强烈杀菌作用,回答下列问题:
其作饮用水消毒剂是因为水解生成的HClO具有强烈杀菌作用,回答下列问题:(1)二氯胺与水反应的化学方程式为
(2)工业上可利用

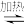
 ∆H制备一氯胺,已知该反应化学反应能量变化如图所示,则该反应的
∆H制备一氯胺,已知该反应化学反应能量变化如图所示,则该反应的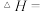


(3)在密闭容器中反应

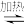
 ∆H达到平衡,据此反应通过热力学定律计算理论上
∆H达到平衡,据此反应通过热力学定律计算理论上 的体积分数随
的体积分数随 (氨氯比)的变化曲线如图所示。
(氨氯比)的变化曲线如图所示。
①a、b、c三点对应平衡常数
 、
、 、
、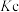 的大小关系为
的大小关系为 温度下该反应的平衡常数为
温度下该反应的平衡常数为②在
 温度下,Q点对应的速率:
温度下,Q点对应的速率:
 (填“大于”“小于”或“等于”);
(填“大于”“小于”或“等于”);③在
 温度下,当
温度下,当 
 的体积分数最大;
的体积分数最大;④若产物都是气体,实验测得
 的体积分数始终比理论值低,原因可能是
的体积分数始终比理论值低,原因可能是
您最近一年使用:0次
2022-06-03更新
|
242次组卷
|
2卷引用:宁夏回族自治区石嘴山市平罗中学2023届高三下学期第六次模拟考试理科综合化学试题
名校
解题方法
6 . 中科院天津工业生物所利用光伏发电,将电解水获得的H2与CO2反应合成甲醇,再由甲醇经若干酶促反应合成淀粉,首次在实验室实现二氧化碳到淀粉的从头合成。回答下列问题:
(1)该研究成果的重大意义是____ 。(答出一点即可)
(2)已知:在一定温度和压强下,由最稳定单质生成1mol化合物的焓变称为该物质的摩尔生成焓。某些化合物的摩尔生成焓如表所示。
反应I:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1
反应II:CO2(g)+H2(g) CO(g)+H2O(g) ΔH2
CO(g)+H2O(g) ΔH2
①反应I的焓变ΔH1=____ kJ∙mol-1。
②保持温度T不变,在一刚性密闭容器中,充入一定量的CO2和H2,同时发生反应I和II,起始及达平衡时,容器内各气体的物质的量如表所示。
已知起始时总压强为1.5pkPa,平衡时体系总压强为pkPa,则表中n1=____ ,反应I的平衡常数Kp=____ 。(含p的式子表示)
(3)取物质的量浓度为amol∙L-1的甲醇,选择不同的工程酶组块作为催化剂反应10h,测得实验数据如表所示。
①根据表中数据选取最佳的反应条件____ 。
②已知温度升高,反应生成的淀粉量先增加后急剧减少,其可能原因是____ 。
③实验4可用淀粉的质量浓度表示反应速率为____ g∙L-1∙h-1。淀粉的产率为____ 。(用含a的式子表示)
(1)该研究成果的重大意义是
(2)已知:在一定温度和压强下,由最稳定单质生成1mol化合物的焓变称为该物质的摩尔生成焓。某些化合物的摩尔生成焓如表所示。
| 化合物 | CO2(g) | CH3OH(g) | H2O(g) |
| 摩尔生成焓/(kJ∙mol-1) | -395 | -200 | -242 |
 CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1反应II:CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH2
CO(g)+H2O(g) ΔH2①反应I的焓变ΔH1=
②保持温度T不变,在一刚性密闭容器中,充入一定量的CO2和H2,同时发生反应I和II,起始及达平衡时,容器内各气体的物质的量如表所示。
| CO2 | H2 | CH3OH | CO | H2O | |
| 起始量/mol | 4.0 | 8.0 | 0 | 0 | 0 |
| 平衡量/mol | n1 | 3.0 |
(3)取物质的量浓度为amol∙L-1的甲醇,选择不同的工程酶组块作为催化剂反应10h,测得实验数据如表所示。
| 实验序号 | 温度/K | 不同工程酶的组块 | 淀粉/(g∙L-1) |
| 1 | T1 | agp-M1 | 0.21 |
| 2 | T1 | agp-M2 | 0.38 |
| 3 | T2 | agp-M2 | 1.82 |
| 4 | T2 | agp-M3 | 1.24 |
②已知温度升高,反应生成的淀粉量先增加后急剧减少,其可能原因是
③实验4可用淀粉的质量浓度表示反应速率为
您最近一年使用:0次
2022-05-23更新
|
202次组卷
|
2卷引用:宁夏回族自治区银川一中2022届高三三模理科综合化学试题
名校
7 . 我国提出2060年前实现碳中和,降低大气中CO2含量是当今世界重要科研课题之一,以CO2为原料制备甲醇、尿素等能源物质具有较好的发展前景。问答下列问题:
(I)①CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1=-49.5 kJ·mol-1
CH3OH(g)+H2O(g) ΔH1=-49.5 kJ·mol-1
②CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+40.9 kJ·mol-1
CO(g)+H2O(g) ΔH2=+40.9 kJ·mol-1
③CO(g)+2H2(g) CH3OH(g) ΔH3
CH3OH(g) ΔH3
(1)反应①在_______ (填“高温”“低温”或“任何温度”)条件下能够自发进行。
(2)反应③的ΔH3=_______ 。
(II)将H2与CO2充入一密闭容器中,在一定条件下发生反应,CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得CO2的平衡转化率与温度、压强的关系如图所示。
CH3OH(g)+H2O(g),测得CO2的平衡转化率与温度、压强的关系如图所示。_______ 。
(4)X、Y、M、N四点对应的平衡常数从大到小的顺序是_______ (用字母X、Y、M、N表示)。
(Ⅲ)以CO2和NH3为原料合成尿素是利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g),在一定温度下的2L恒容容器中,充入原料气3molNH3和1molCO2,此时容器内总压强为pkPa;5min达到平衡,CO2的转化率为50%。
CO(NH2)2(s)+H2O(g),在一定温度下的2L恒容容器中,充入原料气3molNH3和1molCO2,此时容器内总压强为pkPa;5min达到平衡,CO2的转化率为50%。
(5)5min内NH3的平均反应速率为_______ 。
(6)该温度下,上述反应的平衡常数Kp=_______ (用平衡分压代替 平衡浓度计算,分压=总压×物质的量分数)。
(Ⅳ)碳捕捉技术的发展有利于实现CO2资源性利用。常温下,某次用氨水溶液捕捉空气中CO2,得到0.1mol/L且pH=8的NH4HCO3溶液。已知相应温度下Ka1(H2CO3)=4×10-7、Ka2(H2CO3)=5×10-11。
(7)下列有关离子浓度的关系式中,正确的是_______ (填字母)。
A.c( )+c(NH3·H2O)+c(H+)<c(
)+c(NH3·H2O)+c(H+)<c( )+c(
)+c( )+c(H2CO3)+c(OH-)
)+c(H2CO3)+c(OH-)
B.c( )+c(NH3·H2O)=c(
)+c(NH3·H2O)=c( )+c(H2CO3)
)+c(H2CO3)
C. c(H2CO3)-c( )-c(NH3·H2O)=9.9 ×10-7mol/L
)-c(NH3·H2O)=9.9 ×10-7mol/L
(8)c(H2CO3):c( )=
)=_______
(I)①CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH1=-49.5 kJ·mol-1
CH3OH(g)+H2O(g) ΔH1=-49.5 kJ·mol-1②CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH2=+40.9 kJ·mol-1
CO(g)+H2O(g) ΔH2=+40.9 kJ·mol-1③CO(g)+2H2(g)
 CH3OH(g) ΔH3
CH3OH(g) ΔH3(1)反应①在
(2)反应③的ΔH3=
(II)将H2与CO2充入一密闭容器中,在一定条件下发生反应,CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),测得CO2的平衡转化率与温度、压强的关系如图所示。
CH3OH(g)+H2O(g),测得CO2的平衡转化率与温度、压强的关系如图所示。
(4)X、Y、M、N四点对应的平衡常数从大到小的顺序是
(Ⅲ)以CO2和NH3为原料合成尿素是利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:2NH3(g)+CO2(g)
 CO(NH2)2(s)+H2O(g),在一定温度下的2L恒容容器中,充入原料气3molNH3和1molCO2,此时容器内总压强为pkPa;5min达到平衡,CO2的转化率为50%。
CO(NH2)2(s)+H2O(g),在一定温度下的2L恒容容器中,充入原料气3molNH3和1molCO2,此时容器内总压强为pkPa;5min达到平衡,CO2的转化率为50%。(5)5min内NH3的平均反应速率为
(6)该温度下,上述反应的平衡常数Kp=
(Ⅳ)碳捕捉技术的发展有利于实现CO2资源性利用。常温下,某次用氨水溶液捕捉空气中CO2,得到0.1mol/L且pH=8的NH4HCO3溶液。已知相应温度下Ka1(H2CO3)=4×10-7、Ka2(H2CO3)=5×10-11。
(7)下列有关离子浓度的关系式中,正确的是
A.c(
 )+c(NH3·H2O)+c(H+)<c(
)+c(NH3·H2O)+c(H+)<c( )+c(
)+c( )+c(H2CO3)+c(OH-)
)+c(H2CO3)+c(OH-) B.c(
 )+c(NH3·H2O)=c(
)+c(NH3·H2O)=c( )+c(H2CO3)
)+c(H2CO3)C. c(H2CO3)-c(
 )-c(NH3·H2O)=9.9 ×10-7mol/L
)-c(NH3·H2O)=9.9 ×10-7mol/L(8)c(H2CO3):c(
 )=
)=
您最近一年使用:0次
2022-05-19更新
|
1285次组卷
|
2卷引用:2024届宁夏银川市唐徕中学高三下学期三模理科综合试题-高中化学
名校
解题方法
8 . 中国科学家为实现“碳中和”目标而不断努力,以CO2为原料合成甲烷、乙醇等能源物质具有良好的发展前景。
(1)CO2在固体催化表面加氢合成甲烷过程中发生以下两个反应:
主反应:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g) ∆H1=-156.9kJ·mol-1
副反应:CO2(g)+H2(g)⇌CO(g)+H2O(g) ∆H2=+41.1kJ·mol-1
①已知2H2+O2(g)⇌2H2O(g) ∆H3=-483.6kJ·mol-1,1摩尔液态水完全汽化吸收热量44千焦,则CH4燃烧热∆H=_______ 。
②500℃时,向1L恒容密闭容器中充入4mol CO2和12mol H2,初始压强为p,20min时主、副反应都达到平衡状态,测得c(H2O)=5mol·L-1,体系压强为 p,则0~20min内,v(CH4)=
p,则0~20min内,v(CH4)=_______ mol·L-1·min-1,平衡时CH4选择性=_______ (CH4选择性=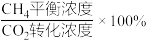 ,保留3位有效数字)。
,保留3位有效数字)。
(2)已知CO2催化加氢合成乙醇的反应为:2CO2(g)+6H2(g)⇌C2H5OH(g)+3H2O(g) ∆H<0,设m为起始时的投料比,即m=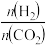 。
。
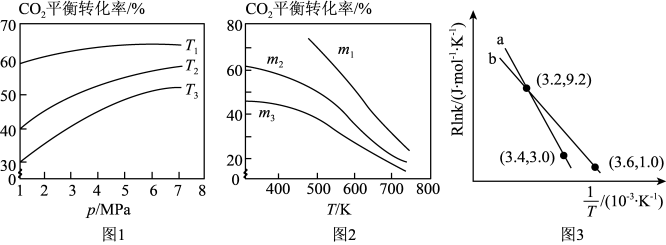
①图1中投料比相同,温度从高到低的顺序为_______ 。
②图2中m1、m2、m3从大到小的顺序为_______ 。
③该反应的Arrhenius经验公式的实验数据如图3中曲线a所示,已知Arhenius经验公式Rlnk=-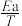 +C(Ea为活化能,k为速率常数,R和C为常数)。则该反应的活化能Ea=
+C(Ea为活化能,k为速率常数,R和C为常数)。则该反应的活化能Ea=_______ kJ·mol-1。当改变外界条件时,实验数据如图3中的曲线b所示,则实验可能改变的外界条件是_______ 。
(1)CO2在固体催化表面加氢合成甲烷过程中发生以下两个反应:
主反应:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g) ∆H1=-156.9kJ·mol-1
副反应:CO2(g)+H2(g)⇌CO(g)+H2O(g) ∆H2=+41.1kJ·mol-1
①已知2H2+O2(g)⇌2H2O(g) ∆H3=-483.6kJ·mol-1,1摩尔液态水完全汽化吸收热量44千焦,则CH4燃烧热∆H=
②500℃时,向1L恒容密闭容器中充入4mol CO2和12mol H2,初始压强为p,20min时主、副反应都达到平衡状态,测得c(H2O)=5mol·L-1,体系压强为
 p,则0~20min内,v(CH4)=
p,则0~20min内,v(CH4)=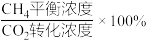 ,保留3位有效数字)。
,保留3位有效数字)。(2)已知CO2催化加氢合成乙醇的反应为:2CO2(g)+6H2(g)⇌C2H5OH(g)+3H2O(g) ∆H<0,设m为起始时的投料比,即m=
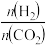 。
。
①图1中投料比相同,温度从高到低的顺序为
②图2中m1、m2、m3从大到小的顺序为
③该反应的Arrhenius经验公式的实验数据如图3中曲线a所示,已知Arhenius经验公式Rlnk=-
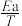 +C(Ea为活化能,k为速率常数,R和C为常数)。则该反应的活化能Ea=
+C(Ea为活化能,k为速率常数,R和C为常数)。则该反应的活化能Ea=
您最近一年使用:0次
2022-04-26更新
|
545次组卷
|
6卷引用:宁夏回族自治区银川一中2022届高三二模理科综合化学试题
宁夏回族自治区银川一中2022届高三二模理科综合化学试题山东省泰安市2021-2022学年高三下学期3月一模考试化学试题(已下线)必刷卷02-2022年高考化学考前信息必刷卷(山东专用)湖南省湖南师范大学附属中学2021-2022学年高三下学期第十次月考(三模,5月)化学试题湖南省株洲市攸县第三中学2022-2023学年高三上学期第一次月考化学试题(已下线)专题05 反应原理专题-【大题精做】冲刺2023年高考化学大题突破+限时集训(新高考专用)
9 . CO2是目前大气中含量最高的一种温室气体,中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40-50% CO2的综合利用是解决温室问题的有效途径。
(1)研究表明CO2和H2在催化剂存在下可发生反应生成CH3OH已知部分反应的热化学方程式如下:
CH3OH(g)+ O2(g)=CO2(g)+2H2O(g) ΔH1 =a kJ·mol-1
O2(g)=CO2(g)+2H2O(g) ΔH1 =a kJ·mol-1
H2(g)+ O2(g)=H2O(g) ΔH2 =b kJ·mol-1
O2(g)=H2O(g) ΔH2 =b kJ·mol-1
H2O(g) = H2O(l) ΔH3=c kJ·mol-1
则CO2(g)+3H2(g)⇌H2O(g)+CH3OH(g) ΔH=_______
(2)为研究CO2与CO之间的转化,让一定量的CO2与足量碳在体积可变的密闭容器中反应:C(s)+CO2(g)⇌2CO(g) ΔH, 反应达平衡后,测得压强、温度对CO的体积分数的影响如图1所示。

回答下列问题:
①压强P1、P2、P3的大小关系是_______ ;Ka、K b、Kc为a、b、c三点对应的平衡常数,则其大小关系是_______ 。
②900℃、1.0MPa时,足量碳与amol CO2反应达平衡后,CO2的转化率为_______ (保留三位有效数字 ),该反应的平衡常数Kp=
),该反应的平衡常数Kp=_______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸,CO2(g)+CH4(g)⇌CH3COOH(g)。在不同温度下催化剂的催化效率与乙酸的生成速率如图2所示。250~300℃时,乙酸的生成速率降低的主要原因是_______ 。
(3)以铅蓄电池为电源可将CO2转化为乙烯,其原理如图3所示,电解所用电极材料均为惰性电极。阴极上的电极反应式为_______ ;每生成0.5mol乙烯,理论上需消耗铅蓄电池中_______ mol硫酸。
(1)研究表明CO2和H2在催化剂存在下可发生反应生成CH3OH已知部分反应的热化学方程式如下:
CH3OH(g)+
 O2(g)=CO2(g)+2H2O(g) ΔH1 =a kJ·mol-1
O2(g)=CO2(g)+2H2O(g) ΔH1 =a kJ·mol-1H2(g)+
 O2(g)=H2O(g) ΔH2 =b kJ·mol-1
O2(g)=H2O(g) ΔH2 =b kJ·mol-1H2O(g) = H2O(l) ΔH3=c kJ·mol-1
则CO2(g)+3H2(g)⇌H2O(g)+CH3OH(g) ΔH=
(2)为研究CO2与CO之间的转化,让一定量的CO2与足量碳在体积可变的密闭容器中反应:C(s)+CO2(g)⇌2CO(g) ΔH, 反应达平衡后,测得压强、温度对CO的体积分数的影响如图1所示。

回答下列问题:
①压强P1、P2、P3的大小关系是
②900℃、1.0MPa时,足量碳与amol CO2反应达平衡后,CO2的转化率为
 ),该反应的平衡常数Kp=
),该反应的平衡常数Kp=③以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸,CO2(g)+CH4(g)⇌CH3COOH(g)。在不同温度下催化剂的催化效率与乙酸的生成速率如图2所示。250~300℃时,乙酸的生成速率降低的主要原因是
(3)以铅蓄电池为电源可将CO2转化为乙烯,其原理如图3所示,电解所用电极材料均为惰性电极。阴极上的电极反应式为
您最近一年使用:0次
2021-04-09更新
|
225次组卷
|
4卷引用:宁夏六盘山市高级中学2020-2021学年高三下学期第一次模拟测试理综化学试题
10 . 第五届联合国环境大会(UNEA-5)于2021年2月份在肯尼亚举行,会议主题为“加大力度保护自然,实现可持续发展”。有效去除大气中的H2S、SO2以及废水中的硫化物是环境保护的重要课题。
(1)氨水可以脱除烟气中的SO2.氨水脱硫的相关热化学方程式如下:
2NH3(g)+H2O(1)+SO2(g)=(NH4)2SO3(aq)∆H=akJ∙mol-1
(NH4)2SO3(aq)t+H2O(l)+SO2(g)=2NH4HSO3(aq)∆H=bkJ∙mol-1
2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq)∆H=ckJ∙mol-1
反应NH3(g)+NH4HSO3(aq)+ O2(g)=(NH4)2SO4(aq)的∆H=
O2(g)=(NH4)2SO4(aq)的∆H=_______ 。(用含a、b、c的代数式表示)kJ∙mol-1)。
(2)SO2可被NO2氧化:SO2(g)+NO2(g)⇌SO3(g)+NO(g)。当温度高于225℃时,反应速率v正=k正∙c(SO2)∙c(NO2),v逆=k逆∙c(SO3)∙c(NO),k正、k逆分别为正、逆反应速率常数。在上述温度范围内,k正、k逆与该反应的平衡常数K之间的关系为_______ 。
(3)在一定条件下,CO可以去除烟气中的SO2,其反应原理为2CO(g)+SO2(g)⇌2CO2(g)+S(g) ∆H>0。其他条件相同、以γ-Al2O3作为催化剂,研究表明,γ-Al2O3在240℃以上发挥催化作用。反应相同的时间,SO2的去除率随反应温度的变化如图1所示。下列有关SO2大除率的说法正确的是_______ (填标号)。

A.240°C以下,SO2能够被催化剂吸附,温度升高,吸附能力减弱,SO2去除率降低
B.以γ-Al2O3作为催化剂,SO2去除率最高只能达到80%
C.温度高于500℃,SO2去除率降低是因为催化剂的活性降低
(4)在气体总压强分别为p1和p2时,反应2SO3(g)⇌2SO2(g)+O2(g)在不同温度下达到平衡,测得SO3(g)及SO2(g)的物质的量分数如图2所示:

①压强:p1_______ (填“>”或“<”)p2。
②若p1=0.81MPa,起始时充入一定虽的SO3(g)发生反应,计算Q点对应温度下该反应的平衡常数Kp=_______ (用平衡分压代替平衡浓度计算。分压=总压×物质的量分数)MPa。
(5)电化学氧化法是一种高效去除废水中硫化物的方法,电解NaHS溶液脱硫的原理如图3所示。碱性条件下,HS-首先被氧化生成中间产物S ,S
,S 容易被继续氧化而生成硫单质。
容易被继续氧化而生成硫单质。

①阳极HS-氧化为S 的电极反应式为
的电极反应式为_______ 。
②电解一段时间后,阳极的石墨电极会出现电极饨化,导致电极反应不能持续有效进行,其原因是_______ 。
(1)氨水可以脱除烟气中的SO2.氨水脱硫的相关热化学方程式如下:
2NH3(g)+H2O(1)+SO2(g)=(NH4)2SO3(aq)∆H=akJ∙mol-1
(NH4)2SO3(aq)t+H2O(l)+SO2(g)=2NH4HSO3(aq)∆H=bkJ∙mol-1
2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq)∆H=ckJ∙mol-1
反应NH3(g)+NH4HSO3(aq)+
 O2(g)=(NH4)2SO4(aq)的∆H=
O2(g)=(NH4)2SO4(aq)的∆H=(2)SO2可被NO2氧化:SO2(g)+NO2(g)⇌SO3(g)+NO(g)。当温度高于225℃时,反应速率v正=k正∙c(SO2)∙c(NO2),v逆=k逆∙c(SO3)∙c(NO),k正、k逆分别为正、逆反应速率常数。在上述温度范围内,k正、k逆与该反应的平衡常数K之间的关系为
(3)在一定条件下,CO可以去除烟气中的SO2,其反应原理为2CO(g)+SO2(g)⇌2CO2(g)+S(g) ∆H>0。其他条件相同、以γ-Al2O3作为催化剂,研究表明,γ-Al2O3在240℃以上发挥催化作用。反应相同的时间,SO2的去除率随反应温度的变化如图1所示。下列有关SO2大除率的说法正确的是

A.240°C以下,SO2能够被催化剂吸附,温度升高,吸附能力减弱,SO2去除率降低
B.以γ-Al2O3作为催化剂,SO2去除率最高只能达到80%
C.温度高于500℃,SO2去除率降低是因为催化剂的活性降低
(4)在气体总压强分别为p1和p2时,反应2SO3(g)⇌2SO2(g)+O2(g)在不同温度下达到平衡,测得SO3(g)及SO2(g)的物质的量分数如图2所示:

①压强:p1
②若p1=0.81MPa,起始时充入一定虽的SO3(g)发生反应,计算Q点对应温度下该反应的平衡常数Kp=
(5)电化学氧化法是一种高效去除废水中硫化物的方法,电解NaHS溶液脱硫的原理如图3所示。碱性条件下,HS-首先被氧化生成中间产物S
 ,S
,S 容易被继续氧化而生成硫单质。
容易被继续氧化而生成硫单质。
①阳极HS-氧化为S
 的电极反应式为
的电极反应式为②电解一段时间后,阳极的石墨电极会出现电极饨化,导致电极反应不能持续有效进行,其原因是
您最近一年使用:0次
2021-04-04更新
|
655次组卷
|
3卷引用:宁夏银川一中2020-2021学年高三下学期第三次模拟理综化学试题



