1 . NOx是大气主要污染物。有效去除大气中的NOx是环境保护的重要课题。
已知:2NO(g)+O2(g) 2NO2(g)的反应过程分为两步:
2NO2(g)的反应过程分为两步:
第一步:2NO(g) N2O2(g) △H1<0;v1正=k1正c2(NO),v1逆=k1逆c(N2O2)
N2O2(g) △H1<0;v1正=k1正c2(NO),v1逆=k1逆c(N2O2)
第二步:N2O2(g)+O2(g) 2NO2(g) △H2<0;v2正=k2正c(N2O2)•c(O2),v2逆=k2逆c2(NO2)
2NO2(g) △H2<0;v2正=k2正c(N2O2)•c(O2),v2逆=k2逆c2(NO2)
(1)一定温度下,反应2NO(g)+O2(g) 2NO2(g)的平衡常数表达式是
2NO2(g)的平衡常数表达式是______ (用k1正,k2正,k1逆,k2逆表示)。
(2)将H2、NO、O2按体积之比为3:2:1充入恒温恒压(200℃,100Kpa)容器中,发生反应4H2(g)+2NO(g)+O2(g) N2(g)+4H2O(g)。达到平衡时,N2的体积分数为0.1。
N2(g)+4H2O(g)。达到平衡时,N2的体积分数为0.1。
①平衡时,NO的转化率为______ ,平衡常数Kp=______ (以平衡分压表示,平衡分压=平衡时总压×平衡时的物质的量分数)Kpa-2。
②已知该反应ΔH<0,初始温度、压强和反应物的用量均相同,下列四种容器中NO的转化率最高的是______ 。
A.恒温恒容容器 B.恒温恒压容器
C.恒容绝热容器 D.恒压绝热容器
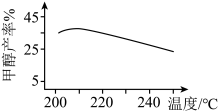
③该反应需选择合适的催化剂进行,分别选用A,B,C三种不同的催化剂进行实验,所得结果如图所示(其它条件相同),则实际生产中适宜选择的催化剂是______ ,理由为______ 。______ 。
已知:2NO(g)+O2(g)
 2NO2(g)的反应过程分为两步:
2NO2(g)的反应过程分为两步:第一步:2NO(g)
 N2O2(g) △H1<0;v1正=k1正c2(NO),v1逆=k1逆c(N2O2)
N2O2(g) △H1<0;v1正=k1正c2(NO),v1逆=k1逆c(N2O2)第二步:N2O2(g)+O2(g)
 2NO2(g) △H2<0;v2正=k2正c(N2O2)•c(O2),v2逆=k2逆c2(NO2)
2NO2(g) △H2<0;v2正=k2正c(N2O2)•c(O2),v2逆=k2逆c2(NO2)(1)一定温度下,反应2NO(g)+O2(g)
 2NO2(g)的平衡常数表达式是
2NO2(g)的平衡常数表达式是(2)将H2、NO、O2按体积之比为3:2:1充入恒温恒压(200℃,100Kpa)容器中,发生反应4H2(g)+2NO(g)+O2(g)
 N2(g)+4H2O(g)。达到平衡时,N2的体积分数为0.1。
N2(g)+4H2O(g)。达到平衡时,N2的体积分数为0.1。①平衡时,NO的转化率为
②已知该反应ΔH<0,初始温度、压强和反应物的用量均相同,下列四种容器中NO的转化率最高的是
A.恒温恒容容器 B.恒温恒压容器
C.恒容绝热容器 D.恒压绝热容器
③该反应需选择合适的催化剂进行,分别选用A,B,C三种不同的催化剂进行实验,所得结果如图所示(其它条件相同),则实际生产中适宜选择的催化剂是

您最近一年使用:0次
2 . 利用反应Ⅰ.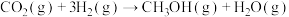
 ,可减少CO2排放,是实现“双碳”目标的途径之一、该反应一般认为可通过以下两步来实现:
,可减少CO2排放,是实现“双碳”目标的途径之一、该反应一般认为可通过以下两步来实现:
反应Ⅱ.
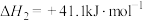
反应Ⅲ.

请回答:
(1)反应Ⅰ自发进行的条件是___________ 。(填“高温”、“低温”或“任何温度”)
(2)一定压强下,往某密闭容器中按投料比 充入H2和CO2反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。
充入H2和CO2反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。___________ 。
A.图中X、Y分别代表CO、H2O
B.增大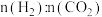 的比值,H2的平衡转化率增大
的比值,H2的平衡转化率增大
C.若容器内混合气体的密度不再随时间改变时,说明反应已达到平衡状态
D.250℃时,反应Ⅱ的平衡常数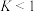
②体系中的CO2物质的量分数受温度的影响不大,试分析原因___________ 。
(3)在一定温度下,在一容积固定的密闭容器中充入1 mol CO2(g)和3 mol H2(g),仅发生反应Ⅰ。起始时容器内气体的总压强为16p kPa,平衡时CH3OH(g)的体积分数为30%,则该温度下反应Ⅰ的平衡常数
___________ 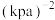 (用含p的表达式表示)。(已知:用气体分压计算的平衡常数为
(用含p的表达式表示)。(已知:用气体分压计算的平衡常数为 ,分压=总压×物质的量分数)。
,分压=总压×物质的量分数)。
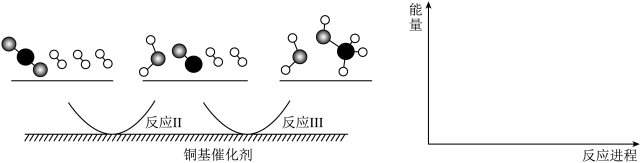
(4)多相催化反应是在催化剂表面通过“扩散→吸附→反应→脱附”四个基本过程进行的。CO2的平衡转化率随着H2浓度的增加先增大后减小,请解释原因___________ 。如图,我国学者发现T℃时,在铜催化剂上二氧化碳加氢的反应机理如下,其中反应Ⅱ为慢反应,请画出反应能量变化图像___________ 。
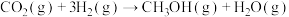
 ,可减少CO2排放,是实现“双碳”目标的途径之一、该反应一般认为可通过以下两步来实现:
,可减少CO2排放,是实现“双碳”目标的途径之一、该反应一般认为可通过以下两步来实现:反应Ⅱ.

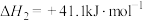
反应Ⅲ.


请回答:
(1)反应Ⅰ自发进行的条件是
(2)一定压强下,往某密闭容器中按投料比
 充入H2和CO2反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。
充入H2和CO2反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。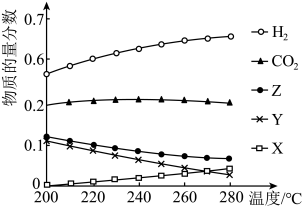
A.图中X、Y分别代表CO、H2O
B.增大
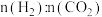 的比值,H2的平衡转化率增大
的比值,H2的平衡转化率增大C.若容器内混合气体的密度不再随时间改变时,说明反应已达到平衡状态
D.250℃时,反应Ⅱ的平衡常数
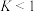
②体系中的CO2物质的量分数受温度的影响不大,试分析原因
(3)在一定温度下,在一容积固定的密闭容器中充入1 mol CO2(g)和3 mol H2(g),仅发生反应Ⅰ。起始时容器内气体的总压强为16p kPa,平衡时CH3OH(g)的体积分数为30%,则该温度下反应Ⅰ的平衡常数

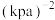 (用含p的表达式表示)。(已知:用气体分压计算的平衡常数为
(用含p的表达式表示)。(已知:用气体分压计算的平衡常数为 ,分压=总压×物质的量分数)。
,分压=总压×物质的量分数)。(4)多相催化反应是在催化剂表面通过“扩散→吸附→反应→脱附”四个基本过程进行的。CO2的平衡转化率随着H2浓度的增加先增大后减小,请解释原因
您最近一年使用:0次
名校
3 . 用 和
和 脱氢制备丙烯已成为制备丙烯的重要方法之一、相关反应为:
脱氢制备丙烯已成为制备丙烯的重要方法之一、相关反应为:
反应Ⅰ:
反应Ⅱ:
已知:①CO和 的标准燃烧热分别为
的标准燃烧热分别为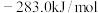 和
和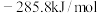 ;
;
②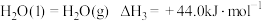
(1)计算
_______  。
。
(2)维持体系总压强恒定为0.1MPa,加入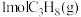 时体积为50L,再加入8.4mol水蒸气作为稀释剂,测得丙烷平衡转化率与温度关系如图所示,已知:水烃比是指投料中水蒸气和丙烷的物质的量之比。
时体积为50L,再加入8.4mol水蒸气作为稀释剂,测得丙烷平衡转化率与温度关系如图所示,已知:水烃比是指投料中水蒸气和丙烷的物质的量之比。
①计算800K下反应1的平衡常数
_______  。(用气体分压计算平衡常数为
。(用气体分压计算平衡常数为 ,气体分压=气体总压×气体的物质的量分数).
,气体分压=气体总压×气体的物质的量分数).
② 下,在图中画出水烃比为10时的曲线
下,在图中画出水烃比为10时的曲线_______ 。
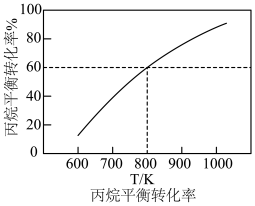
③若其它条件不变,将8.4mol的水蒸气改为8.4mol的 ,则丙烷的平衡转化率将大大增加,请解释原因
,则丙烷的平衡转化率将大大增加,请解释原因______ 。
(3)化学家研究催化剂 催化丙烷脱氢机理如下图所示:
催化丙烷脱氢机理如下图所示:
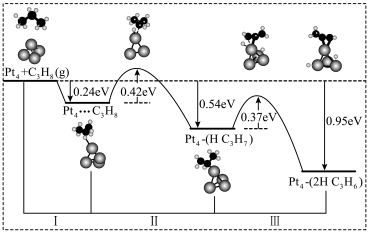
下列说法正确的是______。
 和
和 脱氢制备丙烯已成为制备丙烯的重要方法之一、相关反应为:
脱氢制备丙烯已成为制备丙烯的重要方法之一、相关反应为:反应Ⅰ:

反应Ⅱ:

已知:①CO和
 的标准燃烧热分别为
的标准燃烧热分别为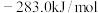 和
和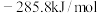 ;
;②
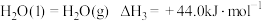
(1)计算

 。
。(2)维持体系总压强恒定为0.1MPa,加入
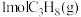 时体积为50L,再加入8.4mol水蒸气作为稀释剂,测得丙烷平衡转化率与温度关系如图所示,已知:水烃比是指投料中水蒸气和丙烷的物质的量之比。
时体积为50L,再加入8.4mol水蒸气作为稀释剂,测得丙烷平衡转化率与温度关系如图所示,已知:水烃比是指投料中水蒸气和丙烷的物质的量之比。①计算800K下反应1的平衡常数

 。(用气体分压计算平衡常数为
。(用气体分压计算平衡常数为 ,气体分压=气体总压×气体的物质的量分数).
,气体分压=气体总压×气体的物质的量分数).②
 下,在图中画出水烃比为10时的曲线
下,在图中画出水烃比为10时的曲线
③若其它条件不变,将8.4mol的水蒸气改为8.4mol的
 ,则丙烷的平衡转化率将大大增加,请解释原因
,则丙烷的平衡转化率将大大增加,请解释原因(3)化学家研究催化剂
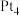 催化丙烷脱氢机理如下图所示:
催化丙烷脱氢机理如下图所示: 
下列说法正确的是______。
A.由图可知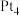 催化大致经过阶段Ⅰ(吸附)、反应Ⅱ(断裂第1个 催化大致经过阶段Ⅰ(吸附)、反应Ⅱ(断裂第1个 键)、反应Ⅲ(断裂第2个 键)、反应Ⅲ(断裂第2个 键) 键) |
B.反应Ⅱ活化能最大,是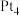 催化丙烷的决速阶段 催化丙烷的决速阶段 |
C.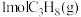 在 在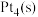 催化下反应生成 催化下反应生成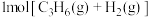 时,放出的热量为 时,放出的热量为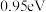 |
| D.若该催化反应在绝热容器中按照先发生Ⅰ,后发生Ⅱ,再发生Ⅲ,则完成反应Ⅱ后,不需要再加热就能发生反应Ⅲ |
您最近一年使用:0次
名校
解题方法
4 . 利用工业废气实现双减最有希望开展大规模应用的是 加氢生成甲醇的反应。298K、100kPa条件下该反应焓变和熵变的数据如下,假设反应
加氢生成甲醇的反应。298K、100kPa条件下该反应焓变和熵变的数据如下,假设反应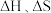 不随温度的改变而变化。
不随温度的改变而变化。
I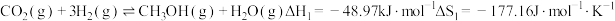
(1)该反应在________ 自发(填“低温”或“任意条件”或“高温”)
(2)在使用催化剂时,该反应由两个基元反应组成,写出决速步骤基元反应方程式________ 。 、总压
、总压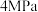 下,
下,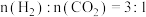 时,不同催化剂组成对
时,不同催化剂组成对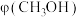 [
[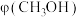 代表单位质量的催化剂在单位时间处理原料气的质量,体现出催化剂的处理能力]、甲醇选择性及副产物
代表单位质量的催化剂在单位时间处理原料气的质量,体现出催化剂的处理能力]、甲醇选择性及副产物 选择性的影响如下表:
选择性的影响如下表:
在实际生产过程中选择催化剂2、3组均可,请说明工业生产中应选择第2组催化剂最主要的原因________ ,选择催化剂3的最主要的原因________ 。
(4) 与
与 不同比例对
不同比例对 转化率和甲醇产率的影响如下图所示,在图中画出副产物
转化率和甲醇产率的影响如下图所示,在图中画出副产物 产率曲线
产率曲线________ (在图中标出与虚线的坐标)。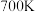 时,
时, 和
和 反应生成甲醇的平衡常数为
反应生成甲醇的平衡常数为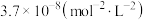 ,在恒容容器中按照
,在恒容容器中按照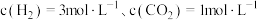 投料,若只发生反应Ⅰ,计算此时
投料,若只发生反应Ⅰ,计算此时 的平衡转化率
的平衡转化率________ 。
 加氢生成甲醇的反应。298K、100kPa条件下该反应焓变和熵变的数据如下,假设反应
加氢生成甲醇的反应。298K、100kPa条件下该反应焓变和熵变的数据如下,假设反应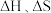 不随温度的改变而变化。
不随温度的改变而变化。I
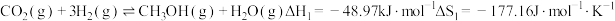
(1)该反应在
(2)在使用催化剂时,该反应由两个基元反应组成,写出决速步骤基元反应方程式
 、总压
、总压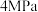 下,
下,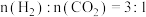 时,不同催化剂组成对
时,不同催化剂组成对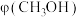 [
[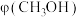 代表单位质量的催化剂在单位时间处理原料气的质量,体现出催化剂的处理能力]、甲醇选择性及副产物
代表单位质量的催化剂在单位时间处理原料气的质量,体现出催化剂的处理能力]、甲醇选择性及副产物 选择性的影响如下表:
选择性的影响如下表: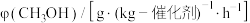 |  选择性(%) 选择性(%) | CO选择性(%) | |
| 催化剂1 | 78 | 40 | 60 |
| 催化剂2 | 88 | 100 | 0 |
| 催化剂3 | 138 | 91 | 9 |
(4)
 与
与 不同比例对
不同比例对 转化率和甲醇产率的影响如下图所示,在图中画出副产物
转化率和甲醇产率的影响如下图所示,在图中画出副产物 产率曲线
产率曲线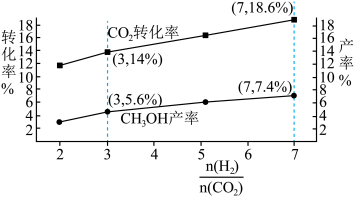
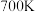 时,
时, 和
和 反应生成甲醇的平衡常数为
反应生成甲醇的平衡常数为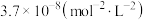 ,在恒容容器中按照
,在恒容容器中按照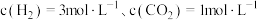 投料,若只发生反应Ⅰ,计算此时
投料,若只发生反应Ⅰ,计算此时 的平衡转化率
的平衡转化率
您最近一年使用:0次
2024-03-22更新
|
471次组卷
|
3卷引用:浙江省金丽衢十二校2023-2024学年高三下学期第二次联考 化学试题
浙江省金丽衢十二校2023-2024学年高三下学期第二次联考 化学试题(已下线)压轴题13 化学反应原理综合题(方法总结+题型密押+压轴题速练)-2024年高考化学压轴题专项训练(浙江专用)2024届河南省焦作市博爱县第一中学高三下学期三模化学试题
解题方法
5 . 中国首次实现了利用二氧化碳人工合成淀粉,为全球的“碳达峰”、“碳中和”起到重大的支撑作用。其中最关键的一步是以CO2为原料制CH3OH.在某 CO2催化加氢制CH3OH 的反应体系中,发生的主要反应有:
Ⅰ.CO2(g)+H2(g) CO(g)+H2O(g) ΔH1=+41.1kJ/mol
CO(g)+H2O(g) ΔH1=+41.1kJ/mol
Ⅱ.CO(g)+2H2(g) CH3OH(g) ΔH2
CH3OH(g) ΔH2
Ⅲ.CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH3=-48.9kJ/mol
CH3OH(g)+H2O(g) ΔH3=-48.9kJ/mol
(1)ΔH2=___________ kJ/mol。
(2)5 MPa时、往某密闭容器中按投料比n(H2):n(CO2)=3∶1充入H2和CO2,反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如下图所示。
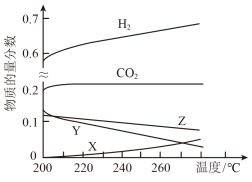
图中Y代表___________ (填化学式)。
(3)我国科研人员研究出在Cu-ZnO—ZrO2催化剂上CO2氢化合成甲醇的反应历程如下图所示。

反应②的化学方程式为___________ 。分析在反应气中加入少量的水能够提升甲醇产率的可能原因是___________ 。
(4)恒压下,CO2和H2以物质的量之比1:3投料合成甲醇(不考虑副反应Ⅱ),在有分子筛膜时甲醇的产率随温度的变化如图所示,其中分子筛膜能选择性分离出H2O。请在下图中画出无分子筛膜时甲醇的平衡产率随温度的变化曲线。________
Ⅰ.CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH1=+41.1kJ/mol
CO(g)+H2O(g) ΔH1=+41.1kJ/molⅡ.CO(g)+2H2(g)
 CH3OH(g) ΔH2
CH3OH(g) ΔH2Ⅲ.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH3=-48.9kJ/mol
CH3OH(g)+H2O(g) ΔH3=-48.9kJ/mol(1)ΔH2=
(2)5 MPa时、往某密闭容器中按投料比n(H2):n(CO2)=3∶1充入H2和CO2,反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如下图所示。

图中Y代表
(3)我国科研人员研究出在Cu-ZnO—ZrO2催化剂上CO2氢化合成甲醇的反应历程如下图所示。

反应②的化学方程式为
(4)恒压下,CO2和H2以物质的量之比1:3投料合成甲醇(不考虑副反应Ⅱ),在有分子筛膜时甲醇的产率随温度的变化如图所示,其中分子筛膜能选择性分离出H2O。请在下图中画出无分子筛膜时甲醇的平衡产率随温度的变化曲线。

您最近一年使用:0次
6 . 丁二烯是生产丁苯橡胶、聚二烯橡胶等的基本原料.丁烯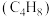 氧化脱氢制丁二烯
氧化脱氢制丁二烯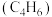 的生产工艺涉及反应如下:
的生产工艺涉及反应如下:
反应Ⅰ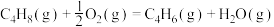
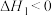
反应Ⅱ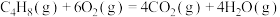
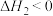
回答下列问题:
(1)判断反应Ⅱ的自发性并说明理由__________ .
(2)在常压、催化剂作用下,投料按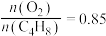 ,并用水蒸气稀释;不同温度下反应相同时间后,测得丁烯的转化率与丁二烯、二氧化碳的选择性随温度变化情况如图1所示(选择性:转化的
,并用水蒸气稀释;不同温度下反应相同时间后,测得丁烯的转化率与丁二烯、二氧化碳的选择性随温度变化情况如图1所示(选择性:转化的 中,生成
中,生成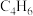 或
或 的
的 的百分比).
的百分比).___________ .
A.随温度的升高, 平衡转化率逐渐增大
平衡转化率逐渐增大
B.水蒸气可调节一定温度下反应物与产物的分压,提高丁烯的平衡转化率
C.较低温度条件下,反应Ⅰ速率大于反应Ⅱ的速率
D.320~580℃范围内,升温,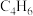 的产率下降,
的产率下降, 产率升高
产率升高
②温度高于440℃时,丁烯转化率随温度变化不明显的可能原因是_____________ .
(3)文献显示,丁烯与 反应也可制丁二烯,可分两步实现:
反应也可制丁二烯,可分两步实现:
反应Ⅲ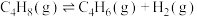
反应Ⅳ
600℃时,恒定总压0.10MPa、以起始物质的量均为1mol的 、
、 投料,达平衡时,测得
投料,达平衡时,测得 和
和 的转化率分别为80%、10%.600℃时,反应Ⅳ的平衡常数
的转化率分别为80%、10%.600℃时,反应Ⅳ的平衡常数
_________ .
(4)有人设计一种电解装置,用乙炔合成二丁烯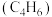 的装置如图2.电解质溶液为
的装置如图2.电解质溶液为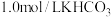 溶液.
溶液.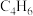 的电极的电极反应式:
的电极的电极反应式:____________ 。
②用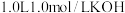 溶液吸收阳极逸出的气体再生电解质溶液。不考虑气体溶解残留.当电路中转移
溶液吸收阳极逸出的气体再生电解质溶液。不考虑气体溶解残留.当电路中转移 时,计算再生液的
时,计算再生液的
____________ 。(已知 的电离常数
的电离常数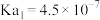 ,
,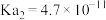 )
)
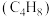 氧化脱氢制丁二烯
氧化脱氢制丁二烯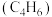 的生产工艺涉及反应如下:
的生产工艺涉及反应如下:反应Ⅰ
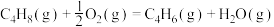
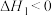
反应Ⅱ
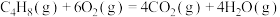
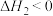
回答下列问题:
(1)判断反应Ⅱ的自发性并说明理由
(2)在常压、催化剂作用下,投料按
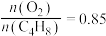 ,并用水蒸气稀释;不同温度下反应相同时间后,测得丁烯的转化率与丁二烯、二氧化碳的选择性随温度变化情况如图1所示(选择性:转化的
,并用水蒸气稀释;不同温度下反应相同时间后,测得丁烯的转化率与丁二烯、二氧化碳的选择性随温度变化情况如图1所示(选择性:转化的 中,生成
中,生成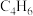 或
或 的
的 的百分比).
的百分比).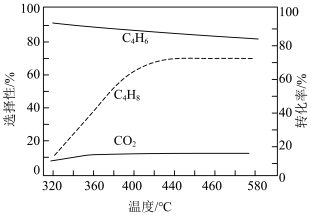
图1
①根据图1的相关信息,下列说法正确的是A.随温度的升高,
 平衡转化率逐渐增大
平衡转化率逐渐增大B.水蒸气可调节一定温度下反应物与产物的分压,提高丁烯的平衡转化率
C.较低温度条件下,反应Ⅰ速率大于反应Ⅱ的速率
D.320~580℃范围内,升温,
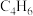 的产率下降,
的产率下降, 产率升高
产率升高②温度高于440℃时,丁烯转化率随温度变化不明显的可能原因是
(3)文献显示,丁烯与
 反应也可制丁二烯,可分两步实现:
反应也可制丁二烯,可分两步实现:反应Ⅲ
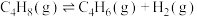
反应Ⅳ

600℃时,恒定总压0.10MPa、以起始物质的量均为1mol的
 、
、 投料,达平衡时,测得
投料,达平衡时,测得 和
和 的转化率分别为80%、10%.600℃时,反应Ⅳ的平衡常数
的转化率分别为80%、10%.600℃时,反应Ⅳ的平衡常数
(4)有人设计一种电解装置,用乙炔合成二丁烯
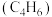 的装置如图2.电解质溶液为
的装置如图2.电解质溶液为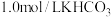 溶液.
溶液.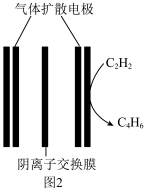
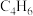 的电极的电极反应式:
的电极的电极反应式:②用
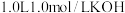 溶液吸收阳极逸出的气体再生电解质溶液。不考虑气体溶解残留.当电路中转移
溶液吸收阳极逸出的气体再生电解质溶液。不考虑气体溶解残留.当电路中转移 时,计算再生液的
时,计算再生液的
 的电离常数
的电离常数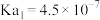 ,
,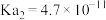 )
)
您最近一年使用:0次
解题方法
7 . 钛酸钡 是一种压电材料,主要用于电子陶瓷、PTC热敏电阻、电容器等多种电子元器件的制备。某工厂以重晶石
是一种压电材料,主要用于电子陶瓷、PTC热敏电阻、电容器等多种电子元器件的制备。某工厂以重晶石 为原料,生产
为原料,生产 的工业流程如下图:
的工业流程如下图:

已知常温下: ,
, 。
。
回答下列问题:
(1)为提高 的酸浸速率,可采取的措施为
的酸浸速率,可采取的措施为_______ (写出一条)。
(2)转化过程中溶液中钛元素在不同pH时主要以 、
、 、
、 这三种形式存在(变化曲线如右图所示)。实际制备工艺中,先用氨水调节混合溶液的pH为
这三种形式存在(变化曲线如右图所示)。实际制备工艺中,先用氨水调节混合溶液的pH为_______ ,再进行转化,理由是_______ 。
(3)工业上用饱和 溶液处理重晶石(假设杂质不与
溶液处理重晶石(假设杂质不与 溶液作用),待达到平衡后,移走上层清液,重复多次操作,将
溶液作用),待达到平衡后,移走上层清液,重复多次操作,将 转化为
转化为 ,此反应的平衡常数K=
,此反应的平衡常数K=_______ (填写计算结果)。若不考虑 的水解,要使
的水解,要使 恰好完全转化为
恰好完全转化为 ,则至少需要浓度为
,则至少需要浓度为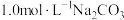 溶液
溶液_______ mL。
(4)在隔绝空气条件下,煅烧草酸氧钛钡晶体时有两种气体(水蒸气除外)生成,该反应的化学方程式为_______ 。流程中用 而不用其它酸的理由是
而不用其它酸的理由是_______ 。
 是一种压电材料,主要用于电子陶瓷、PTC热敏电阻、电容器等多种电子元器件的制备。某工厂以重晶石
是一种压电材料,主要用于电子陶瓷、PTC热敏电阻、电容器等多种电子元器件的制备。某工厂以重晶石 为原料,生产
为原料,生产 的工业流程如下图:
的工业流程如下图:
已知常温下:
 ,
, 。
。回答下列问题:
(1)为提高
 的酸浸速率,可采取的措施为
的酸浸速率,可采取的措施为(2)转化过程中溶液中钛元素在不同pH时主要以
 、
、 、
、 这三种形式存在(变化曲线如右图所示)。实际制备工艺中,先用氨水调节混合溶液的pH为
这三种形式存在(变化曲线如右图所示)。实际制备工艺中,先用氨水调节混合溶液的pH为(3)工业上用饱和
 溶液处理重晶石(假设杂质不与
溶液处理重晶石(假设杂质不与 溶液作用),待达到平衡后,移走上层清液,重复多次操作,将
溶液作用),待达到平衡后,移走上层清液,重复多次操作,将 转化为
转化为 ,此反应的平衡常数K=
,此反应的平衡常数K= 的水解,要使
的水解,要使 恰好完全转化为
恰好完全转化为 ,则至少需要浓度为
,则至少需要浓度为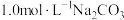 溶液
溶液(4)在隔绝空气条件下,煅烧草酸氧钛钡晶体时有两种气体(水蒸气除外)生成,该反应的化学方程式为
 而不用其它酸的理由是
而不用其它酸的理由是
您最近一年使用:0次
解题方法
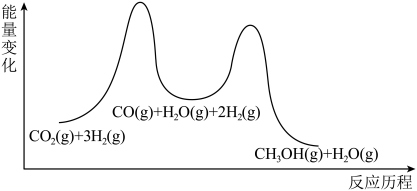
8 . 将二氧化碳转化为高附加值化学品是目前研究的热点之一,甲醇是重要的化工原料和优良的替代燃料,因此加氢制甲醇被广泛关注。在催化剂作用下主要发生以下反应。
Ⅰ.

Ⅱ.
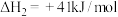
Ⅲ.

(1)反应Ⅲ自发进行的条件是______ 。
(2)恒温恒容条件下,原料气 、
、 以物质的量浓度1:3投料时,控制合适条件(不考虑反应Ⅲ),甲醇的选择性为
以物质的量浓度1:3投料时,控制合适条件(不考虑反应Ⅲ),甲醇的选择性为 。已知初始压强为
。已知初始压强为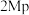 ,
, ,
, 平衡转化率为
平衡转化率为 ,则该条件下反应Ⅱ
,则该条件下反应Ⅱ
______ 。(对于气相反应,用组分B的平衡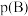 代替
代替 ,记作
,记作 。
。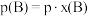 ,p为平衡压强,
,p为平衡压强,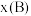 为平衡系统中
为平衡系统中 的物质的量分数。)
的物质的量分数。)
在 ,
,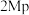 ,
, 、
、 以物质的量浓度1:3投料,以一定流速通过不同
以物质的量浓度1:3投料,以一定流速通过不同 与
与 催化剂,图a和b为催化反应
催化剂,图a和b为催化反应 转化率、甲醇选择性、甲醇收率随温度的变化,反应的产物只有甲醇、
转化率、甲醇选择性、甲醇收率随温度的变化,反应的产物只有甲醇、 和
和 。
。
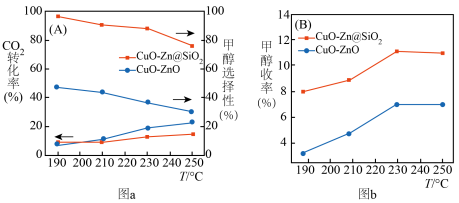
(3)分析在该压强下的最适合反应条件为______ 。
(4)推测在一定温度范围内,随着反应温度的升高, 转化率增大,但甲醇选择性降低的原因是
转化率增大,但甲醇选择性降低的原因是______ 。
(5)催化加氢的反应机理如下图所示。

下列说法正确的是_______
(6)在 催化剂条件下,保持流速与反应物投料比不变,增加反应物用量,请在图b上画出甲醇收率随温度变化曲线
催化剂条件下,保持流速与反应物投料比不变,增加反应物用量,请在图b上画出甲醇收率随温度变化曲线__________ 。
Ⅰ.


Ⅱ.

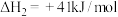
Ⅲ.


(1)反应Ⅲ自发进行的条件是
(2)恒温恒容条件下,原料气
 、
、 以物质的量浓度1:3投料时,控制合适条件(不考虑反应Ⅲ),甲醇的选择性为
以物质的量浓度1:3投料时,控制合适条件(不考虑反应Ⅲ),甲醇的选择性为 。已知初始压强为
。已知初始压强为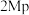 ,
, ,
, 平衡转化率为
平衡转化率为 ,则该条件下反应Ⅱ
,则该条件下反应Ⅱ
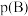 代替
代替 ,记作
,记作 。
。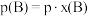 ,p为平衡压强,
,p为平衡压强,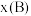 为平衡系统中
为平衡系统中 的物质的量分数。)
的物质的量分数。) 在
 ,
,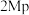 ,
, 、
、 以物质的量浓度1:3投料,以一定流速通过不同
以物质的量浓度1:3投料,以一定流速通过不同 与
与 催化剂,图a和b为催化反应
催化剂,图a和b为催化反应 转化率、甲醇选择性、甲醇收率随温度的变化,反应的产物只有甲醇、
转化率、甲醇选择性、甲醇收率随温度的变化,反应的产物只有甲醇、 和
和 。
。
(3)分析在该压强下的最适合反应条件为
(4)推测在一定温度范围内,随着反应温度的升高,
 转化率增大,但甲醇选择性降低的原因是
转化率增大,但甲醇选择性降低的原因是(5)催化加氢的反应机理如下图所示。

下列说法正确的是_______
A. 催化剂中 催化剂中 抑制了 抑制了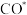 的解吸附,从而抑制 的解吸附,从而抑制 的生成。 的生成。 |
B. 催化剂上主要通过甲酸盐路径加氢生成甲醇。 催化剂上主要通过甲酸盐路径加氢生成甲醇。 |
| C.增大流速,原料气与催化剂碰撞机会多,甲醇产率一定增加。 |
D.随着温度升高,有利于 在催化剂表面反应,平衡转化率增大。 在催化剂表面反应,平衡转化率增大。 |
(6)在
 催化剂条件下,保持流速与反应物投料比不变,增加反应物用量,请在图b上画出甲醇收率随温度变化曲线
催化剂条件下,保持流速与反应物投料比不变,增加反应物用量,请在图b上画出甲醇收率随温度变化曲线
您最近一年使用:0次
名校
解题方法
9 . 甲烷是重要的资源,通过下列过程可实现由甲烷到氢气的转化。

(1)500℃时,CH4与H2O重整主要发生下列反应:
反应1:

反应2:
已知: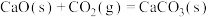

①向重整反应体系中加入适量CaO,其优点是___________
②向一恒容密闭容器中加入1 mol CH4和一定量的H2O,若只发生反应1,CH4的平衡转化率按不同投料比x( )随温度的变化曲线如图1所示。下列说法
)随温度的变化曲线如图1所示。下列说法不正确 的是___________

A.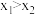
B.反应速率:
C.点a、b、c对应的平衡常数:
D.反应温度为 ,当容器内压强不变时,反应达到平衡状态
,当容器内压强不变时,反应达到平衡状态
(2)CH4与CO2重整主要发生下列反应:
反应3:

反应4:

将1 mol CH4与1 mol CO2在2 L密闭容器中反应制取CO和H2时,CH4和CO2的平衡转化率随温度变化关系如图2所示。

①计算923 K时反应3的化学平衡常数
___________ (计算结果保留两位小数)
②CH4还原能力(R)可衡量CO2转化效率,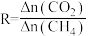 (同一时段内CO2与CH4的物质的量变化量之比),从平衡移动的角度分析,随着温度升高,R值逐渐减小直至近似等于1的原因
(同一时段内CO2与CH4的物质的量变化量之比),从平衡移动的角度分析,随着温度升高,R值逐渐减小直至近似等于1的原因___________
③催化剂X可提高R值,常压下CH4和CO2按物质的量之比1:3投料,某一段时间内CH4转化率、R值随温度变化如下表:
下列说法正确的是___________ 。
A.R值提高是由于催化剂X选择性地提高反应4的速率
B.温度越低,含氢产物中H2O占比越低
C.温度升高,CH4转化率增加,CO2转化率降低,R值减小
D.改变催化剂可提高平衡时的R值

(1)500℃时,CH4与H2O重整主要发生下列反应:
反应1:


反应2:

已知:
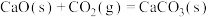

①向重整反应体系中加入适量CaO,其优点是
②向一恒容密闭容器中加入1 mol CH4和一定量的H2O,若只发生反应1,CH4的平衡转化率按不同投料比x(
 )随温度的变化曲线如图1所示。下列说法
)随温度的变化曲线如图1所示。下列说法
A.
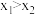
B.反应速率:

C.点a、b、c对应的平衡常数:

D.反应温度为
 ,当容器内压强不变时,反应达到平衡状态
,当容器内压强不变时,反应达到平衡状态(2)CH4与CO2重整主要发生下列反应:
反应3:


反应4:


将1 mol CH4与1 mol CO2在2 L密闭容器中反应制取CO和H2时,CH4和CO2的平衡转化率随温度变化关系如图2所示。

①计算923 K时反应3的化学平衡常数

②CH4还原能力(R)可衡量CO2转化效率,
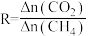 (同一时段内CO2与CH4的物质的量变化量之比),从平衡移动的角度分析,随着温度升高,R值逐渐减小直至近似等于1的原因
(同一时段内CO2与CH4的物质的量变化量之比),从平衡移动的角度分析,随着温度升高,R值逐渐减小直至近似等于1的原因③催化剂X可提高R值,常压下CH4和CO2按物质的量之比1:3投料,某一段时间内CH4转化率、R值随温度变化如下表:
| 温度/℃ | 480 | 500 | 520 | 550 |
| CH4转化率/% | 7.9 | 11.5 | 20.2 | 34.8 |
| R | 2.6 | 2.4 | 2.1 | 1.8 |
A.R值提高是由于催化剂X选择性地提高反应4的速率
B.温度越低,含氢产物中H2O占比越低
C.温度升高,CH4转化率增加,CO2转化率降低,R值减小
D.改变催化剂可提高平衡时的R值
您最近一年使用:0次
10 .  过度排放会引起气候、环境等问题。在Cu/ZnO催化剂下,
过度排放会引起气候、环境等问题。在Cu/ZnO催化剂下, 和
和 可发生反应生成
可发生反应生成 和CO,热化学方程式如下:
和CO,热化学方程式如下:
Ⅰ.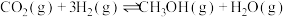
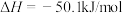
Ⅱ.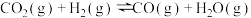
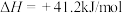
(1)已知: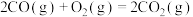
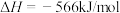

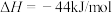
写出表示氢气燃烧热的热化学方程式___________ 。
(2)在一定温度下,向体积固定的密闭容器中通入 和
和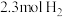 ,起始压强为0.33MPa,发生反应Ⅰ和Ⅱ。平衡时,总压为0.25MPa,
,起始压强为0.33MPa,发生反应Ⅰ和Ⅱ。平衡时,总压为0.25MPa, 的转化率为50%,则反应Ⅰ的平衡常数
的转化率为50%,则反应Ⅰ的平衡常数
___________  (以分压表示,分压=总压×物质的量分数)
(以分压表示,分压=总压×物质的量分数)
(3)不同压强下,维持投料比相同,实验测定 的平衡转化率随温度的变化关系如图1所示。在恒压密闭容器中,维持投料比相同,将
的平衡转化率随温度的变化关系如图1所示。在恒压密闭容器中,维持投料比相同,将 和
和 按一定的流速通过反应器,二氧化碳的转化率
按一定的流速通过反应器,二氧化碳的转化率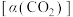 和甲醇的选择性 [
和甲醇的选择性 [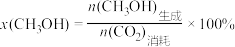 ]随温度变化关系如图2所示。图示温度范围催化剂的活性受温度影响不大。
]随温度变化关系如图2所示。图示温度范围催化剂的活性受温度影响不大。

①下列说法不正确 的是___________ 。
A.图1中,
B.图1中550℃后以反应Ⅱ为主,反应Ⅱ前后气体分子数相等,压强改变对平衡基本没有影响
C.图2中236℃后,升温使反应Ⅰ平衡逆向移动的程度大于反应Ⅱ平衡正向移动程度,使 转化率和
转化率和 选择性都下降
选择性都下降
D.改用活性更好的催化剂能使图2中各温度下 转化率都增大
转化率都增大
②假设只发生反应Ⅰ,一定温度下氢气和二氧化碳的物质的量之比为n:1,相应平衡体系中甲醇的物质的量分数为y,请在图3中绘制y随n变化的示意图。___________

(4)在密闭容器中,维持其他条件不变,在不同的压强下发生反应Ⅰ和Ⅱ,二氧化碳的平衡转化率和甲醇的选择性随压强变化关系如下表所示。 随压强增大而
随压强增大而___________ (填“增大”“减小”或“不变”),从化学平衡移动角度解释原因___________ 。
 过度排放会引起气候、环境等问题。在Cu/ZnO催化剂下,
过度排放会引起气候、环境等问题。在Cu/ZnO催化剂下, 和
和 可发生反应生成
可发生反应生成 和CO,热化学方程式如下:
和CO,热化学方程式如下:Ⅰ.
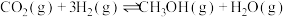
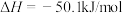
Ⅱ.
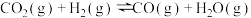
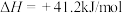
(1)已知:
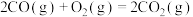
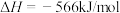

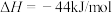
写出表示氢气燃烧热的热化学方程式
(2)在一定温度下,向体积固定的密闭容器中通入
 和
和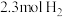 ,起始压强为0.33MPa,发生反应Ⅰ和Ⅱ。平衡时,总压为0.25MPa,
,起始压强为0.33MPa,发生反应Ⅰ和Ⅱ。平衡时,总压为0.25MPa, 的转化率为50%,则反应Ⅰ的平衡常数
的转化率为50%,则反应Ⅰ的平衡常数
 (以分压表示,分压=总压×物质的量分数)
(以分压表示,分压=总压×物质的量分数)(3)不同压强下,维持投料比相同,实验测定
 的平衡转化率随温度的变化关系如图1所示。在恒压密闭容器中,维持投料比相同,将
的平衡转化率随温度的变化关系如图1所示。在恒压密闭容器中,维持投料比相同,将 和
和 按一定的流速通过反应器,二氧化碳的转化率
按一定的流速通过反应器,二氧化碳的转化率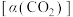 和甲醇的选择性 [
和甲醇的选择性 [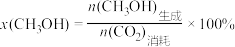 ]随温度变化关系如图2所示。图示温度范围催化剂的活性受温度影响不大。
]随温度变化关系如图2所示。图示温度范围催化剂的活性受温度影响不大。
①下列说法
A.图1中,

B.图1中550℃后以反应Ⅱ为主,反应Ⅱ前后气体分子数相等,压强改变对平衡基本没有影响
C.图2中236℃后,升温使反应Ⅰ平衡逆向移动的程度大于反应Ⅱ平衡正向移动程度,使
 转化率和
转化率和 选择性都下降
选择性都下降D.改用活性更好的催化剂能使图2中各温度下
 转化率都增大
转化率都增大②假设只发生反应Ⅰ,一定温度下氢气和二氧化碳的物质的量之比为n:1,相应平衡体系中甲醇的物质的量分数为y,请在图3中绘制y随n变化的示意图。

(4)在密闭容器中,维持其他条件不变,在不同的压强下发生反应Ⅰ和Ⅱ,二氧化碳的平衡转化率和甲醇的选择性随压强变化关系如下表所示。
 随压强增大而
随压强增大而| 压强P(MPa) | 1 | 2 | 3 | 4 | 5 | 6 |
 的平衡转化率% 的平衡转化率% | 8.1 | 15.3 | 22.2 | 29.5 | 36.1 | 43.2 |
 的选择性% 的选择性% | 49.5 | 80.1 | 90.0 | 94.5 | 97.1 | 98.6 |
您最近一年使用:0次



