名校
解题方法
1 .  和
和 都是重要的能源物质,
都是重要的能源物质, 催化加氢合成甲醇是一种有效利用氢气且减少温室气体
催化加氢合成甲醇是一种有效利用氢气且减少温室气体 排放的方法。
排放的方法。
(1)通过计算机分析,我们可从势能图认识 加氢制甲醇在不同催化条件下存在的两种反应路径,如图所示,下列说法正确的是
加氢制甲醇在不同催化条件下存在的两种反应路径,如图所示,下列说法正确的是___________ 。
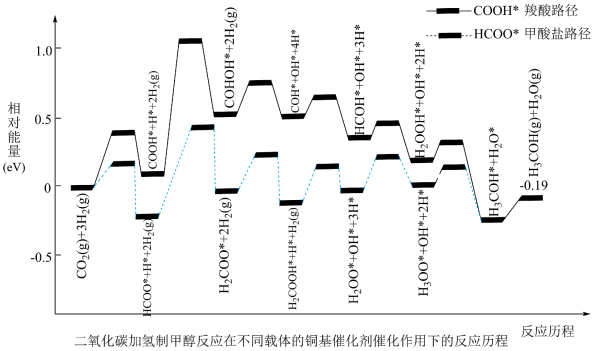
①甲酸盐路径的决速步是
②不考虑 ,两种路径中产生的含碳中间体种类均有6种
,两种路径中产生的含碳中间体种类均有6种
③该反应的活化能
④催化剂相同,使用不同的载体也可改变反应历程
(2) 催化加氢合成甲醇的过程中会发生副反应。
催化加氢合成甲醇的过程中会发生副反应。
副反应I:

副反应II:

主反应为

 的选择性
的选择性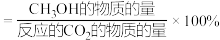
 的转化率
的转化率
①在一定条件下,选择合适的催化剂只进行反应副反应I,控制 和
和 初始投料比为
初始投料比为 时,在不同温度下
时,在不同温度下 ,
, ,
, ,达到平衡后,
,达到平衡后, 的转化率分别为50%、60%、75%,已知反应速率
的转化率分别为50%、60%、75%,已知反应速率 ,
, 、
、 分别为正、逆向反应速率常数,x为物质的量分数。
分别为正、逆向反应速率常数,x为物质的量分数。 最大的是温度
最大的是温度_________ (填“ ”、“
”、“ ”或“
”或“ ”,下同),
”,下同), 最大的是温度
最大的是温度________ 。
②控制 和
和 初始投料比为
初始投料比为 时,温度对
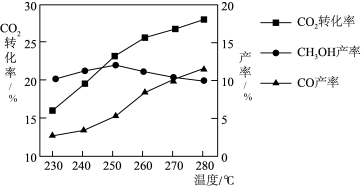
时,温度对 平衡转化率及甲醇和CO的产率的影响如图所示,则在250℃以上,升高温度
平衡转化率及甲醇和CO的产率的影响如图所示,则在250℃以上,升高温度 的转化率增大,但甲醇的产率降低,原因是
的转化率增大,但甲醇的产率降低,原因是___________ 。为增大 的产率,可采用的方法是
的产率,可采用的方法是___________ (填一项即可)。
③一定条件下,在固定容积的容器中通入1mol 和3mol
和3mol 发生上述反应,初始压强为p,达到平衡时,容器中
发生上述反应,初始压强为p,达到平衡时,容器中 的物质的量为0.4mol,
的物质的量为0.4mol, 物质的量为0.1mol,
物质的量为0.1mol, 的转化率为70%,则
的转化率为70%,则 的选择性为
的选择性为___________ 。主反应的平衡常数 的计算表达式为
的计算表达式为___________ (用平衡分压代替平衡浓度,分压=总压×物质的量分数)。
 和
和 都是重要的能源物质,
都是重要的能源物质, 催化加氢合成甲醇是一种有效利用氢气且减少温室气体
催化加氢合成甲醇是一种有效利用氢气且减少温室气体 排放的方法。
排放的方法。(1)通过计算机分析,我们可从势能图认识
 加氢制甲醇在不同催化条件下存在的两种反应路径,如图所示,下列说法正确的是
加氢制甲醇在不同催化条件下存在的两种反应路径,如图所示,下列说法正确的是
①甲酸盐路径的决速步是

②不考虑
 ,两种路径中产生的含碳中间体种类均有6种
,两种路径中产生的含碳中间体种类均有6种③该反应的活化能

④催化剂相同,使用不同的载体也可改变反应历程
(2)
 催化加氢合成甲醇的过程中会发生副反应。
催化加氢合成甲醇的过程中会发生副反应。副反应I:


副反应II:


主反应为


 的选择性
的选择性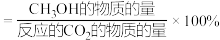
 的转化率
的转化率
①在一定条件下,选择合适的催化剂只进行反应副反应I,控制
 和
和 初始投料比为
初始投料比为 时,在不同温度下
时,在不同温度下 ,
, ,
, ,达到平衡后,
,达到平衡后, 的转化率分别为50%、60%、75%,已知反应速率
的转化率分别为50%、60%、75%,已知反应速率 ,
, 、
、 分别为正、逆向反应速率常数,x为物质的量分数。
分别为正、逆向反应速率常数,x为物质的量分数。 最大的是温度
最大的是温度 ”、“
”、“ ”或“
”或“ ”,下同),
”,下同),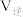 最大的是温度
最大的是温度②控制
 和
和 初始投料比为
初始投料比为 时,温度对
时,温度对 平衡转化率及甲醇和CO的产率的影响如图所示,则在250℃以上,升高温度
平衡转化率及甲醇和CO的产率的影响如图所示,则在250℃以上,升高温度 的转化率增大,但甲醇的产率降低,原因是
的转化率增大,但甲醇的产率降低,原因是 的产率,可采用的方法是
的产率,可采用的方法是
③一定条件下,在固定容积的容器中通入1mol
 和3mol
和3mol 发生上述反应,初始压强为p,达到平衡时,容器中
发生上述反应,初始压强为p,达到平衡时,容器中 的物质的量为0.4mol,
的物质的量为0.4mol, 物质的量为0.1mol,
物质的量为0.1mol, 的转化率为70%,则
的转化率为70%,则 的选择性为
的选择性为 的计算表达式为
的计算表达式为
您最近一年使用:0次
2024-03-09更新
|
365次组卷
|
2卷引用:四川省成都市树德中学2023-2024学年高三上学期期末考试理科综合试题-高中化学
2 .  的转化利用对化解全球环境生态危机,实现全球碳达峰和碳中和有着重要的意义。
的转化利用对化解全球环境生态危机,实现全球碳达峰和碳中和有着重要的意义。
(1)以 为催化剂的光热化学循环可以分解
为催化剂的光热化学循环可以分解 。已知气态分子化学键完全断裂时的能量变化如图所示,则
。已知气态分子化学键完全断裂时的能量变化如图所示,则 分解的热化学方程式为
分解的热化学方程式为___________ 。

(2) 催化加氢可以合成甲醇,该过程主要发生下列反应:
催化加氢可以合成甲醇,该过程主要发生下列反应:
i.
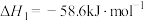
ii.
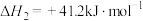
①若在绝热条件下,将 、
、 按体积比1:2充入恒容密闭容器中只发生反应ii,下列能判断反应ii达到平衡状态的是
按体积比1:2充入恒容密闭容器中只发生反应ii,下列能判断反应ii达到平衡状态的是___________
A.容器内混合气体的密度不变 B.容器内混合气体的压强不变
C.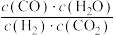 不变 D.
不变 D.
②若在一定温度下,向2L恒容密闭容器中充入3mol 和5mol
和5mol 同时发生反应i和ii,达到平衡时H₂的总转化率为80%,体系压强减小了25%,则
同时发生反应i和ii,达到平衡时H₂的总转化率为80%,体系压强减小了25%,则 的选择性为
的选择性为___________ ( 的选择性=
的选择性= ,该温度下,反应i的化学平衡常数
,该温度下,反应i的化学平衡常数 =
=___________ 。
③若在一定压强下,将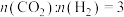 的混合气体以一定流速通过装有催化剂的反应器,实验测得
的混合气体以一定流速通过装有催化剂的反应器,实验测得 的转化率、
的转化率、 或
或 的选择性以及
的选择性以及 的收率(
的收率( 的收率=
的收率= 的转化率×
的转化率× 的选择性)随温度的变化关系如图所示。
的选择性)随温度的变化关系如图所示。

曲线a表示___________ 的选择性随温度的变化。210~290℃之间, 收率先增大后减小的原因是
收率先增大后减小的原因是___________ 。
(3)电解法也可以将 转化为甲醇,原理如图所示。若右侧溶液中
转化为甲醇,原理如图所示。若右侧溶液中 溶液浓度不变(忽略体积的变化)且溶液中不产生
溶液浓度不变(忽略体积的变化)且溶液中不产生 ,则电极b上发生的电极反应式为
,则电极b上发生的电极反应式为___________ 。若将产生的 用于碱性燃料电池对外供电,该电池的比能量为
用于碱性燃料电池对外供电,该电池的比能量为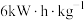 ,甲醇的燃烧热
,甲醇的燃烧热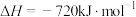 ,该电池的能量转化率为
,该电池的能量转化率为___________ 。(已知: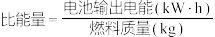 ;
;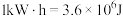 )。
)。

 的转化利用对化解全球环境生态危机,实现全球碳达峰和碳中和有着重要的意义。
的转化利用对化解全球环境生态危机,实现全球碳达峰和碳中和有着重要的意义。(1)以
 为催化剂的光热化学循环可以分解
为催化剂的光热化学循环可以分解 。已知气态分子化学键完全断裂时的能量变化如图所示,则
。已知气态分子化学键完全断裂时的能量变化如图所示,则 分解的热化学方程式为
分解的热化学方程式为
(2)
 催化加氢可以合成甲醇,该过程主要发生下列反应:
催化加氢可以合成甲醇,该过程主要发生下列反应:i.

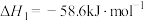
ii.

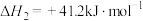
①若在绝热条件下,将
 、
、 按体积比1:2充入恒容密闭容器中只发生反应ii,下列能判断反应ii达到平衡状态的是
按体积比1:2充入恒容密闭容器中只发生反应ii,下列能判断反应ii达到平衡状态的是A.容器内混合气体的密度不变 B.容器内混合气体的压强不变
C.
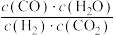 不变 D.
不变 D.
②若在一定温度下,向2L恒容密闭容器中充入3mol
 和5mol
和5mol 同时发生反应i和ii,达到平衡时H₂的总转化率为80%,体系压强减小了25%,则
同时发生反应i和ii,达到平衡时H₂的总转化率为80%,体系压强减小了25%,则 的选择性为
的选择性为 的选择性=
的选择性= ,该温度下,反应i的化学平衡常数
,该温度下,反应i的化学平衡常数 =
=③若在一定压强下,将
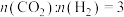 的混合气体以一定流速通过装有催化剂的反应器,实验测得
的混合气体以一定流速通过装有催化剂的反应器,实验测得 的转化率、
的转化率、 或
或 的选择性以及
的选择性以及 的收率(
的收率( 的收率=
的收率= 的转化率×
的转化率× 的选择性)随温度的变化关系如图所示。
的选择性)随温度的变化关系如图所示。
曲线a表示
 收率先增大后减小的原因是
收率先增大后减小的原因是(3)电解法也可以将
 转化为甲醇,原理如图所示。若右侧溶液中
转化为甲醇,原理如图所示。若右侧溶液中 溶液浓度不变(忽略体积的变化)且溶液中不产生
溶液浓度不变(忽略体积的变化)且溶液中不产生 ,则电极b上发生的电极反应式为
,则电极b上发生的电极反应式为 用于碱性燃料电池对外供电,该电池的比能量为
用于碱性燃料电池对外供电,该电池的比能量为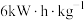 ,甲醇的燃烧热
,甲醇的燃烧热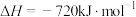 ,该电池的能量转化率为
,该电池的能量转化率为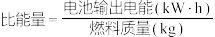 ;
;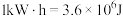 )。
)。
您最近一年使用:0次
名校
解题方法
3 . 某工厂采用如下工艺处理镍钴矿硫酸浸取液(含 、
、 、
、 、
、 、
、 和
和 ),实现镍、钴、镁元素的回收。
),实现镍、钴、镁元素的回收。
(1)工业上用一定浓度的硫酸浸取已粉碎的镍钴矿并不断搅拌,提高浸取速率的方法为____________ (答出一条即可)。
(2)“氧化”时,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸( ),其中
),其中 元素的化合价为
元素的化合价为______ 。
(3)已知: 的电离方程式为
的电离方程式为 、
、
①“氧化”时,先通入足量混合气,溶液中的正二价铁元素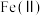 被
被 氧化为
氧化为 ,该反应的离子方程式为
,该反应的离子方程式为______ ;再加入石灰乳,所得滤渣中主要成分是 、
、______ 。
②通入混合气中 的体积分数与
的体积分数与 氧化率随时间的变化关系如图所示,若混合气中不添加
氧化率随时间的变化关系如图所示,若混合气中不添加 ,相同时间内
,相同时间内 氧化率较低的原因是
氧化率较低的原因是____________ ; 的体积分数高于9.0%时,相同时间内
的体积分数高于9.0%时,相同时间内 氧化率开始降低的原因是
氧化率开始降低的原因是____________ 。 溶液进行“钴镍分离”,写出“钴镍分离”反应生成
溶液进行“钴镍分离”,写出“钴镍分离”反应生成
 沉淀的离子方程式:
沉淀的离子方程式:______ 。
②若“镍钴分离”后溶液中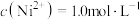 ,加入
,加入 溶液“沉镍”后的滤液中
溶液“沉镍”后的滤液中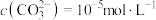 ,则沉镍率=
,则沉镍率=______ 。[已知: ,沉镍率=
,沉镍率=
 、
、 、
、 、
、 、
、 和
和 ),实现镍、钴、镁元素的回收。
),实现镍、钴、镁元素的回收。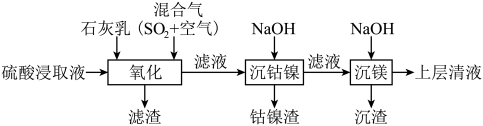
(1)工业上用一定浓度的硫酸浸取已粉碎的镍钴矿并不断搅拌,提高浸取速率的方法为
(2)“氧化”时,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸(
 ),其中
),其中 元素的化合价为
元素的化合价为(3)已知:
 的电离方程式为
的电离方程式为 、
、
①“氧化”时,先通入足量混合气,溶液中的正二价铁元素
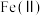 被
被 氧化为
氧化为 ,该反应的离子方程式为
,该反应的离子方程式为 、
、②通入混合气中
 的体积分数与
的体积分数与 氧化率随时间的变化关系如图所示,若混合气中不添加
氧化率随时间的变化关系如图所示,若混合气中不添加 ,相同时间内
,相同时间内 氧化率较低的原因是
氧化率较低的原因是 的体积分数高于9.0%时,相同时间内
的体积分数高于9.0%时,相同时间内 氧化率开始降低的原因是
氧化率开始降低的原因是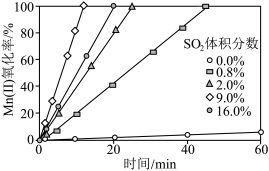
 溶液进行“钴镍分离”,写出“钴镍分离”反应生成
溶液进行“钴镍分离”,写出“钴镍分离”反应生成 沉淀的离子方程式:
沉淀的离子方程式:②若“镍钴分离”后溶液中
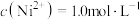 ,加入
,加入 溶液“沉镍”后的滤液中
溶液“沉镍”后的滤液中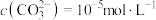 ,则沉镍率=
,则沉镍率= ,沉镍率=
,沉镍率=
您最近一年使用:0次
2024-02-17更新
|
480次组卷
|
4卷引用:2024届四川省眉山市仁寿县高三下学期三诊模拟联考理综试题-高中化学
2024届四川省眉山市仁寿县高三下学期三诊模拟联考理综试题-高中化学安徽省合肥市第一中学2023-2024学年高三上学期期末考试化学试题(已下线)专题08 工艺流程综合题-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)2024届陕西省商洛市高三下学期第三次尖子生学情诊断考试理综试题-高中化学
名校
解题方法
4 . 环境保护是当今社会的热门问题,而氮的氧化物是大气污染的主要物质,研究氮的氧化物的反应对于减少大气污染有重要意义。回答下列问题:
I.汽车尾气中的NO对人体健康有严重危害,一种新技术用 还原NO的反应原理为:
还原NO的反应原理为:
 。该反应的能量变化过程如图:
。该反应的能量变化过程如图:
___________  (用图中字母a、b、c、d表示)。该反应在
(用图中字母a、b、c、d表示)。该反应在___________ (填“高温”、“低温”或“任意温度”)条件下有利于自发进行。
Ⅱ.汽油燃油车上安装三元催化转化器,可以使CO和NO两种尾气反应生成 ,可有效降低汽车尾气污染。
,可有效降低汽车尾气污染。
已知反应:
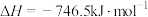 。在密闭容器中充入10molCO和8molNO发生反应,平衡时NO的体积分数与温度、压强的关系如图所示:
。在密闭容器中充入10molCO和8molNO发生反应,平衡时NO的体积分数与温度、压强的关系如图所示:
___________  (填“>”、“<”或“=”);反应平衡后,改变以下条件能使速率和两种污染气体转化率都增大的是
(填“>”、“<”或“=”);反应平衡后,改变以下条件能使速率和两种污染气体转化率都增大的是___________ (填标号)。
a.压缩容器体积 b.升高温度 c.恒压充入氦气 d.加入催化剂
(3)反应在D点达到平衡后,若此时降低温度,同时压缩容器体积,在重新达到平衡过程中,D点会向A~G点中的___________ 点方向移动。
(4)E点的压强平衡常数
___________  (保留两位有效数字;用平衡分压代替平衡浓度计算,分压=总压×该组分物质的量分数)。
(保留两位有效数字;用平衡分压代替平衡浓度计算,分压=总压×该组分物质的量分数)。
(5)某研究小组探究温度和催化剂对CO、NO转化率的影响。将CO和NO按物质的量之比1:1以一定的流速分别通过两种催化剂(Cat-1和Cat-2)进行反应,相同时间内测量逸出气体中NO的含量,从而确定尾气脱氮率(即NO的转化率),结果如图所示:___________ (填“Cat-1”或“Cat-2”)。
②催化剂Cat-2条件下,450℃后,脱氮率随温度升高而下降的原因是___________ 。
I.汽车尾气中的NO对人体健康有严重危害,一种新技术用
 还原NO的反应原理为:
还原NO的反应原理为:
 。该反应的能量变化过程如图:
。该反应的能量变化过程如图: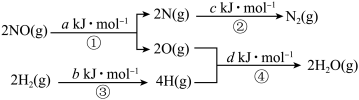

 (用图中字母a、b、c、d表示)。该反应在
(用图中字母a、b、c、d表示)。该反应在Ⅱ.汽油燃油车上安装三元催化转化器,可以使CO和NO两种尾气反应生成
 ,可有效降低汽车尾气污染。
,可有效降低汽车尾气污染。已知反应:

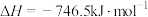 。在密闭容器中充入10molCO和8molNO发生反应,平衡时NO的体积分数与温度、压强的关系如图所示:
。在密闭容器中充入10molCO和8molNO发生反应,平衡时NO的体积分数与温度、压强的关系如图所示: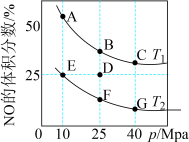

 (填“>”、“<”或“=”);反应平衡后,改变以下条件能使速率和两种污染气体转化率都增大的是
(填“>”、“<”或“=”);反应平衡后,改变以下条件能使速率和两种污染气体转化率都增大的是a.压缩容器体积 b.升高温度 c.恒压充入氦气 d.加入催化剂
(3)反应在D点达到平衡后,若此时降低温度,同时压缩容器体积,在重新达到平衡过程中,D点会向A~G点中的
(4)E点的压强平衡常数

 (保留两位有效数字;用平衡分压代替平衡浓度计算,分压=总压×该组分物质的量分数)。
(保留两位有效数字;用平衡分压代替平衡浓度计算,分压=总压×该组分物质的量分数)。(5)某研究小组探究温度和催化剂对CO、NO转化率的影响。将CO和NO按物质的量之比1:1以一定的流速分别通过两种催化剂(Cat-1和Cat-2)进行反应,相同时间内测量逸出气体中NO的含量,从而确定尾气脱氮率(即NO的转化率),结果如图所示:
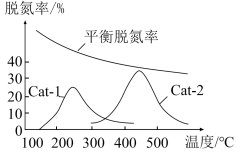
②催化剂Cat-2条件下,450℃后,脱氮率随温度升高而下降的原因是
您最近一年使用:0次
2024-01-13更新
|
323次组卷
|
3卷引用:四川省德阳外国语学校2023-2024学年高二下学期入学考试化学试题
名校
解题方法
5 . 一氧化二氮可以用作火箭氧化剂,在室温下稳定,易于储存和飞行使用。现利用汽车尾气中的NO与H2反应来制备N2O气体,回答下列问题。
(1)已知:H2的燃烧热为286kJ·mol-1
①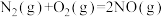 ΔH1=+180kJ·mol-1
ΔH1=+180kJ·mol-1
② ΔH2=+164kJ·mol-1
ΔH2=+164kJ·mol-1
③ ΔH3=+44kJ·mol-1
ΔH3=+44kJ·mol-1
反应 的ΔH=
的ΔH=_____ kJ·mol-1.
(2)总反应分为两步进行:
第①步:2NO(g)=N2O2(g)。
第②步:_____ 。
实验发现,第①步反应几乎不影响总反应到达平衡所用的时间,由此推断,下列关于该反应叙述正确的是_____ 。(填序号)
A.更换催化剂,可改变反应的ΔH
B.步骤①的逆反应活化能一定小于②的
C.步骤②的有效碰撞频率小于步骤①
D.反应进程中N2O2属于中间产物
(3)在1093K时,NO与H2以物质的量之比为2:1混合置于某密闭容器中,在恒温恒压(100kPa)的条件下,发生反应 。达到平衡时,测得N2O的体积分数为20%,该平衡的Kp=
。达到平衡时,测得N2O的体积分数为20%,该平衡的Kp=_____ (以分压表示,分压=总压×物质的量分数)。
(4)既能提高NO的平衡转化率又能加快反应的速率,可采取的措施是(举两种)_____ 。
(1)已知:H2的燃烧热为286kJ·mol-1
①
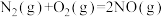 ΔH1=+180kJ·mol-1
ΔH1=+180kJ·mol-1 ②
 ΔH2=+164kJ·mol-1
ΔH2=+164kJ·mol-1③
 ΔH3=+44kJ·mol-1
ΔH3=+44kJ·mol-1反应
 的ΔH=
的ΔH=(2)总反应分为两步进行:
第①步:2NO(g)=N2O2(g)。
第②步:
实验发现,第①步反应几乎不影响总反应到达平衡所用的时间,由此推断,下列关于该反应叙述正确的是
A.更换催化剂,可改变反应的ΔH
B.步骤①的逆反应活化能一定小于②的
C.步骤②的有效碰撞频率小于步骤①
D.反应进程中N2O2属于中间产物
(3)在1093K时,NO与H2以物质的量之比为2:1混合置于某密闭容器中,在恒温恒压(100kPa)的条件下,发生反应
 。达到平衡时,测得N2O的体积分数为20%,该平衡的Kp=
。达到平衡时,测得N2O的体积分数为20%,该平衡的Kp=(4)既能提高NO的平衡转化率又能加快反应的速率,可采取的措施是(举两种)
您最近一年使用:0次
名校
解题方法
6 . 硫酸的消耗量是衡量一个国家化学工业发展水平的标志。以黄铁矿(主要成分为FeS2)为原料生产H2SO4和Na2S2O5。

请回答下列问题:
(1)FeS2中铁元素的化合价为________ 。
(2)若要增大煅烧过程的反应速率,可采取的措施是________ (任写一条即可)。
(3)若要检验Na2S2O5是否变质生成了Na2SO4,所用的试剂是________ 。
(4)“氧化”时反应的方程式为,2SO2(g)+O2(g) 2SO3(g) △H=-196.6kJ•mol-1。
2SO3(g) △H=-196.6kJ•mol-1。
①在一定温度下,将2molSO2和1molO2放入容积为2L的密闭容器中反应,达到平衡时,测得容器内O2的物质的量浓度为0.2mol•L-1,则该反应的平衡常数为________ 。
②如表列出了在不同温度和压强下,反应达到平衡时SO2的转化率,从化学反应速率、化学平衡及生产成本、产量等角度综合分析,在实际生产中有关该反应适宜条件选择的说法不正确的有________ 。
a.SO2的转化率与温度成反比,故采用尽可能低的温度
b.该反应在450℃左右、0.1MPa(常压)下进行较为合适
c.SO2的转化率与压强成正比,故采用尽可能高的压强
d.为了提高的SO2的转化率,应使用合适的催化剂

请回答下列问题:
(1)FeS2中铁元素的化合价为
(2)若要增大煅烧过程的反应速率,可采取的措施是
(3)若要检验Na2S2O5是否变质生成了Na2SO4,所用的试剂是
(4)“氧化”时反应的方程式为,2SO2(g)+O2(g)
 2SO3(g) △H=-196.6kJ•mol-1。
2SO3(g) △H=-196.6kJ•mol-1。①在一定温度下,将2molSO2和1molO2放入容积为2L的密闭容器中反应,达到平衡时,测得容器内O2的物质的量浓度为0.2mol•L-1,则该反应的平衡常数为
②如表列出了在不同温度和压强下,反应达到平衡时SO2的转化率,从化学反应速率、化学平衡及生产成本、产量等角度综合分析,在实际生产中有关该反应适宜条件选择的说法不正确的有
| 温度/℃ | 平衡时的转化率 | ||||
| 0.1MPa | 0.5MPa | 1MPa | 5MPa | 10MPa | |
| 450 | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
| 550 | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
b.该反应在450℃左右、0.1MPa(常压)下进行较为合适
c.SO2的转化率与压强成正比,故采用尽可能高的压强
d.为了提高的SO2的转化率,应使用合适的催化剂
您最近一年使用:0次
7 . 从衣食住行到探索浩瀚宇宙,都有氮及其化合物的参与,但同时有毒含氮化合物的排放,也对环境产生污染。如何实现环境保护与资源利用的和谐统一,已成为我们的重要研究课题。
(1)工业上利用 和
和 可以合成
可以合成 ,
, 又可以进一步制备火箭燃料肼
又可以进一步制备火箭燃料肼 。
。
①
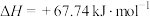
②
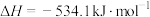
③
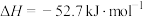
写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:_____ 。
(2) 的水溶液呈弱碱性,室温下其电离常数
的水溶液呈弱碱性,室温下其电离常数 ,则
,则 的
的 水溶液pH等于
水溶液pH等于_____ (忽略 的二级电离和
的二级电离和 的电离,
的电离,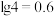 )。
)。
(3)利用测压法在刚性密闭容器中研究 ℃时
℃时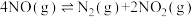 的分解反应,现将一定量的NO充入该密闭容器中,测得体系的总压强随时间的变化如下表所示:
的分解反应,现将一定量的NO充入该密闭容器中,测得体系的总压强随时间的变化如下表所示:
①0~20min时,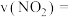
_____  。
。
② ℃时
℃时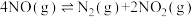 反应的平衡常数
反应的平衡常数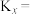
_____ ( 为以物质的量分数表示的平衡常数)。若升高温度,
为以物质的量分数表示的平衡常数)。若升高温度, 的物质的量分数将
的物质的量分数将_____ (填“增大”“减小”或“不变”)。
(4)将等物质的量的NO和CO分别充入盛有催化剂①和②的体积相同的刚性容器,进行反应
 ,经过相同时间测得NO的转化率如图所示,图中cd段转化率下降的可能原因是(答2条)①
,经过相同时间测得NO的转化率如图所示,图中cd段转化率下降的可能原因是(答2条)①_____ ,②_____ 。
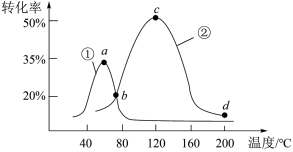
(5)工业上常采用的耦合技术指的是在一套设备中同时进行多单元生成操作,从而使流程和设备简化,反应能耗降低,获得更大产品收率。我国科学家设计了 与氯碱耦合电解池装置如图(图中物质只表示电极上的反应)。
与氯碱耦合电解池装置如图(图中物质只表示电极上的反应)。
①该装置中的离子交换膜为_____ (填“阴”或“阳”)离子交换膜。
②该电解池发生的总反应的化学方程式为_____ 。
(1)工业上利用
 和
和 可以合成
可以合成 ,
, 又可以进一步制备火箭燃料肼
又可以进一步制备火箭燃料肼 。
。①

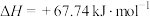
②

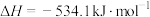
③

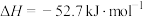
写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:
(2)
 的水溶液呈弱碱性,室温下其电离常数
的水溶液呈弱碱性,室温下其电离常数 ,则
,则 的
的 水溶液pH等于
水溶液pH等于 的二级电离和
的二级电离和 的电离,
的电离, )。
)。(3)利用测压法在刚性密闭容器中研究
 ℃时
℃时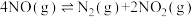 的分解反应,现将一定量的NO充入该密闭容器中,测得体系的总压强随时间的变化如下表所示:
的分解反应,现将一定量的NO充入该密闭容器中,测得体系的总压强随时间的变化如下表所示:| 反应时间/min | 0 | 10 | 20 | 30 | 40 |
| 压强/MPa | 15.00 | 14.02 | 13.20 | 12.50 | 12.50 |
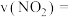
 。
。②
 ℃时
℃时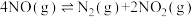 反应的平衡常数
反应的平衡常数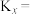
 为以物质的量分数表示的平衡常数)。若升高温度,
为以物质的量分数表示的平衡常数)。若升高温度, 的物质的量分数将
的物质的量分数将(4)将等物质的量的NO和CO分别充入盛有催化剂①和②的体积相同的刚性容器,进行反应

 ,经过相同时间测得NO的转化率如图所示,图中cd段转化率下降的可能原因是(答2条)①
,经过相同时间测得NO的转化率如图所示,图中cd段转化率下降的可能原因是(答2条)①

(5)工业上常采用的耦合技术指的是在一套设备中同时进行多单元生成操作,从而使流程和设备简化,反应能耗降低,获得更大产品收率。我国科学家设计了
 与氯碱耦合电解池装置如图(图中物质只表示电极上的反应)。
与氯碱耦合电解池装置如图(图中物质只表示电极上的反应)。①该装置中的离子交换膜为
②该电解池发生的总反应的化学方程式为
您最近一年使用:0次
8 . 随着我国碳达峰、碳中和目标的确定,二氧化碳资源化利用倍受关注。以 和
和 为原料合成尿素
为原料合成尿素
 。合成尿素反应分两步完成,其能量变化如下图所示:
。合成尿素反应分两步完成,其能量变化如下图所示:
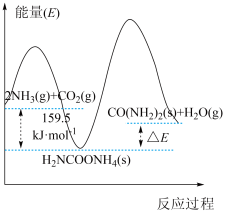
(1)第一步: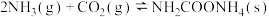

第二步: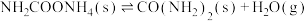

①图中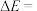
___________ kJ/mol。(用 或
或 代数表达式)
代数表达式)
②反应速率较快的是反应___________ (填“第一步”或“第二步”),原因是___________ 。
③能加快正反应速率且能提高 平衡转化率的措施是
平衡转化率的措施是___________ (填序号)
A.高温 B.降低 浓度 C.高压 D.分离出尿素 E.催化剂
浓度 C.高压 D.分离出尿素 E.催化剂
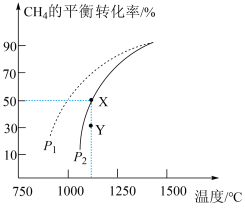
(2)在恒容密闭容器中通入物质的量均为0.2mol 的 和
和 ,在一定条件下发生反应
,在一定条件下发生反应
 ,
, 的平衡转化率随温度、压强的变化关系如图所示。
的平衡转化率随温度、压强的变化关系如图所示。
①若反应在恒温、恒容密闭容器中进行,下列叙述能说明反应到达平衡状态的是___________ (填序号)。
A. 和
和 的物质的量之比保持不变时 B.CO和
的物质的量之比保持不变时 B.CO和 的浓度相等时
的浓度相等时
C.反应速率: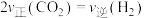 D.同时断裂1mol C-H键和2mol H-H键
D.同时断裂1mol C-H键和2mol H-H键
②由图乙可知,压强
___________  (填“>”“<”或“=”,下同);Y点速率
(填“>”“<”或“=”,下同);Y点速率
___________  。
。
③将上述反应放在恒温恒容密闭容器中反应,测得起始压强为 ,反应后甲烷转换率为50%。已知气体分压=气体总压×气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数
,反应后甲烷转换率为50%。已知气体分压=气体总压×气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数 ,则X点对应温度下的
,则X点对应温度下的
___________ (用含 的代数式表示)。
的代数式表示)。
 和
和 为原料合成尿素
为原料合成尿素
 。合成尿素反应分两步完成,其能量变化如下图所示:
。合成尿素反应分两步完成,其能量变化如下图所示:
(1)第一步:
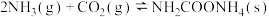

第二步:
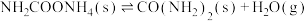

①图中
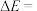
 或
或 代数表达式)
代数表达式)②反应速率较快的是反应
③能加快正反应速率且能提高
 平衡转化率的措施是
平衡转化率的措施是A.高温 B.降低
 浓度 C.高压 D.分离出尿素 E.催化剂
浓度 C.高压 D.分离出尿素 E.催化剂(2)在恒容密闭容器中通入物质的量均为0.2mol 的
 和
和 ,在一定条件下发生反应
,在一定条件下发生反应
 ,
, 的平衡转化率随温度、压强的变化关系如图所示。
的平衡转化率随温度、压强的变化关系如图所示。
①若反应在恒温、恒容密闭容器中进行,下列叙述能说明反应到达平衡状态的是
A.
 和
和 的物质的量之比保持不变时 B.CO和
的物质的量之比保持不变时 B.CO和 的浓度相等时
的浓度相等时C.反应速率:
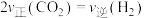 D.同时断裂1mol C-H键和2mol H-H键
D.同时断裂1mol C-H键和2mol H-H键②由图乙可知,压强

 (填“>”“<”或“=”,下同);Y点速率
(填“>”“<”或“=”,下同);Y点速率
 。
。③将上述反应放在恒温恒容密闭容器中反应,测得起始压强为
 ,反应后甲烷转换率为50%。已知气体分压=气体总压×气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数
,反应后甲烷转换率为50%。已知气体分压=气体总压×气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数 ,则X点对应温度下的
,则X点对应温度下的
 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
2023-09-26更新
|
515次组卷
|
3卷引用:四川省绵阳南山中学2023-2024学年高三上学期综合演练(三)理综化学试题
解题方法
9 . CH3OH是一种绿色燃料,可由CO或CO2制备。工业上制备CH3OH发生如下反应:反应1:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.5kJ/mol
CH3OH(g)+H2O(g) ΔH=-49.5kJ/mol
反应2:CO2(g)+H2(g) CO(g)+H2O(g) ΔH=+41.2kJ/mol
CO(g)+H2O(g) ΔH=+41.2kJ/mol
请回答:
(1)CO(g)+2H2(g) CH3OH(g),该反应的ΔH=
CH3OH(g),该反应的ΔH=___________ kJ/mol。
(2)将CO2和H2按1︰3通入密闭容器中发生反应1和反应2,改变反应温度,分别测得1MPa、3MPa、5MPa下CO2的平衡转化率(α)以及3MPa时生成CH3OH、CO选择性(S)的变化如图甲(选择性为目标产物在总产物中的比率)。___________ (填“a”“b”或“c”)。
②随着温度升高,a、b、c三条曲线接近重合的原因是___________ 。
③P点对应的反应2的平衡常数Kp=___________ 。
④分子筛膜反应器可提高反应1的平衡转化率,原理如图乙所示。分子筛膜反应器可提高转化率的原因是___________ 。__________
 CH3OH(g)+H2O(g) ΔH=-49.5kJ/mol
CH3OH(g)+H2O(g) ΔH=-49.5kJ/mol反应2:CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH=+41.2kJ/mol
CO(g)+H2O(g) ΔH=+41.2kJ/mol请回答:
(1)CO(g)+2H2(g)
 CH3OH(g),该反应的ΔH=
CH3OH(g),该反应的ΔH=(2)将CO2和H2按1︰3通入密闭容器中发生反应1和反应2,改变反应温度,分别测得1MPa、3MPa、5MPa下CO2的平衡转化率(α)以及3MPa时生成CH3OH、CO选择性(S)的变化如图甲(选择性为目标产物在总产物中的比率)。

②随着温度升高,a、b、c三条曲线接近重合的原因是
③P点对应的反应2的平衡常数Kp=
④分子筛膜反应器可提高反应1的平衡转化率,原理如图乙所示。分子筛膜反应器可提高转化率的原因是


您最近一年使用:0次
名校
解题方法
10 . 合理利用温室气体是当前能源与环境研究的热点。 催化加氢可缓解
催化加氢可缓解 对温室效应的影响,其原理为:
对温室效应的影响,其原理为:
反应Ⅰ:

反应Ⅱ:
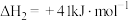
(1)已知 相关物质的燃烧热数据如下表:
相关物质的燃烧热数据如下表:
已知
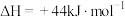 ,则
,则
___________  。
。
(2)反应II的
___________ 0(填“>”、“<”或“=”)请说明理由___________
(3)反应II中,正反应速率: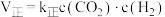 ,逆反应速率:
,逆反应速率: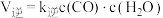 ,其中
,其中 、
、 分别为正、逆反应速率常数,仅受温度影响。下图(
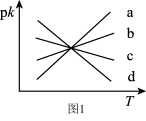
分别为正、逆反应速率常数,仅受温度影响。下图(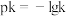 ,T表示温度)所示a、b、c、d四条斜线中,有两条分别为
,T表示温度)所示a、b、c、d四条斜线中,有两条分别为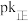 和
和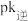 随T变化斜线,则表示
随T变化斜线,则表示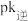 随T变化关系的斜线是
随T变化关系的斜线是___________ 。
(4)在 下,将
下,将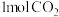 和
和 充入
充入 刚性密闭容器中,反应相同时间,温度对
刚性密闭容器中,反应相同时间,温度对 转化率如图所示。
转化率如图所示。

①解释 转化率在高于
转化率在高于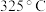 时,随温度升高先减小后增大的原因
时,随温度升高先减小后增大的原因___________ 。
②假设只发生反应Ⅱ,当 平衡产率为
平衡产率为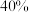 时,此时总压为
时,此时总压为 。计算该温度下反应II的平衡常数
。计算该温度下反应II的平衡常数 为
为___________ 。(计算结果用分数表示,用平衡分压代替平衡浓度计算,分压=总压 物质的量分数)
物质的量分数)
 催化加氢可缓解
催化加氢可缓解 对温室效应的影响,其原理为:
对温室效应的影响,其原理为:反应Ⅰ:


反应Ⅱ:

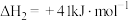
(1)已知
 相关物质的燃烧热数据如下表:
相关物质的燃烧热数据如下表:| 物质 |  |  |
燃烧热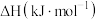 |  |  |

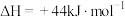 ,则
,则
 。
。(2)反应II的

(3)反应II中,正反应速率:
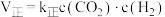 ,逆反应速率:
,逆反应速率: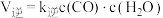 ,其中
,其中 、
、 分别为正、逆反应速率常数,仅受温度影响。下图(
分别为正、逆反应速率常数,仅受温度影响。下图( ,T表示温度)所示a、b、c、d四条斜线中,有两条分别为
,T表示温度)所示a、b、c、d四条斜线中,有两条分别为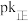 和
和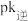 随T变化斜线,则表示
随T变化斜线,则表示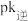 随T变化关系的斜线是
随T变化关系的斜线是
(4)在
 下,将
下,将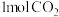 和
和 充入
充入 刚性密闭容器中,反应相同时间,温度对
刚性密闭容器中,反应相同时间,温度对 转化率如图所示。
转化率如图所示。
①解释
 转化率在高于
转化率在高于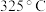 时,随温度升高先减小后增大的原因
时,随温度升高先减小后增大的原因②假设只发生反应Ⅱ,当
 平衡产率为
平衡产率为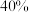 时,此时总压为
时,此时总压为 。计算该温度下反应II的平衡常数
。计算该温度下反应II的平衡常数 为
为 物质的量分数)
物质的量分数)
您最近一年使用:0次
2023-08-21更新
|
406次组卷
|
3卷引用:四川省泸州市泸县第四中学2023-2024学年高二上学期10月月考化学试题



