名校
解题方法
1 . Ⅰ.甲醇是一种可再生能源,具有广泛的开发和应用前景。
工业上用CO为原料生产燃料甲醇,一定条件下发生反应
(1)由图甲可知该反应使用催化剂的途径是___________ (填写“a”或“b”),反应的热化学方程式是___________ 。
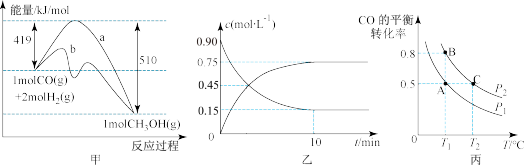
(2)图乙是反应 中部分物质的浓度随时间t的变化情况,
中部分物质的浓度随时间t的变化情况, 内,用
内,用 表示的平均反应速率
表示的平均反应速率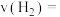
___________
(3)容积可变的密闭容器中充入 和
和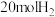 ,发生反应
,发生反应 ,
, 的平衡转化率随温度(T)、压强(ρ)的变化如图丙所示。
的平衡转化率随温度(T)、压强(ρ)的变化如图丙所示。
①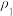
___________ 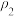 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
②比较图丙中A、B、C三点平衡常数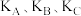 的大小:
的大小:___________ (从大到小排列)。
③若达到化学平衡状态点A时,容器的体积为20L,T1℃时平衡常数
___________ 。
Ⅱ.根据表中数据回答问题:
表1:25℃时浓度为 两种溶液的
两种溶液的
表2:25℃时两种酸的电离平衡常数
(4)①根据表1能不能判断出 与
与 的酸性强弱?
的酸性强弱?___________ (填“能”或“不能”)。
② 溶液中离子浓度由大到小的顺序为
溶液中离子浓度由大到小的顺序为___________
③ 溶液和
溶液和 溶液反应的离子方程式为
溶液反应的离子方程式为___________
(5)已知:t℃时, 为白色沉淀,
为白色沉淀, 为砖红色沉淀,在
为砖红色沉淀,在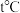 时,向
时,向 和
和 浓度均为
浓度均为 的混合溶液中逐滴加入
的混合溶液中逐滴加入 溶液至过量且不断搅拌,实验现象为
溶液至过量且不断搅拌,实验现象为___________ 。
工业上用CO为原料生产燃料甲醇,一定条件下发生反应

(1)由图甲可知该反应使用催化剂的途径是

(2)图乙是反应
 中部分物质的浓度随时间t的变化情况,
中部分物质的浓度随时间t的变化情况, 内,用
内,用 表示的平均反应速率
表示的平均反应速率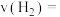
(3)容积可变的密闭容器中充入
 和
和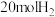 ,发生反应
,发生反应 ,
, 的平衡转化率随温度(T)、压强(ρ)的变化如图丙所示。
的平衡转化率随温度(T)、压强(ρ)的变化如图丙所示。①
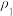
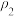 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。②比较图丙中A、B、C三点平衡常数
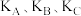 的大小:
的大小:③若达到化学平衡状态点A时,容器的体积为20L,T1℃时平衡常数

Ⅱ.根据表中数据回答问题:
表1:25℃时浓度为
 两种溶液的
两种溶液的
| 溶质 |  |  |
 | 9.7 | 11.6 |
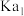 | 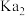 | |
 | 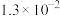 | 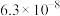 |
 | 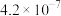 | 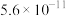 |
(4)①根据表1能不能判断出
 与
与 的酸性强弱?
的酸性强弱?②
 溶液中离子浓度由大到小的顺序为
溶液中离子浓度由大到小的顺序为③
 溶液和
溶液和 溶液反应的离子方程式为
溶液反应的离子方程式为(5)已知:t℃时,
 为白色沉淀,
为白色沉淀, 为砖红色沉淀,在
为砖红色沉淀,在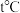 时,向
时,向 和
和 浓度均为
浓度均为 的混合溶液中逐滴加入
的混合溶液中逐滴加入 溶液至过量且不断搅拌,实验现象为
溶液至过量且不断搅拌,实验现象为
您最近一年使用:0次
2024-01-21更新
|
337次组卷
|
2卷引用:广西柳州铁一中学2023-2024学年高二上学期10月校际交流联考化学试卷
名校
2 . 十九大报告指出:“坚持全民共治、源头防治,持续实施大气污染防治行动,打赢蓝天保卫战 ”,因此研究
”,因此研究 等大气污染物的处理方法具有重要意义。
等大气污染物的处理方法具有重要意义。
(1)汽车尾气中的 和
和 在一定条件下可发生如下反应:
在一定条件下可发生如下反应:
反应a:
反应b:
① 的燃烧热为
的燃烧热为 ,则
,则
_______ 。
②某科研小组尝试利用固体表面催化工艺进行 的分解。若用
的分解。若用 和
和 分别表示
分别表示 、
、 、
、 和固体催化剂,在固体催化剂表面分解
和固体催化剂,在固体催化剂表面分解 的过程如图所示。从吸附到解吸的过程中,能量状态最低的是
的过程如图所示。从吸附到解吸的过程中,能量状态最低的是_______ (填字母序号)。 、
、 转化的影响。将
转化的影响。将 和
和 以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中
以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中 的含量,从而确定尾气脱氮率(脱氮率即
的含量,从而确定尾气脱氮率(脱氮率即 的转化率),结果如图
的转化率),结果如图 所示。若低于
所示。若低于 ,图
,图 中曲线Ⅰ脱氮率随温度升高而变化不大的主要原因为
中曲线Ⅰ脱氮率随温度升高而变化不大的主要原因为_______ ; 点是否为对应温度下的平衡脱氮率,说明其理由
点是否为对应温度下的平衡脱氮率,说明其理由_______ 。 作为还原剂脱硝
作为还原剂脱硝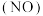 ,脱硝机理如图
,脱硝机理如图 ,则总反应的化学方程式为
,则总反应的化学方程式为_______ 。 温度时在容积为2L的恒容密闭容器中发生反应:
温度时在容积为2L的恒容密闭容器中发生反应:
 ,实验测得:υ(正)=υ(NO)消耗=2υ(O2)消耗=k(正)c2(NO)c(O2),υ(逆)=υ(NO2)消耗=k(逆)c2(NO2),k(正)、k(逆)为速率常数只受温度影响。不同时刻测得容器中
,实验测得:υ(正)=υ(NO)消耗=2υ(O2)消耗=k(正)c2(NO)c(O2),υ(逆)=υ(NO2)消耗=k(逆)c2(NO2),k(正)、k(逆)为速率常数只受温度影响。不同时刻测得容器中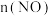 、
、 如下表:
如下表:
 温度时
温度时 =
=______ L∙mol−1。
②若将容器的温度改变为 时其
时其 ,则
,则
_______ (填“ ”“
”“ ”或“
”或“ ”)
”) 。
。
 ”,因此研究
”,因此研究 等大气污染物的处理方法具有重要意义。
等大气污染物的处理方法具有重要意义。(1)汽车尾气中的
 和
和 在一定条件下可发生如下反应:
在一定条件下可发生如下反应:反应a:

反应b:

①
 的燃烧热为
的燃烧热为 ,则
,则
②某科研小组尝试利用固体表面催化工艺进行
 的分解。若用
的分解。若用 和
和 分别表示
分别表示 、
、 、
、 和固体催化剂,在固体催化剂表面分解
和固体催化剂,在固体催化剂表面分解 的过程如图所示。从吸附到解吸的过程中,能量状态最低的是
的过程如图所示。从吸附到解吸的过程中,能量状态最低的是
 、
、 转化的影响。将
转化的影响。将 和
和 以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中
以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中 的含量,从而确定尾气脱氮率(脱氮率即
的含量,从而确定尾气脱氮率(脱氮率即 的转化率),结果如图
的转化率),结果如图 所示。若低于
所示。若低于 ,图
,图 中曲线Ⅰ脱氮率随温度升高而变化不大的主要原因为
中曲线Ⅰ脱氮率随温度升高而变化不大的主要原因为 点是否为对应温度下的平衡脱氮率,说明其理由
点是否为对应温度下的平衡脱氮率,说明其理由
 作为还原剂脱硝
作为还原剂脱硝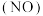 ,脱硝机理如图
,脱硝机理如图 ,则总反应的化学方程式为
,则总反应的化学方程式为
 温度时在容积为2L的恒容密闭容器中发生反应:
温度时在容积为2L的恒容密闭容器中发生反应:
 ,实验测得:υ(正)=υ(NO)消耗=2υ(O2)消耗=k(正)c2(NO)c(O2),υ(逆)=υ(NO2)消耗=k(逆)c2(NO2),k(正)、k(逆)为速率常数只受温度影响。不同时刻测得容器中
,实验测得:υ(正)=υ(NO)消耗=2υ(O2)消耗=k(正)c2(NO)c(O2),υ(逆)=υ(NO2)消耗=k(逆)c2(NO2),k(正)、k(逆)为速率常数只受温度影响。不同时刻测得容器中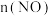 、
、 如下表:
如下表:时间 |  |  |  |  |  |
 |  | 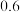 | 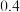 |  |  |
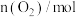 | 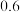 | 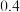 |  |  |  |
 温度时
温度时 =
=②若将容器的温度改变为
 时其
时其 ,则
,则
 ”“
”“ ”或“
”或“ ”)
”) 。
。
您最近一年使用:0次
3 . 随着我国碳达峰、碳中和目标的确定,二氧化碳资源化利用倍受关注。
I.以CO2和NH3为原料合成尿素2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g) ∆H= -87 kJ/mol。
CO(NH2)2(s)+H2O(g) ∆H= -87 kJ/mol。
(1)有利于提高CO2平衡转化率的措施是_______(填序号)。
(2)研究发现,合成尿素反应分两步完成,其能量变化如图甲所示: NH2COONH4(s) ∆H1
NH2COONH4(s) ∆H1
第二步:NH2COONH4(s) CO(NH2)2(s)+H2O(g) ∆H2
CO(NH2)2(s)+H2O(g) ∆H2
①图中ΔE=_______ kJ/mol。
②反应速率较快的是_______ 反应(填“第一步”或“第二步”)。
II.以CO2和CH4催化重整制备合成气:CO2(g)+CH4(g) 2CO(g)+ 2H2(g)。
(3)在密闭容器中通入物质的量均为0.2 mol的CH4和CO2,在一定条件下发生反应CH4(g) +CO2 (g) 2CO (g)+2H2(g),CH4的平衡转化率随温度、压强的变化关系如图乙所示。
2CO (g)+2H2(g),CH4的平衡转化率随温度、压强的变化关系如图乙所示。_______ (填序号)。
A.容器中混合气体的密度保持不变
B.容器内混合气体的压强保持不变
C.n(CO2)=n (CH4)
D.同时断裂2molC- H键和1 molH-H键
②由图乙可知,Y点速率v正_______ v逆(填“>”“<”或“=”,下同)。
③已知气体分压=气体总压x气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数Kp,则X点对应温度下的Kp=_______ (用含P2的代数式表示)。
III.电化学法还原二氧化碳制乙烯在强酸性溶液中通入二氧化碳,用惰性电极进行电解可制得乙烯,其原理如图丙所示:_______ ,该装置中使用的是_______ (填“阴”或“阳”)离子交换膜。
I.以CO2和NH3为原料合成尿素2NH3(g)+CO2(g)
 CO(NH2)2(s)+H2O(g) ∆H= -87 kJ/mol。
CO(NH2)2(s)+H2O(g) ∆H= -87 kJ/mol。(1)有利于提高CO2平衡转化率的措施是_______(填序号)。
| A.高温低压 | B.低温高压 | C.高温高压 | D.低温低压 |

 NH2COONH4(s) ∆H1
NH2COONH4(s) ∆H1第二步:NH2COONH4(s)
 CO(NH2)2(s)+H2O(g) ∆H2
CO(NH2)2(s)+H2O(g) ∆H2①图中ΔE=
②反应速率较快的是
II.以CO2和CH4催化重整制备合成气:CO2(g)+CH4(g) 2CO(g)+ 2H2(g)。
(3)在密闭容器中通入物质的量均为0.2 mol的CH4和CO2,在一定条件下发生反应CH4(g) +CO2 (g)
 2CO (g)+2H2(g),CH4的平衡转化率随温度、压强的变化关系如图乙所示。
2CO (g)+2H2(g),CH4的平衡转化率随温度、压强的变化关系如图乙所示。
A.容器中混合气体的密度保持不变
B.容器内混合气体的压强保持不变
C.n(CO2)=n (CH4)
D.同时断裂2molC- H键和1 molH-H键
②由图乙可知,Y点速率v正
③已知气体分压=气体总压x气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数Kp,则X点对应温度下的Kp=
III.电化学法还原二氧化碳制乙烯在强酸性溶液中通入二氧化碳,用惰性电极进行电解可制得乙烯,其原理如图丙所示:

您最近一年使用:0次
2023-04-26更新
|
429次组卷
|
2卷引用:2023届广西钦州市灵山县那隆中学高三下学期5月考前冲刺保温卷理综试卷-高中化学
名校
解题方法
4 . Ⅰ.甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列两种反应合成甲醇
反应①:CO(g)+2H2(g)⇌CH3OH(g) △H1
反应②:CO2(g)+3H2(g)⇌CH3OH(g)+ H2O(g) △H2
下表所列数据是反应①在不同温度下的化学平衡常数(K):
温度 | 250℃ | 300℃ | 350℃ |
K | 2.0 | 0.27 | 0.012 |
(1)由表中数据判断△H1
(2)反应CO2(g)+H2(g)⇌CO(g)+H2O(g) △H3=
Ⅱ.合成氨工业对国民经济和社会发展具有重要的意义。其原理为:N2(g)+3H2(g)⇌2NH3(g) △H=-92.4kJ/mol。据此回答以下问题:
(3)某温度下,若把2molN2与6molH2
 置于体积为2L的密闭容器内,反应1min达到平衡状态时,能说明该反应达到化学平衡状态的是
置于体积为2L的密闭容器内,反应1min达到平衡状态时,能说明该反应达到化学平衡状态的是a. 容器内的密度保持不变 b. 容器内压强保持不变
c. 3υ正(H2)=2υ逆(NH3) d.混合气体的平均摩尔质量不变
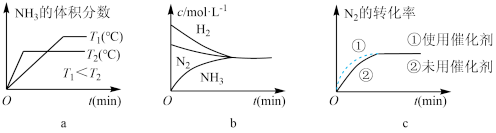
(4)对于合成氨反应而言,下列有关图像一定正确的是(选填序号)
(5)相同温度下,有恒容密闭容器
 和恒压密闭容器
和恒压密闭容器 ,两容器中均充入
,两容器中均充入 和
和 ,此时两容器的体积相等。在一定条件下反应达到平衡状态,
,此时两容器的体积相等。在一定条件下反应达到平衡状态, 中
中 的体积分数为
的体积分数为 ,放出热量为Q1,B中
,放出热量为Q1,B中 的体积分数为
的体积分数为 ,放出热量为Q2。则:a
,放出热量为Q2。则:a ”或“<”,下同)Q1
”或“<”,下同)Q1
您最近一年使用:0次
2023-03-07更新
|
245次组卷
|
2卷引用:广西壮族自治区玉林市第一中学2022-2023学年高二上学期期末考试化学试题
名校
解题方法
5 . 氢能是极具发展潜力的清洁能源,以氢燃料为代表的燃料电池有良好的应用前景。
(1) 时,
时,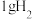 燃烧生成
燃烧生成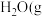 )放热
)放热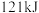 ,
, 蒸发吸热
蒸发吸热 ,表示
,表示 燃烧热的热化学方程式为
燃烧热的热化学方程式为___________ 。
(2)工业上常用甲烷水蒸气重整制备氢气,体系中发生如下反应。
Ⅰ、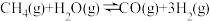
Ⅱ、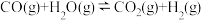
①下列操作中,能提高 平衡转化率的是
平衡转化率的是___________ (填标号)。
A.增加 用量B.恒温恒压下通入惰性气体C.移除
用量B.恒温恒压下通入惰性气体C.移除 D.加入催化剂
D.加入催化剂
②恒温恒压条件下,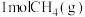 和
和 反应达平衡时,
反应达平衡时, 的转化率为a,
的转化率为a, 的物质的量为
的物质的量为 ,则反应Ⅰ的平衡常数
,则反应Ⅰ的平衡常数
___________ (写出含有a、b的计算式;对于反应 ,
,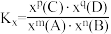 ,x为物质的量分数)。
,x为物质的量分数)。
(3)氢氧燃料电池中氢气在___________ (填“正”或“负”)极发生反应。
(4)在允许 自由迁移的固体电解质燃料电池中,
自由迁移的固体电解质燃料电池中,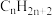 放电的电极反应式为
放电的电极反应式为___________ 。
(5)甲醇燃料电池中,吸附在催化剂表面的甲醇分子逐步脱氢得到CO,四步可能脱氢产物及其相对能量如图,则最可行途径为a→___________ (用 等代号表示)。
等代号表示)。
(1)
 时,
时,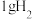 燃烧生成
燃烧生成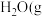 )放热
)放热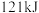 ,
, 蒸发吸热
蒸发吸热 ,表示
,表示 燃烧热的热化学方程式为
燃烧热的热化学方程式为(2)工业上常用甲烷水蒸气重整制备氢气,体系中发生如下反应。
Ⅰ、
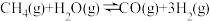
Ⅱ、
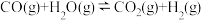
①下列操作中,能提高
 平衡转化率的是
平衡转化率的是A.增加
 用量B.恒温恒压下通入惰性气体C.移除
用量B.恒温恒压下通入惰性气体C.移除 D.加入催化剂
D.加入催化剂②恒温恒压条件下,
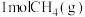 和
和 反应达平衡时,
反应达平衡时, 的转化率为a,
的转化率为a, 的物质的量为
的物质的量为 ,则反应Ⅰ的平衡常数
,则反应Ⅰ的平衡常数
 ,
,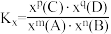 ,x为物质的量分数)。
,x为物质的量分数)。(3)氢氧燃料电池中氢气在
(4)在允许
 自由迁移的固体电解质燃料电池中,
自由迁移的固体电解质燃料电池中,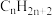 放电的电极反应式为
放电的电极反应式为(5)甲醇燃料电池中,吸附在催化剂表面的甲醇分子逐步脱氢得到CO,四步可能脱氢产物及其相对能量如图,则最可行途径为a→
 等代号表示)。
等代号表示)。
您最近一年使用:0次
2023-03-02更新
|
372次组卷
|
3卷引用:广西壮族自治区南宁市第二中学2022-2023学年高二下学期期末化学考试试卷
6 . 黄血盐[亚铁氰化钾,K4Fe(CN)6]目前广泛用作食品添加剂(抗结剂),我国卫生部规定实验中黄血盐的最大使用量为10mg/kg。一种制备黄雪盐的工艺如图:
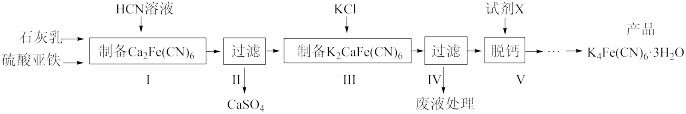
回答下列问题:
(1)步骤I反应的化学方程式为_____ 。
(2)步骤IV过滤所得的废液中含量较多的溶质为______ (填化学式)。
(3)步骤V所用的试剂X是_____ 。(填化学式)
(4)工艺中用到剧毒的HCN溶液,含CN-的废水必须处理后才能排放。
已知:HCN是一种具有苦杏仁味的无色剧毒液体,易挥发,25℃时Ka(HCN)=6.25×10-10;10-0.35=0.447;溶液中H2CO3、HCO 、CO
、CO 的存在与溶液pH的关系如图所示:
的存在与溶液pH的关系如图所示:

①NaCN中碳的化合价为______ 。
②处理含CN-废水的方法:第一步控制pH>10,用NaClO溶液先将CN-不完全氧化为OCN-;第二步控制pH为7.5~8.5,用NaClO溶液完全氧化OCN-生成N2和两种盐(其中一种用于制作面包的发酵粉)。第一步控制强碱性的主要目的是_____ ,第二步反应的离子方程式为_____ 。
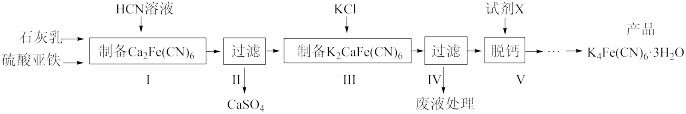
回答下列问题:
(1)步骤I反应的化学方程式为
(2)步骤IV过滤所得的废液中含量较多的溶质为
(3)步骤V所用的试剂X是
(4)工艺中用到剧毒的HCN溶液,含CN-的废水必须处理后才能排放。
已知:HCN是一种具有苦杏仁味的无色剧毒液体,易挥发,25℃时Ka(HCN)=6.25×10-10;10-0.35=0.447;溶液中H2CO3、HCO
 、CO
、CO 的存在与溶液pH的关系如图所示:
的存在与溶液pH的关系如图所示:
①NaCN中碳的化合价为
②处理含CN-废水的方法:第一步控制pH>10,用NaClO溶液先将CN-不完全氧化为OCN-;第二步控制pH为7.5~8.5,用NaClO溶液完全氧化OCN-生成N2和两种盐(其中一种用于制作面包的发酵粉)。第一步控制强碱性的主要目的是
您最近一年使用:0次
名校
7 . 以下是关于合成氨的有关问题,请回答;
(1)若在一容积为2 L的密闭容器中加入0.2 mol的 和0.6 mol的
和0.6 mol的 在一定条件下发生反应:
在一定条件下发生反应: ,
, ,若在5分钟时反应达到平衡,此时测得
,若在5分钟时反应达到平衡,此时测得 的物质的量为0.2 mol。则平衡时
的物质的量为0.2 mol。则平衡时
_______ 。平衡时 的转化率为
的转化率为_______ %。
(2)平衡后,若提高 的转化率,可以采取的措施有_______。
的转化率,可以采取的措施有_______。
(3)若在0.5 L的密闭容器中,一定量的氮气和氢气进行如下反应: ,
, ,其化学平衡常数K与温度T的关系如表所示:
,其化学平衡常数K与温度T的关系如表所示:
请完成下列问题:
①写出化学平衡常数K的表达式_______ 。
②试比较 、
、 的大小,
的大小,
_______  (填“>”、“<”或“=”);
(填“>”、“<”或“=”);
③400℃时,反应 的化学平衡常数为
的化学平衡常数为_______ 。当测得 、
、 和
和 物质的量分别为3 mol、2 mol和2 mol时,则该反应的
物质的量分别为3 mol、2 mol和2 mol时,则该反应的
_______  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(1)若在一容积为2 L的密闭容器中加入0.2 mol的
 和0.6 mol的
和0.6 mol的 在一定条件下发生反应:
在一定条件下发生反应: ,
, ,若在5分钟时反应达到平衡,此时测得
,若在5分钟时反应达到平衡,此时测得 的物质的量为0.2 mol。则平衡时
的物质的量为0.2 mol。则平衡时
 的转化率为
的转化率为(2)平衡后,若提高
 的转化率,可以采取的措施有_______。
的转化率,可以采取的措施有_______。| A.加了催化剂 | B.增大容器体积 |
| C.降低反应体系的温度 | D.加入一定量 |
 ,
, ,其化学平衡常数K与温度T的关系如表所示:
,其化学平衡常数K与温度T的关系如表所示:| T/℃ | 200 | 300 | 400 |
| K |  |  |  |
请完成下列问题:
①写出化学平衡常数K的表达式
②试比较
 、
、 的大小,
的大小,
 (填“>”、“<”或“=”);
(填“>”、“<”或“=”);③400℃时,反应
 的化学平衡常数为
的化学平衡常数为 、
、 和
和 物质的量分别为3 mol、2 mol和2 mol时,则该反应的
物质的量分别为3 mol、2 mol和2 mol时,则该反应的
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
您最近一年使用:0次
解题方法
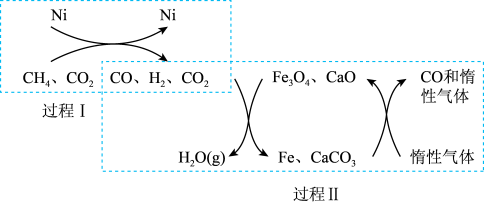
8 . 甲烷以天然气和可燃冰两种主要形式存在于地球上,储量巨大,充分利用甲烷对人类的未来发展具有重要意义。
(1)利用 、
、 在一定条件下重整的技术可得到富含CO的气体,在能源和环境上具有双重重大意义。重整过程中的催化转化原理如图所示:
在一定条件下重整的技术可得到富含CO的气体,在能源和环境上具有双重重大意义。重整过程中的催化转化原理如图所示:
已知:
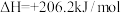

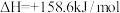
则:①过程Ⅱ中第二步反应的化学方程式为________________________ 。
②只有过程Ⅰ投料比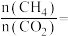
______ ,过程Ⅱ中催化剂组成才会保持不变。
③该技术总反应的热化学方程式为_________________________ 。
(2)乙炔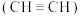 是重要的化工原料。工业上可用甲烷裂解法制取乙炔,反应为:
是重要的化工原料。工业上可用甲烷裂解法制取乙炔,反应为: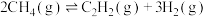 。甲烷裂解时还发生副反应:
。甲烷裂解时还发生副反应: 。甲烷裂解时,几种气体平衡时分压(Pa)的对数即lg P与温度(℃)之间的关系如图1所示。
。甲烷裂解时,几种气体平衡时分压(Pa)的对数即lg P与温度(℃)之间的关系如图1所示。
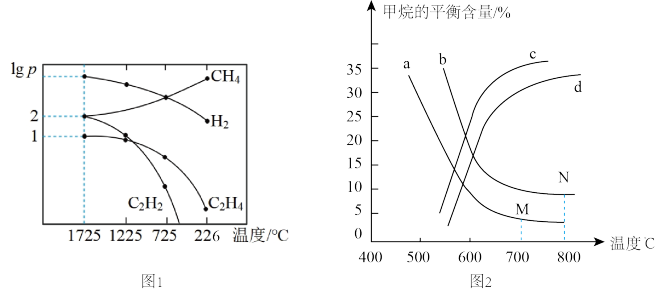
①1725℃时,向恒容密闭容器中充入 ,达到平衡时
,达到平衡时 生成
生成 的平衡转化率为
的平衡转化率为________ 。
②1725℃时,若图中 的
的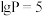 ,则反应
,则反应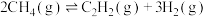 的平衡常数
的平衡常数
________ (注:用平衡分压Pa代替平衡浓度 进行计算)。
进行计算)。
③根据图判断,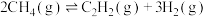

_____ 0(填“>”或“<”)。由图可知,甲烷裂解制乙炔过程中有副产物乙烯生成。为提高甲烷制乙炔的产率,除改变温度外,还可采取的措施有__________ 。
(3)工业上用甲烷和水蒸气在高温和催化剂存在的条件下制得合成气(CO、 ),发生反应为:
),发生反应为:
 图2中a、b、c、d四条曲线中的两条代表压强分别为1MPa、2MPa时甲烷含量曲线,其中表示2MPa的是
图2中a、b、c、d四条曲线中的两条代表压强分别为1MPa、2MPa时甲烷含量曲线,其中表示2MPa的是________ (填字母)。在实际生产中采用图中M点而不是N点对应的反应条件,运用化学反应速率和平衡知识,同时考虑实际生产,说明选择该反应条件的主要原因是______________ 。
(1)利用
 、
、 在一定条件下重整的技术可得到富含CO的气体,在能源和环境上具有双重重大意义。重整过程中的催化转化原理如图所示:
在一定条件下重整的技术可得到富含CO的气体,在能源和环境上具有双重重大意义。重整过程中的催化转化原理如图所示:
已知:

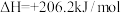

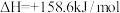
则:①过程Ⅱ中第二步反应的化学方程式为
②只有过程Ⅰ投料比
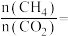
③该技术总反应的热化学方程式为
(2)乙炔
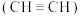 是重要的化工原料。工业上可用甲烷裂解法制取乙炔,反应为:
是重要的化工原料。工业上可用甲烷裂解法制取乙炔,反应为: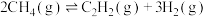 。甲烷裂解时还发生副反应:
。甲烷裂解时还发生副反应: 。甲烷裂解时,几种气体平衡时分压(Pa)的对数即lg P与温度(℃)之间的关系如图1所示。
。甲烷裂解时,几种气体平衡时分压(Pa)的对数即lg P与温度(℃)之间的关系如图1所示。
①1725℃时,向恒容密闭容器中充入
 ,达到平衡时
,达到平衡时 生成
生成 的平衡转化率为
的平衡转化率为②1725℃时,若图中
 的
的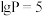 ,则反应
,则反应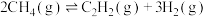 的平衡常数
的平衡常数
 进行计算)。
进行计算)。③根据图判断,

(3)工业上用甲烷和水蒸气在高温和催化剂存在的条件下制得合成气(CO、
 ),发生反应为:
),发生反应为:
 图2中a、b、c、d四条曲线中的两条代表压强分别为1MPa、2MPa时甲烷含量曲线,其中表示2MPa的是
图2中a、b、c、d四条曲线中的两条代表压强分别为1MPa、2MPa时甲烷含量曲线,其中表示2MPa的是
您最近一年使用:0次
2022-11-17更新
|
383次组卷
|
2卷引用:广西钦州市第四中学2023-2024学年高二上学期10月考试化学试卷
解题方法
9 . 利用“萨巴蒂尔反应”,空间站的水气整合系统将CO2转化为CH4和水蒸气,配合O2
生成系统可实现O2的再生。回答下列问题:
I.萨巴蒂尔反应为CO2(g)十4H2(g) CH4(g) + 2H2O(g) ∆H
CH4(g) + 2H2O(g) ∆H
(1)已知25°C和101 kPa时,①H2(g)的燃烧热△H=- 285. 8 kJ●mol-1;
②CH4(g)的燃烧热∆H=- 890. 3 kJ●mol-1;
③H2O(g)=H2O (l) ∆H=-44.0 kJ●mol-1。
则萨巴蒂尔反应的∆H=_______ kJ●mol-1。
(2)萨巴蒂尔反应的前三步反应历程如图所示,其中吸附在催化剂Pt/SiO2表面的物质用“*”标注,Ts表示过渡态。从物质吸附在催化剂表面到形成过渡态的过程会_______ (填“放出”或“吸收”)热量,反应历程中最小能垒(活化能)步骤的化学方程式为_______ 。

II.CO2在一定条件下能与H2O发生氧再生反应:CO2(g) +2H2O(g) CH4(g)+ 2O2(g) ∆H=+802.3 kJ●mol-1
CH4(g)+ 2O2(g) ∆H=+802.3 kJ●mol-1
(3)恒压p0条件下,按c(CO2) : c(H2O)=1 : 2投料,进行氧再生反应,测得不同温度下平衡时体系中各物质浓度的关系如图所示。350 ℃时,该反应的平衡常数Kp=_______ (以分压表示,分压=总压×物质的量分数)。为了提高CO2的转化率,除升高温度外,还可采取的措施为_______ (写出一条)。

(4)氧再生反应还可以通过酸性条件下半导体光催化转化实现,反应机理如图甲所示:

①光催化CO2转化为CH4时,阴极的电极反应式为_______ 。
②催化剂的催化效率和CH4的生成速率随温度的变化关系如图乙所示。300~400℃之间,CH4生成速率加快的原因是_______ 。

(5)氧再生反应所需的能量可由合成氨反应提供。合成氨反应的焓变和熵变如下:N2 (g) +3H2(g) 2NH3(g) ∆H= -92.4 kJ●mol-1 ∆S=-200J·K-1●mol-1常温(298 K)下,合成氨反应的自由能∆G=
2NH3(g) ∆H= -92.4 kJ●mol-1 ∆S=-200J·K-1●mol-1常温(298 K)下,合成氨反应的自由能∆G=_______ kJ ●mol-1, 合成氨反应在常温下_______ (填“能”或“不能”)自发进行。
生成系统可实现O2的再生。回答下列问题:
I.萨巴蒂尔反应为CO2(g)十4H2(g)
 CH4(g) + 2H2O(g) ∆H
CH4(g) + 2H2O(g) ∆H(1)已知25°C和101 kPa时,①H2(g)的燃烧热△H=- 285. 8 kJ●mol-1;
②CH4(g)的燃烧热∆H=- 890. 3 kJ●mol-1;
③H2O(g)=H2O (l) ∆H=-44.0 kJ●mol-1。
则萨巴蒂尔反应的∆H=
(2)萨巴蒂尔反应的前三步反应历程如图所示,其中吸附在催化剂Pt/SiO2表面的物质用“*”标注,Ts表示过渡态。从物质吸附在催化剂表面到形成过渡态的过程会

II.CO2在一定条件下能与H2O发生氧再生反应:CO2(g) +2H2O(g)
 CH4(g)+ 2O2(g) ∆H=+802.3 kJ●mol-1
CH4(g)+ 2O2(g) ∆H=+802.3 kJ●mol-1(3)恒压p0条件下,按c(CO2) : c(H2O)=1 : 2投料,进行氧再生反应,测得不同温度下平衡时体系中各物质浓度的关系如图所示。350 ℃时,该反应的平衡常数Kp=

(4)氧再生反应还可以通过酸性条件下半导体光催化转化实现,反应机理如图甲所示:

①光催化CO2转化为CH4时,阴极的电极反应式为
②催化剂的催化效率和CH4的生成速率随温度的变化关系如图乙所示。300~400℃之间,CH4生成速率加快的原因是

(5)氧再生反应所需的能量可由合成氨反应提供。合成氨反应的焓变和熵变如下:N2 (g) +3H2(g)
 2NH3(g) ∆H= -92.4 kJ●mol-1 ∆S=-200J·K-1●mol-1常温(298 K)下,合成氨反应的自由能∆G=
2NH3(g) ∆H= -92.4 kJ●mol-1 ∆S=-200J·K-1●mol-1常温(298 K)下,合成氨反应的自由能∆G=
您最近一年使用:0次
10 . CH4-CO2催化重整不仅可以得到合成气,还有利于实现碳中和。
(1)已知25°C、101kPa 时,一些物质燃烧的热化学方程式如下:
反应I: CH4 (g) +2O2 (g) CO2 (g) +2H2O (1) △H1= - 890.3 kJ·mol-1
CO2 (g) +2H2O (1) △H1= - 890.3 kJ·mol-1
反应II: 2CO (g) +O2 (g) 2CO2 (g) △H2=- 566.0 kJ·mol-1
2CO2 (g) △H2=- 566.0 kJ·mol-1
反应III: 2H2 (g) +O2 (g) 2 H2O (1) △H3=-571.6 kJ·mol-1
2 H2O (1) △H3=-571.6 kJ·mol-1
则催化重整反应CH4 (g) +CO2 (g) 2CO (g) +2H2 (g) △H=
2CO (g) +2H2 (g) △H=___________ 。
(2)实验室中模拟CH4—CO2催化重整过程,CO2的平衡转化率(a)与温度(T)、平衡压强(p)的关系如图1,回答下列问题:
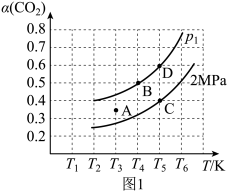
①定温度下, 在恒容的密闭容器中,能说明反应CH4 (g) +CO2(g) 2CO (g) +2H2 (g)达到平衡状态的标志有
2CO (g) +2H2 (g)达到平衡状态的标志有___________ (填标号)。
a. CH4的生成速率与CO的消耗速率之比为1:2 b.容器中的压强不再发生变化
c.混合气体的密度不再变化 d. H2 的物质的量浓度不再变化
②p1___________ (填 “大于”、“小于”或“等于”,下同) 2MPa;当温度为T3、压强为2MPa时,A点的v正___________ v逆。
③在2L的恒容密闭容器中,加入1mol CH4和1mol CO2发生反应CH4 (g) +CO2 (g) =2CO (g) +2H2 (g), 5min 达到平衡,在温度为T4、压强为p1条件下,用CH4表示该反应的平均反应速率为
=2CO (g) +2H2 (g), 5min 达到平衡,在温度为T4、压强为p1条件下,用CH4表示该反应的平均反应速率为___________ ;该温度时反应的平衡常数Kp=___________ (用平衡分压代替平衡浓度计算,分压=总压x物质的量分数,结果用含p1的代数式表示)。
(3)在一定条件下的密闭容器中,按投料比 =1加入反应物,发生反应CH4(g) +CO2 (g)
=1加入反应物,发生反应CH4(g) +CO2 (g)  2CO (g) +2H2 (g),图2表示v正~c (CH4)和v逆~c(CO)的速率—浓度关系曲线。
2CO (g) +2H2 (g),图2表示v正~c (CH4)和v逆~c(CO)的速率—浓度关系曲线。
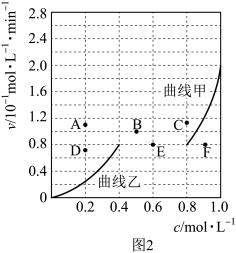
降低温度,反应重新达到平衡时,图2中v逆相应的平衡点可能为_____ (填写字母)。
(1)已知25°C、101kPa 时,一些物质燃烧的热化学方程式如下:
反应I: CH4 (g) +2O2 (g)
 CO2 (g) +2H2O (1) △H1= - 890.3 kJ·mol-1
CO2 (g) +2H2O (1) △H1= - 890.3 kJ·mol-1反应II: 2CO (g) +O2 (g)
 2CO2 (g) △H2=- 566.0 kJ·mol-1
2CO2 (g) △H2=- 566.0 kJ·mol-1反应III: 2H2 (g) +O2 (g)
 2 H2O (1) △H3=-571.6 kJ·mol-1
2 H2O (1) △H3=-571.6 kJ·mol-1则催化重整反应CH4 (g) +CO2 (g)
 2CO (g) +2H2 (g) △H=
2CO (g) +2H2 (g) △H=(2)实验室中模拟CH4—CO2催化重整过程,CO2的平衡转化率(a)与温度(T)、平衡压强(p)的关系如图1,回答下列问题:

①定温度下, 在恒容的密闭容器中,能说明反应CH4 (g) +CO2(g)
 2CO (g) +2H2 (g)达到平衡状态的标志有
2CO (g) +2H2 (g)达到平衡状态的标志有a. CH4的生成速率与CO的消耗速率之比为1:2 b.容器中的压强不再发生变化
c.混合气体的密度不再变化 d. H2 的物质的量浓度不再变化
②p1
③在2L的恒容密闭容器中,加入1mol CH4和1mol CO2发生反应CH4 (g) +CO2 (g)
 =2CO (g) +2H2 (g), 5min 达到平衡,在温度为T4、压强为p1条件下,用CH4表示该反应的平均反应速率为
=2CO (g) +2H2 (g), 5min 达到平衡,在温度为T4、压强为p1条件下,用CH4表示该反应的平均反应速率为(3)在一定条件下的密闭容器中,按投料比
 =1加入反应物,发生反应CH4(g) +CO2 (g)
=1加入反应物,发生反应CH4(g) +CO2 (g)  2CO (g) +2H2 (g),图2表示v正~c (CH4)和v逆~c(CO)的速率—浓度关系曲线。
2CO (g) +2H2 (g),图2表示v正~c (CH4)和v逆~c(CO)的速率—浓度关系曲线。
降低温度,反应重新达到平衡时,图2中v逆相应的平衡点可能为
您最近一年使用:0次



