名校
解题方法
1 . 丙烯是一种重要的化工原料,但丙烯的产量仅通过石油的催化裂解反应无法满足工业生产需求。工业上以WO3/SiO2为催化剂,利用丁烯和乙烯的催化歧化反应制丙烯: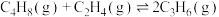
 。请回答下列问题:
。请回答下列问题:
(1)相关物质的燃烧热数据如下表所示:
催化歧化反应的
___________  ;
;
(2)利用丁烯和乙烯的催化歧化反应制备丙烯时,仅 发生如下反应:
反应ⅰ: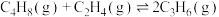
反应ⅱ:
一定条件下,经相同反应时间,丙烯的产率、丁烯的转化率随温度变化的关系如图所示:___________ ,500~550℃丙烯产率下降的原因为___________ 。
②某温度下,保持体系总压强为1.0 MPa,按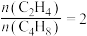 投料,达平衡状态时,C4H8、C2H4的转化率分别为96%、32%,则平衡时
投料,达平衡状态时,C4H8、C2H4的转化率分别为96%、32%,则平衡时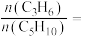
___________ ;反应ⅰ的压强平衡常数
___________ (保留三位有效数字)。
(3)反应ⅱ中,WO3/SiO2催化机理如图,关于该过程中的说法错误的是___________(填字母)。
(4)为了增强WO3/SiO2催化剂的活性和吸附能力,其他条件一定时,可向WO3/SiO2催化剂中添加催化剂助剂。下图为不同催化剂助剂的加入对丁烯的转化率、丙烯的选择性(产率 转化率
转化率 选择性)的影响,选择
选择性)的影响,选择___________ 作催化剂助剂为优选方案(填化学式)。
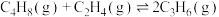
 。请回答下列问题:
。请回答下列问题:(1)相关物质的燃烧热数据如下表所示:
| 物质 | 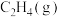 |  | 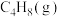 |
燃烧热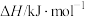 | -1411 | -2049 | -2539 |

 ;
;(2)利用丁烯和乙烯的催化歧化反应制备丙烯时,
反应ⅰ:
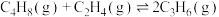
反应ⅱ:

一定条件下,经相同反应时间,丙烯的产率、丁烯的转化率随温度变化的关系如图所示:

②某温度下,保持体系总压强为1.0 MPa,按
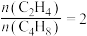 投料,达平衡状态时,C4H8、C2H4的转化率分别为96%、32%,则平衡时
投料,达平衡状态时,C4H8、C2H4的转化率分别为96%、32%,则平衡时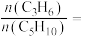

(3)反应ⅱ中,WO3/SiO2催化机理如图,关于该过程中的说法错误的是___________(填字母)。
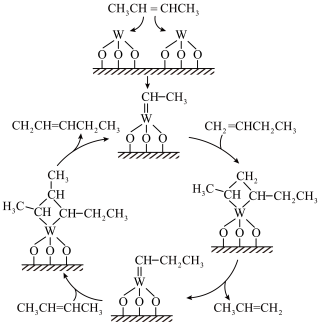
| A.有加成反应发生 | B.能将2-丁烯转化为1-丁烯 |
| C.W元素的成键数目一直未发生变化 | D.存在碳碳单键的断裂和形成 |
 转化率
转化率 选择性)的影响,选择
选择性)的影响,选择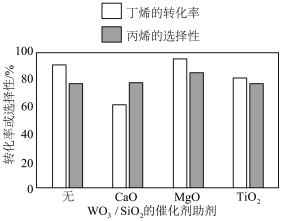
您最近一年使用:0次
2024-04-02更新
|
855次组卷
|
6卷引用:黑龙江省哈尔滨市三校联考2024届高三二模化学试题
黑龙江省哈尔滨市三校联考2024届高三二模化学试题江西省南昌十九中2023-2024学年高三下学期第一次模拟考试化学试卷 东北三省2024届高三下学期三校二模联考化学试题(已下线)提升练09 化学反应原理综合-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)东北三省2024届高三下学期三校二模联考化学试题2024届东北三省三校高三下学期第二次联合模拟考试理综重组卷-高中化学
22-23高二·全国·假期作业
解题方法
2 . 脱除沼气中的H2S具有重要意义,脱除H2S有多种方法。
(1)受热分解法。将H2S和CH4混合气导入热解器,反应分两步进行。
反应Ⅰ:2H2S(g)=2H2(g)+S2(g) =169.8kJ/mol
=169.8kJ/mol
反应Ⅱ:CH4(g)+S2(g)=CS2(g)+2H2(g) =63.7kJ/mol
=63.7kJ/mol
现将硫化氢和甲烷按照2:1体积比投料,并用N2稀释,常压和不同温度下反应,反应相同时间后,H2、S2和CS2体积分数如图所示。 =
=___________ 。
②1050℃时,H2的体积分数为___________ 。
③在950℃~1150℃范围内,其他条件不变,随着温度的升高,S2(g)的体积分数先增大而后减小,其原因可能是___________ 。
(2)光电催化法。某光电催化法脱除H2S的原理如图所示。___________ 。
②与受热分解法相比,光电催化法的优点是___________ 。
(3)催化重整法。Fe2O3可以用作脱除H2S的催化剂,脱除过程如图所示。___________ 。
②脱除一段时间后,催化剂的活性降低,原因是___________ 。
(1)受热分解法。将H2S和CH4混合气导入热解器,反应分两步进行。
反应Ⅰ:2H2S(g)=2H2(g)+S2(g)
 =169.8kJ/mol
=169.8kJ/mol反应Ⅱ:CH4(g)+S2(g)=CS2(g)+2H2(g)
 =63.7kJ/mol
=63.7kJ/mol现将硫化氢和甲烷按照2:1体积比投料,并用N2稀释,常压和不同温度下反应,反应相同时间后,H2、S2和CS2体积分数如图所示。

 =
=②1050℃时,H2的体积分数为
③在950℃~1150℃范围内,其他条件不变,随着温度的升高,S2(g)的体积分数先增大而后减小,其原因可能是
(2)光电催化法。某光电催化法脱除H2S的原理如图所示。
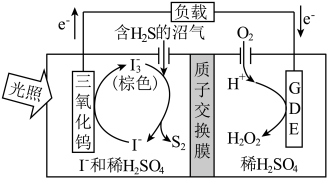
②与受热分解法相比,光电催化法的优点是
(3)催化重整法。Fe2O3可以用作脱除H2S的催化剂,脱除过程如图所示。
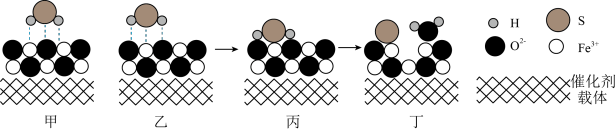
②脱除一段时间后,催化剂的活性降低,原因是
您最近一年使用:0次
解题方法
3 . 我国在应对气候变化工作中取得显著成效,并向国际社会承诺2030年实现“碳达峰”,2060年实现“碳中和”。因此将 转化为高附加值化学品成为科学家研究的重要课题。异丁烯
转化为高附加值化学品成为科学家研究的重要课题。异丁烯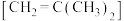 作为汽油添加剂的主要成分,可利用异丁烷与
作为汽油添加剂的主要成分,可利用异丁烷与 反应来制备。
反应来制备。
反应Ⅰ:
反应Ⅱ: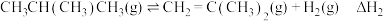
反应Ⅲ: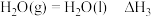
回答下列问题:
(1)已知:异丁烷、异丁烯、 的燃烧热热化学方程式的焓变分别为
的燃烧热热化学方程式的焓变分别为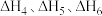 ,则
,则
_______ (用题目给的反应焓变来表示)。
(2)向 恒容密闭容器中加入
恒容密闭容器中加入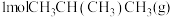 和
和 ,利用反应Ⅰ制备异丁烯。已知
,利用反应Ⅰ制备异丁烯。已知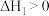 ;正反应速率表示为
;正反应速率表示为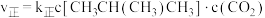 ,逆反应速率表示为
,逆反应速率表示为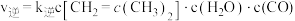 ,其中
,其中 、
、 为速率常数。
为速率常数。
①图中能够代表 的曲线为
的曲线为_______ (填“ ”“
”“ ”“
”“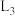 ”或“
”或“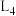 ”)。
”)。
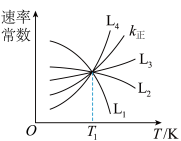
②温度为 时,该反应化学平衡常数
时,该反应化学平衡常数
_______ ,平衡时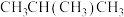 转化率
转化率_______ 50%(填“>”“=”或“<”)。
(3) 重整技术是实现“碳中和”的一种理想的
重整技术是实现“碳中和”的一种理想的 利用技术,反应为:
利用技术,反应为: 。在
。在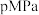 时,将
时,将 和
和 按物质的量之比为
按物质的量之比为 充入密闭容器中,分别在无催化剂及
充入密闭容器中,分别在无催化剂及 催化下反应相同时间,测得
催化下反应相同时间,测得 的转化率与温度的关系如图所示:
的转化率与温度的关系如图所示:

①a点时有催化剂和无催化剂的 转化率相等的原因是
转化率相等的原因是_______ 。
②在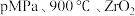 催化条件下,将
催化条件下,将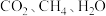 按物质的量之比为
按物质的量之比为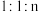 充入密闭容器,
充入密闭容器, 的平衡转化率为a,此时平衡常数
的平衡转化率为a,此时平衡常数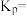
_______ (以分压表示,分压=总压×物质的量分数;用含a、n、p的代数式表示)。
(4)相比于反应Ⅱ直接脱氢,有人提出加入适量空气。采用异丁烷氧化脱氢的方法制备异丁烯,发生反应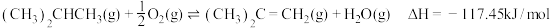 ,相比于异丁烷直接脱氢制备丁烯更好。从产率角度分析该方法的优点是
,相比于异丁烷直接脱氢制备丁烯更好。从产率角度分析该方法的优点是_______ 。
(5)利用电化学可以将 有效转化为
有效转化为 ,装置如图所示(忽略电解前后溶液的体积变化):
,装置如图所示(忽略电解前后溶液的体积变化):
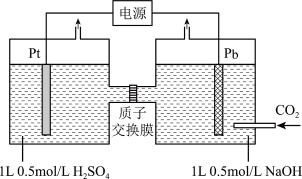
①已知:电解效率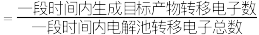 。装置工作时,阴极除有
。装置工作时,阴极除有 生成外,还可能生成副产物降低电解效率。标准状况下,当阳极生成氧气体积为
生成外,还可能生成副产物降低电解效率。标准状况下,当阳极生成氧气体积为 时,测得整个阴极区内的
时,测得整个阴极区内的 ,电解效率为
,电解效率为_______ 。
②研究表明,溶液 会影响
会影响 转化为
转化为 的效率。如图是
的效率。如图是 (以
(以 计)在水溶液中各种存在形式的物质的量分数δ随
计)在水溶液中各种存在形式的物质的量分数δ随 变化的情况。
变化的情况。
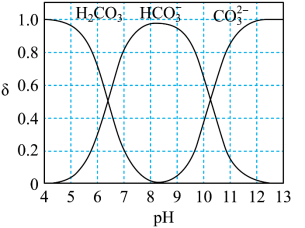
 时,
时, 的转化效率较高,溶液中相应的电极反应式为
的转化效率较高,溶液中相应的电极反应式为_______ ;在此条件下装置工作一段时间后,阴极附近溶液的
_______ (填标号:a.明显增大b.几乎不发生变化c.明显减小)。
 转化为高附加值化学品成为科学家研究的重要课题。异丁烯
转化为高附加值化学品成为科学家研究的重要课题。异丁烯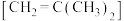 作为汽油添加剂的主要成分,可利用异丁烷与
作为汽油添加剂的主要成分,可利用异丁烷与 反应来制备。
反应来制备。反应Ⅰ:

反应Ⅱ:
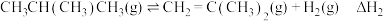
反应Ⅲ:
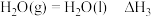
回答下列问题:
(1)已知:异丁烷、异丁烯、
 的燃烧热热化学方程式的焓变分别为
的燃烧热热化学方程式的焓变分别为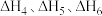 ,则
,则
(2)向
 恒容密闭容器中加入
恒容密闭容器中加入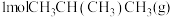 和
和 ,利用反应Ⅰ制备异丁烯。已知
,利用反应Ⅰ制备异丁烯。已知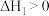 ;正反应速率表示为
;正反应速率表示为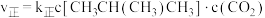 ,逆反应速率表示为
,逆反应速率表示为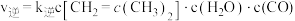 ,其中
,其中 、
、 为速率常数。
为速率常数。①图中能够代表
 的曲线为
的曲线为 ”“
”“ ”“
”“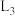 ”或“
”或“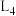 ”)。
”)。
②温度为
 时,该反应化学平衡常数
时,该反应化学平衡常数
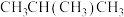 转化率
转化率(3)
 重整技术是实现“碳中和”的一种理想的
重整技术是实现“碳中和”的一种理想的 利用技术,反应为:
利用技术,反应为: 。在
。在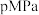 时,将
时,将 和
和 按物质的量之比为
按物质的量之比为 充入密闭容器中,分别在无催化剂及
充入密闭容器中,分别在无催化剂及 催化下反应相同时间,测得
催化下反应相同时间,测得 的转化率与温度的关系如图所示:
的转化率与温度的关系如图所示:
①a点时有催化剂和无催化剂的
 转化率相等的原因是
转化率相等的原因是②在
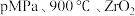 催化条件下,将
催化条件下,将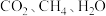 按物质的量之比为
按物质的量之比为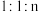 充入密闭容器,
充入密闭容器, 的平衡转化率为a,此时平衡常数
的平衡转化率为a,此时平衡常数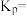
(4)相比于反应Ⅱ直接脱氢,有人提出加入适量空气。采用异丁烷氧化脱氢的方法制备异丁烯,发生反应
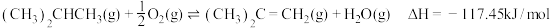 ,相比于异丁烷直接脱氢制备丁烯更好。从产率角度分析该方法的优点是
,相比于异丁烷直接脱氢制备丁烯更好。从产率角度分析该方法的优点是(5)利用电化学可以将
 有效转化为
有效转化为 ,装置如图所示(忽略电解前后溶液的体积变化):
,装置如图所示(忽略电解前后溶液的体积变化):
①已知:电解效率
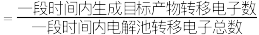 。装置工作时,阴极除有
。装置工作时,阴极除有 生成外,还可能生成副产物降低电解效率。标准状况下,当阳极生成氧气体积为
生成外,还可能生成副产物降低电解效率。标准状况下,当阳极生成氧气体积为 时,测得整个阴极区内的
时,测得整个阴极区内的 ,电解效率为
,电解效率为②研究表明,溶液
 会影响
会影响 转化为
转化为 的效率。如图是
的效率。如图是 (以
(以 计)在水溶液中各种存在形式的物质的量分数δ随
计)在水溶液中各种存在形式的物质的量分数δ随 变化的情况。
变化的情况。
 时,
时, 的转化效率较高,溶液中相应的电极反应式为
的转化效率较高,溶液中相应的电极反应式为
您最近一年使用:0次
2023高三·全国·专题练习
解题方法
4 . 热解H2S制H2,根据文献,将H2S和CH4的混合气体导入石英管反应器热解(一边进料,另一边出料),发生如下反应:
Ⅰ
Ⅱ
总反应:Ⅲ
投料按体积之比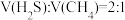 ,并用N2稀释;常压,不同温度下反应相同时间后,测得H2和CS2体积分数如下表:
,并用N2稀释;常压,不同温度下反应相同时间后,测得H2和CS2体积分数如下表:
请回答:
(1)反应Ⅲ能自发进行的条件是___________ 。
(2)下列说法正确的是 ___________。
(3)若将反应Ⅲ看成由反应Ⅰ和反应Ⅱ两步进行,画出由反应原料经两步生成产物的反应过程能量示意图___________ 。

Ⅰ

Ⅱ

总反应:Ⅲ

投料按体积之比
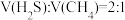 ,并用N2稀释;常压,不同温度下反应相同时间后,测得H2和CS2体积分数如下表:
,并用N2稀释;常压,不同温度下反应相同时间后,测得H2和CS2体积分数如下表:温度 |  |  |  |  |  |
| H2/V(%) | 0.5 | 1.5 | 3.6 | 5.5 | 8.5 |
| CS2/V(%) | 0.0 | 0.0 | 0.1 | 0.4 | 1.8 |
(1)反应Ⅲ能自发进行的条件是
(2)下列说法正确的是 ___________。
| A.其他条件不变时,用Ar替代 N2作稀释气体,对实验结果几乎无影响 |
B.其他条件不变时,温度越高, 的转化率越高 的转化率越高 |
C.由实验数据推出 中的S−H键强于CH4中的C−H键 中的S−H键强于CH4中的C−H键 |
| D.恒温恒压下,增加N2的体积分数,H2的浓度升高 |
(3)若将反应Ⅲ看成由反应Ⅰ和反应Ⅱ两步进行,画出由反应原料经两步生成产物的反应过程能量示意图

您最近一年使用:0次
5 . 研究分解氮氧化物的反应机理,对于控制汽车尾气排放、保护环境有重要意义。
Ⅰ.直接催化分解法是消除 的主要方法,已知
的主要方法,已知 催化分解过程如下:
催化分解过程如下:
①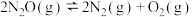
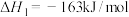
②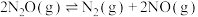
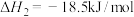
③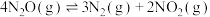
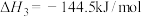 。
。
回答下列问题:
(1)反应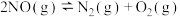 的
的 为
为___________  。
。
(2)T℃,在密闭容器中尝试利用表面催化工艺分解NO,若用 分别表示
分别表示 、NO、
、NO、 和固体催化剂,则在固体催化剂表面分解NO的反应过程可用下图表示:
和固体催化剂,则在固体催化剂表面分解NO的反应过程可用下图表示:
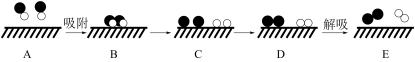
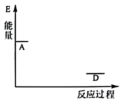
已知NO在固体催化剂表面吸附时总熵减小,请在图中画出从状态A到状态D体系能量的变化曲线图。
___________
(3)T℃和恒定压强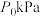 时,在密闭容器中模拟废气中
时,在密闭容器中模拟废气中 直接催化分解过程,各组分的信息如下表:
直接催化分解过程,各组分的信息如下表:
该温度下反应1的压强平衡常数
___________ kPa(分压=总压×物质的量分数,不含a和b)。
②若除去废气中的 ,再在相同条件下模拟实验,发现
,再在相同条件下模拟实验,发现 的平衡转化率明显降低,其原因可能是
的平衡转化率明显降低,其原因可能是___________ 。
Ⅱ.某溶液初始时仅溶有M和N且浓度相等,同时发生以下两个反应:① ;②
;②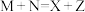 ,反应①的速率可表示为
,反应①的速率可表示为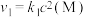 ,反应②的速率可表示为
,反应②的速率可表示为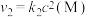 (
( 、
、 为速率常数)。
为速率常数)。
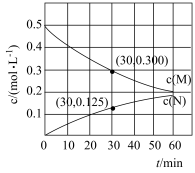
(4)反应体系中组分M、Z的浓度随时间变化情况如图,下列说法错误的是___________。
Ⅰ.直接催化分解法是消除
 的主要方法,已知
的主要方法,已知 催化分解过程如下:
催化分解过程如下:①
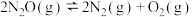
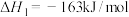
②
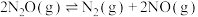
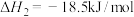
③
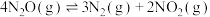
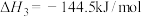 。
。回答下列问题:
(1)反应
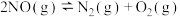 的
的 为
为 。
。(2)T℃,在密闭容器中尝试利用表面催化工艺分解NO,若用
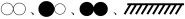 分别表示
分别表示 、NO、
、NO、 和固体催化剂,则在固体催化剂表面分解NO的反应过程可用下图表示:
和固体催化剂,则在固体催化剂表面分解NO的反应过程可用下图表示:
已知NO在固体催化剂表面吸附时总熵减小,请在图中画出从状态A到状态D体系能量的变化曲线图。

(3)T℃和恒定压强
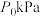 时,在密闭容器中模拟废气中
时,在密闭容器中模拟废气中 直接催化分解过程,各组分的信息如下表:
直接催化分解过程,各组分的信息如下表:| 物质 |  |  |  |  | NO |  |
| n(投料)/mol | 19 | 34 | 6.5 | 25 | 0 | 0 |
| n(平衡)/mol | 50 | 1 | 20 | 25 | A | b |

②若除去废气中的
 ,再在相同条件下模拟实验,发现
,再在相同条件下模拟实验,发现 的平衡转化率明显降低,其原因可能是
的平衡转化率明显降低,其原因可能是Ⅱ.某溶液初始时仅溶有M和N且浓度相等,同时发生以下两个反应:①
 ;②
;②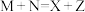 ,反应①的速率可表示为
,反应①的速率可表示为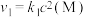 ,反应②的速率可表示为
,反应②的速率可表示为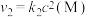 (
( 、
、 为速率常数)。
为速率常数)。(4)反应体系中组分M、Z的浓度随时间变化情况如图,下列说法错误的是___________。

| A.反应开始后,体系中Y和Z的浓度之比保持不变 |
| B.如果反应能进行到底,反应结束时62.5%的M转化为Y |
| C.反应①的活化能比反应②的活化能大 |
| D.其他条件不变升高温度可以提高产物中Y的物质的量分数 |
您最近一年使用:0次
2023高三下·全国·专题练习
6 . 氨是最重要的化学品之一,我国目前氨的生产能力位居世界首位。回答下列问题:
(1)根据图1数据计算反应 的ΔH =
的ΔH =___________ kJ·mol-1。

(2)研究表明,合成氨反应在Fe催化剂上可能通过图2机理进行(*表示催化剂表面吸附位,N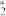 表示被吸附于催化剂表面的N2 )。判断上述反应机理中,速率控制步骤(即速率最慢步骤)为
表示被吸附于催化剂表面的N2 )。判断上述反应机理中,速率控制步骤(即速率最慢步骤)为___________ (填步骤前的标号),理由是___________ 。
图2反应机理
(i)N2(g)+* N
N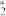
(ii)N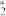 +*
+* 2N*
2N*
(iii)H2(g)+* H
H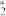
(iv)H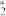 +*
+* 2H*
2H*
(v)N*+H* NH*+*
NH*+*
……
(…)NH
 NH3(g)+*
NH3(g)+*
(3)合成氨催化剂前驱体(主要成分为Fe3O4)使用前经H2还原,生成α-Fe包裹的Fe3O4.已知α-Fe属于立方晶系,晶胞参数a=287pm,密度为7.8 g ·cm-3,则α-Fe晶胞中含有Fe的原子数为___________ (列出计算式,阿伏加德罗常数的值为NA)。
(4)在不同压强下,以两种不同组成进料,反应达平衡时氨的摩尔分数与温度的计算结果如下图所示。其中一种进料组成为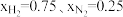 ,另一种为
,另一种为 。(物质i的摩尔分数:
。(物质i的摩尔分数: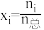 )
)

①图中压强由小到大的顺序为___________ ,判断的依据是___________ 。
②进料组成中含有惰性气体Ar的图是___________ 。
③图3中,当 、
、 时,氮气的转化率
时,氮气的转化率
___________ 。该温度时,反应 的平衡常数
的平衡常数
___________  (化为最简式)。
(化为最简式)。
(1)根据图1数据计算反应
 的ΔH =
的ΔH =
(2)研究表明,合成氨反应在Fe催化剂上可能通过图2机理进行(*表示催化剂表面吸附位,N
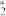 表示被吸附于催化剂表面的N2 )。判断上述反应机理中,速率控制步骤(即速率最慢步骤)为
表示被吸附于催化剂表面的N2 )。判断上述反应机理中,速率控制步骤(即速率最慢步骤)为图2反应机理
(i)N2(g)+*
 N
N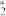
(ii)N
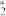 +*
+* 2N*
2N*(iii)H2(g)+*
 H
H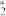
(iv)H
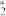 +*
+* 2H*
2H*(v)N*+H*
 NH*+*
NH*+*……
(…)NH

 NH3(g)+*
NH3(g)+*(3)合成氨催化剂前驱体(主要成分为Fe3O4)使用前经H2还原,生成α-Fe包裹的Fe3O4.已知α-Fe属于立方晶系,晶胞参数a=287pm,密度为7.8 g ·cm-3,则α-Fe晶胞中含有Fe的原子数为
(4)在不同压强下,以两种不同组成进料,反应达平衡时氨的摩尔分数与温度的计算结果如下图所示。其中一种进料组成为
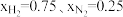 ,另一种为
,另一种为 。(物质i的摩尔分数:
。(物质i的摩尔分数: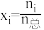 )
)
①图中压强由小到大的顺序为
②进料组成中含有惰性气体Ar的图是
③图3中,当
 、
、 时,氮气的转化率
时,氮气的转化率
 的平衡常数
的平衡常数
 (化为最简式)。
(化为最简式)。
您最近一年使用:0次
2023·广东汕头·三模
7 . 氢能是人类未来的理想能源之一,氢能利用存在两大难题:制取和储存。
Ⅰ.制取氢气
(1)甲醇水蒸气催化重整是当前制取清洁能源氢气的主要方法,其反应机理如下:
反应1:
反应2: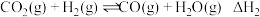
回答下列问题:
①在催化剂 作用下,反应1可通过如图所示的反应历程实现催化重整,则
作用下,反应1可通过如图所示的反应历程实现催化重整,则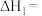
___________  (用含字母a、b、c的代数式表示)。
(用含字母a、b、c的代数式表示)。
②将一定量的甲醇气体和水蒸气混合反应,使用催化剂 ,测得相同条件下,甲醇的转化率
,测得相同条件下,甲醇的转化率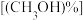 与
与 的物质的量分数
的物质的量分数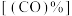 变化如图所示。反应2为
变化如图所示。反应2为___________ 反应(填“吸热”或“放热”),选择催化剂 的作用为
的作用为___________ 。
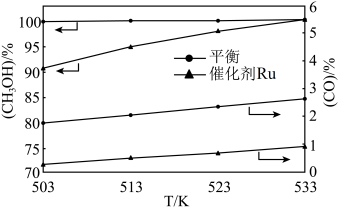
(2)乙烷催化裂解也可制备氢气: 催化裂解过程中利用膜反应新技术可以实现边反应边分离出生成的氢气。不同温度下,
催化裂解过程中利用膜反应新技术可以实现边反应边分离出生成的氢气。不同温度下, 乙烷在容积为
乙烷在容积为 的恒容密闭容器中发生催化裂解反应。氢气移出率
的恒容密闭容器中发生催化裂解反应。氢气移出率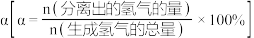 不同时,
不同时, 的平衡转化率与反应温度的关系如图所示:
的平衡转化率与反应温度的关系如图所示:
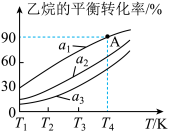
①相同温度时, 、
、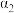 、
、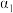 次增大,则对应的
次增大,则对应的 的平衡转化率依次
的平衡转化率依次___________ (答“增大”或“减小”),上述反应达到平衡后,欲增大单位时间内 的转化率,可以采取的措施有
的转化率,可以采取的措施有___________ (填序号)。
A.升高温度 B.通入惰性气体 C.及时移出 D.加入催化剂
D.加入催化剂
②A点时平衡常数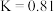 ,则
,则
___________ 。
Ⅱ.储存氢气:硼氢化钠( )是研究最广泛的储氢材料之一
)是研究最广泛的储氢材料之一
(3)在配制 溶液时,为防止发生水解反应,可以加入少量的
溶液时,为防止发生水解反应,可以加入少量的___________ (写化学式)。
(4) 中硼原子在成键时,能将一个
中硼原子在成键时,能将一个 电子激发进入
电子激发进入 能级参与形成化学键,该过程形成的原子光谱为
能级参与形成化学键,该过程形成的原子光谱为___________ 光谱(填“吸收”或“发射”)。
(5)硼氢化钠( )的强碱溶液在催化剂作用下与水反应可获取氢气。查阅资料可知:常温下,
)的强碱溶液在催化剂作用下与水反应可获取氢气。查阅资料可知:常温下, 在水中的溶解度不大,易以
在水中的溶解度不大,易以 形式结晶析出:且化学反应速率与催化剂的接触面积有关。在其他条件相同时,测得平均每克催化剂使用量下,
形式结晶析出:且化学反应速率与催化剂的接触面积有关。在其他条件相同时,测得平均每克催化剂使用量下, 的浓度和放氢速率的变化关系如图所示。随着
的浓度和放氢速率的变化关系如图所示。随着 浓度的增大,放氢速率先增大后减小,其原因可能是
浓度的增大,放氢速率先增大后减小,其原因可能是___________ 。

Ⅰ.制取氢气
(1)甲醇水蒸气催化重整是当前制取清洁能源氢气的主要方法,其反应机理如下:
反应1:

反应2:
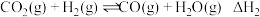
回答下列问题:
①在催化剂
 作用下,反应1可通过如图所示的反应历程实现催化重整,则
作用下,反应1可通过如图所示的反应历程实现催化重整,则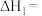
 (用含字母a、b、c的代数式表示)。
(用含字母a、b、c的代数式表示)。
②将一定量的甲醇气体和水蒸气混合反应,使用催化剂
 ,测得相同条件下,甲醇的转化率
,测得相同条件下,甲醇的转化率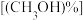 与
与 的物质的量分数
的物质的量分数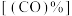 变化如图所示。反应2为
变化如图所示。反应2为 的作用为
的作用为
(2)乙烷催化裂解也可制备氢气:
 催化裂解过程中利用膜反应新技术可以实现边反应边分离出生成的氢气。不同温度下,
催化裂解过程中利用膜反应新技术可以实现边反应边分离出生成的氢气。不同温度下,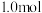 乙烷在容积为
乙烷在容积为 的恒容密闭容器中发生催化裂解反应。氢气移出率
的恒容密闭容器中发生催化裂解反应。氢气移出率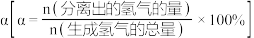 不同时,
不同时, 的平衡转化率与反应温度的关系如图所示:
的平衡转化率与反应温度的关系如图所示:
①相同温度时,
 、
、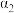 、
、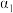 次增大,则对应的
次增大,则对应的 的平衡转化率依次
的平衡转化率依次 的转化率,可以采取的措施有
的转化率,可以采取的措施有A.升高温度 B.通入惰性气体 C.及时移出
 D.加入催化剂
D.加入催化剂②A点时平衡常数
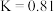 ,则
,则
Ⅱ.储存氢气:硼氢化钠(
 )是研究最广泛的储氢材料之一
)是研究最广泛的储氢材料之一(3)在配制
 溶液时,为防止发生水解反应,可以加入少量的
溶液时,为防止发生水解反应,可以加入少量的(4)
 中硼原子在成键时,能将一个
中硼原子在成键时,能将一个 电子激发进入
电子激发进入 能级参与形成化学键,该过程形成的原子光谱为
能级参与形成化学键,该过程形成的原子光谱为(5)硼氢化钠(
 )的强碱溶液在催化剂作用下与水反应可获取氢气。查阅资料可知:常温下,
)的强碱溶液在催化剂作用下与水反应可获取氢气。查阅资料可知:常温下, 在水中的溶解度不大,易以
在水中的溶解度不大,易以 形式结晶析出:且化学反应速率与催化剂的接触面积有关。在其他条件相同时,测得平均每克催化剂使用量下,
形式结晶析出:且化学反应速率与催化剂的接触面积有关。在其他条件相同时,测得平均每克催化剂使用量下, 的浓度和放氢速率的变化关系如图所示。随着
的浓度和放氢速率的变化关系如图所示。随着 浓度的增大,放氢速率先增大后减小,其原因可能是
浓度的增大,放氢速率先增大后减小,其原因可能是
您最近一年使用:0次
名校
解题方法
8 . 氮及其化合物在工农业生产中有着重要应用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。
Ⅰ.一定条件下,用 催化还原可消除NO污染。
催化还原可消除NO污染。
已知:①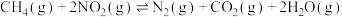

②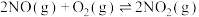

(1) 和
和 完全反应,每生成2.24L(标准状况)NO时,吸收8.9kJ的热量;则
完全反应,每生成2.24L(标准状况)NO时,吸收8.9kJ的热量;则
 ∆H=
∆H=_______ kJ·mol-1。
(2)将2mol NO(g)、1molO2 (g)和1mol He(g)通入反应器,在温度T、压强p条件下进行反应②和 。平衡时,若
。平衡时,若 、
、 与
与 三者的物质的量相等,则NO转化率为
三者的物质的量相等,则NO转化率为_______ ,反应②平衡常数
_______ (用含p的代数式表示,不考虑 )。
)。
Ⅱ.汽车尾气中的氮氧化物可利用如下反应处理: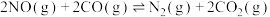

 ,实验测得,
,实验测得, ,
, (
( 、
、 为速率常数,只与温度有关)。
为速率常数,只与温度有关)。
(3)达到平衡后,仅升高温度,k正增大的倍数_______ (填“>”“<”或“=”)k逆增大的倍数。
Ⅲ.近年来,低温等离子技术是在高压放电下,O2产生O*自由基,O*自由基将NO氧化为NO2后,再用Na2CO3溶液吸收,达到消除NO的目的。实验室将模拟气(N2、O2、NO)以一定流速通入低温等离子体装置,实验装置如图所示。

(4)等离子体技术在低温条件下可提高NO的转化率,原因是_______ 。
(5)其他条件相同,等离子体的电功率与NO的转化率关系如图所示,当电功率为30W时,NO转化率达到最大的原因可能是_______ 。

Ⅳ.一种隔膜电化学法可处理燃煤烟气中的NO,装置如图所示。

(6)阴极区的电极反应式为_______ 。
Ⅰ.一定条件下,用
 催化还原可消除NO污染。
催化还原可消除NO污染。已知:①
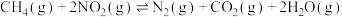

②
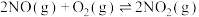

(1)
 和
和 完全反应,每生成2.24L(标准状况)NO时,吸收8.9kJ的热量;则
完全反应,每生成2.24L(标准状况)NO时,吸收8.9kJ的热量;则
 ∆H=
∆H=(2)将2mol NO(g)、1molO2 (g)和1mol He(g)通入反应器,在温度T、压强p条件下进行反应②和
 。平衡时,若
。平衡时,若 、
、 与
与 三者的物质的量相等,则NO转化率为
三者的物质的量相等,则NO转化率为
 )。
)。Ⅱ.汽车尾气中的氮氧化物可利用如下反应处理:
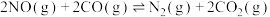

 ,实验测得,
,实验测得, ,
, (
( 、
、 为速率常数,只与温度有关)。
为速率常数,只与温度有关)。(3)达到平衡后,仅升高温度,k正增大的倍数
Ⅲ.近年来,低温等离子技术是在高压放电下,O2产生O*自由基,O*自由基将NO氧化为NO2后,再用Na2CO3溶液吸收,达到消除NO的目的。实验室将模拟气(N2、O2、NO)以一定流速通入低温等离子体装置,实验装置如图所示。

(4)等离子体技术在低温条件下可提高NO的转化率,原因是
(5)其他条件相同,等离子体的电功率与NO的转化率关系如图所示,当电功率为30W时,NO转化率达到最大的原因可能是

Ⅳ.一种隔膜电化学法可处理燃煤烟气中的NO,装置如图所示。

(6)阴极区的电极反应式为
您最近一年使用:0次
解题方法
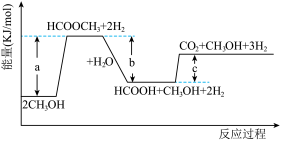
9 . 温室气体让地球“发烧”,倡导低碳生活,是-种可持续发展的环保责任,将CO2应用于生产中实现其综合利用是目前的研究热点。回答下列问题:
(1)通过使用不同的新型催化剂,实现二氧化碳加氢合成转化为二甲醚(CH3OCH3 )也有广泛的应用。
反应I:CO2(g) +3H2(g) CH3OH(g)+H2O(g) ΔH1=-49.01 kJ·mol-1
CH3OH(g)+H2O(g) ΔH1=-49.01 kJ·mol-1
反应II:2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH2=-24.52 kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH2=-24.52 kJ·mol-1
反应III :CO2(g)+H2(g) CO(g)+H2O(g) ΔH3=+41.17 kJ·mol-1
CO(g)+H2O(g) ΔH3=+41.17 kJ·mol-1
则2CO2(g) +6H2(g) CH3OCH3(g)+ 3H2O(g) ΔH=
CH3OCH3(g)+ 3H2O(g) ΔH=_____________ kJ·mol-1。
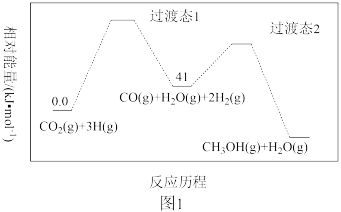
(2)一定条件下,CO2(g) +3H2(g) CH3OH(g) + H2O(g)的反应历程如图1所示。该反应的反应速率由第
CH3OH(g) + H2O(g)的反应历程如图1所示。该反应的反应速率由第_____________________ (填“1”或“2”)步决定。
(3)向2 L恒容密闭容器中充入1 mol CO2和3 mol H2,在一定条件下,仅发生上述反应I;在甲、乙两种不同催化剂的作用下,反应时间均为tmin时,测得甲醇的物质的量分数随温度的变化如图2所示。

①相同温度下,催化剂效果更好的是_____________ (填“甲”或“乙”);T4°C 下,甲醇的平均反应速率为_______ mol·L-1·min-1。
②T2°C和T5°C下,平衡常数:K2___ (填“>”、“<”或“=”)K5。
③T5°C下,反应开始时容器中的总压为p0 MPa,该温度下反应的平衡常数Kp=________ (只列出计算式,不必化简,气体分压=气体总压 ×气体的物质的量分数)。
(4)已知CH3OH的选择性为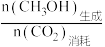 ×100%。其他条件相同时,反应温度对CO2的转化率和CH3OH的选择性的影响如图3、4所示。
×100%。其他条件相同时,反应温度对CO2的转化率和CH3OH的选择性的影响如图3、4所示。
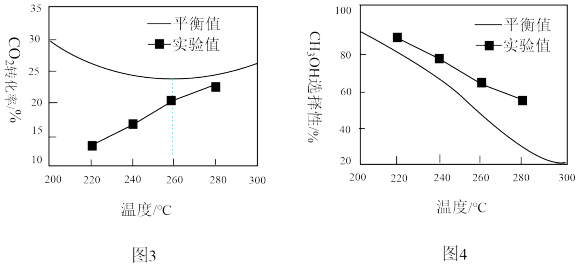
①由图3可知,实验中反应均未达到化学平衡状态的依据是______________________ 。
②温度高于260 °C时,CO2的平衡转化率呈上升变化的原因是__________ 。
③由图4可知,温度相同时CH3OH选择性的实验值略高于其平衡值,从化学反应速率的角度解释其原因是_______ 。
(1)通过使用不同的新型催化剂,实现二氧化碳加氢合成转化为二甲醚(CH3OCH3 )也有广泛的应用。
反应I:CO2(g) +3H2(g)
 CH3OH(g)+H2O(g) ΔH1=-49.01 kJ·mol-1
CH3OH(g)+H2O(g) ΔH1=-49.01 kJ·mol-1反应II:2CH3OH(g)
 CH3OCH3(g)+H2O(g) ΔH2=-24.52 kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH2=-24.52 kJ·mol-1 反应III :CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH3=+41.17 kJ·mol-1
CO(g)+H2O(g) ΔH3=+41.17 kJ·mol-1则2CO2(g) +6H2(g)
 CH3OCH3(g)+ 3H2O(g) ΔH=
CH3OCH3(g)+ 3H2O(g) ΔH=(2)一定条件下,CO2(g) +3H2(g)
 CH3OH(g) + H2O(g)的反应历程如图1所示。该反应的反应速率由第
CH3OH(g) + H2O(g)的反应历程如图1所示。该反应的反应速率由第
(3)向2 L恒容密闭容器中充入1 mol CO2和3 mol H2,在一定条件下,仅发生上述反应I;在甲、乙两种不同催化剂的作用下,反应时间均为tmin时,测得甲醇的物质的量分数随温度的变化如图2所示。

①相同温度下,催化剂效果更好的是
②T2°C和T5°C下,平衡常数:K2
③T5°C下,反应开始时容器中的总压为p0 MPa,该温度下反应的平衡常数Kp=
(4)已知CH3OH的选择性为
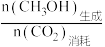 ×100%。其他条件相同时,反应温度对CO2的转化率和CH3OH的选择性的影响如图3、4所示。
×100%。其他条件相同时,反应温度对CO2的转化率和CH3OH的选择性的影响如图3、4所示。
①由图3可知,实验中反应均未达到化学平衡状态的依据是
②温度高于260 °C时,CO2的平衡转化率呈上升变化的原因是
③由图4可知,温度相同时CH3OH选择性的实验值略高于其平衡值,从化学反应速率的角度解释其原因是
您最近一年使用:0次
2023-06-02更新
|
854次组卷
|
3卷引用:四川省名校2023届高三下学期5月适应性测试理科综合化学试题
解题方法
10 . 尿素 是一种重要的化工产品和常用氮肥。回答下列问题:
是一种重要的化工产品和常用氮肥。回答下列问题:
(1)尿素中C、N、O三种元素的电负性由小到大的顺序是_______ (用元素符号表示)。
(2)工业上,用 和
和 制备尿素,总反应分两个基元反应(反应历程与相对能量关系如图1):
制备尿素,总反应分两个基元反应(反应历程与相对能量关系如图1):
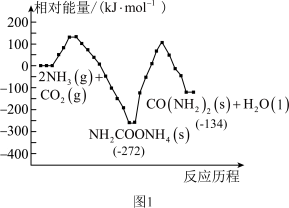
①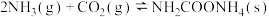
②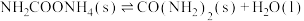
写出总反应的热化学方程式:_______ 。该历程中决速步骤的反应是_______ (填“①”或“②”)。
(3)有人设想直接利用反应 进行人工固氮制备尿素,从热力学角度判断该反应
进行人工固氮制备尿素,从热力学角度判断该反应_______ (填“可行”或“不可行”'),理由为_______ 。
(4)碳酸丙烯酯(PC)是锂离子电池的常用溶剂。工业上常用尿素合成碳酸丙烯酯。已知:碳酸丙烯酯的结构简式为 ,沸点为238.14℃;1,2-丙二醇(PG)的沸点为162℃。1,2-丙二醇和尿素(160℃以上会分解)合成PC的反应如下:
,沸点为238.14℃;1,2-丙二醇(PG)的沸点为162℃。1,2-丙二醇和尿素(160℃以上会分解)合成PC的反应如下:

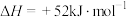
在烧瓶中加入物质的量之比为2:1的PG和尿素,加入催化剂充分反应,测定不同温度下PC的平衡收率变化如图2所示。PC的收率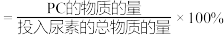 。
。

①160℃以上,PC的收率下降的主要原因可能是_______ 。
②150℃时,PG的平衡转化率为_______ 。以液相中各物质的量分数代替浓度表示平衡常数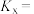
_______ (保留2位小数)。
 是一种重要的化工产品和常用氮肥。回答下列问题:
是一种重要的化工产品和常用氮肥。回答下列问题:(1)尿素中C、N、O三种元素的电负性由小到大的顺序是
(2)工业上,用
 和
和 制备尿素,总反应分两个基元反应(反应历程与相对能量关系如图1):
制备尿素,总反应分两个基元反应(反应历程与相对能量关系如图1):
①
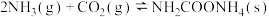
②
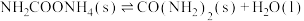
写出总反应的热化学方程式:
(3)有人设想直接利用反应
 进行人工固氮制备尿素,从热力学角度判断该反应
进行人工固氮制备尿素,从热力学角度判断该反应(4)碳酸丙烯酯(PC)是锂离子电池的常用溶剂。工业上常用尿素合成碳酸丙烯酯。已知:碳酸丙烯酯的结构简式为
 ,沸点为238.14℃;1,2-丙二醇(PG)的沸点为162℃。1,2-丙二醇和尿素(160℃以上会分解)合成PC的反应如下:
,沸点为238.14℃;1,2-丙二醇(PG)的沸点为162℃。1,2-丙二醇和尿素(160℃以上会分解)合成PC的反应如下:
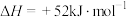
在烧瓶中加入物质的量之比为2:1的PG和尿素,加入催化剂充分反应,测定不同温度下PC的平衡收率变化如图2所示。PC的收率
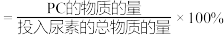 。
。
①160℃以上,PC的收率下降的主要原因可能是
②150℃时,PG的平衡转化率为
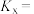
您最近一年使用:0次



