名校
解题方法
1 . 长征五号B运载火箭是中国近地轨道运载能力最大的新一代运载火箭,承担中国空间站舱段发射任务.采用液氧、液氢作为推进剂.回答下列问题:
(1)与偏二甲肼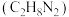 、四氧化二氨推进剂相比,液氢、液氧推进剂的优点是
、四氧化二氨推进剂相比,液氢、液氧推进剂的优点是___________ ;
(2)已知: ;
;
 ;
;
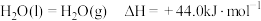 ;
;
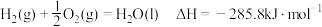 .
.
请写出液氢和液氧生成气态水的热化学方程式:______________ ,氢气的燃烧热
________ ;
(3)如果长征五号B运载火箭所携带的燃料为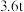 液氢、液氢,且液氢、液氧恰好完全反应生成气态水,总共释放能量
液氢、液氢,且液氢、液氧恰好完全反应生成气态水,总共释放能量________  (保留3位有效数字);
(保留3位有效数字);
(4)光催化制氢是能源研究热点.一种光催化水分解制取氢气的机理如图所示.

①该转化过程中,________ 能转化为化学能;
②由图可知, 转化为
转化为 的催化剂是
的催化剂是________ (填字母)。
A. B.
B. C.
C. D.紫外线
D.紫外线
(1)与偏二甲肼
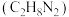 、四氧化二氨推进剂相比,液氢、液氧推进剂的优点是
、四氧化二氨推进剂相比,液氢、液氧推进剂的优点是(2)已知:
 ;
; ;
;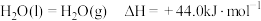 ;
;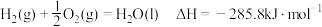 .
.请写出液氢和液氧生成气态水的热化学方程式:

(3)如果长征五号B运载火箭所携带的燃料为
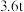 液氢、液氢,且液氢、液氧恰好完全反应生成气态水,总共释放能量
液氢、液氢,且液氢、液氧恰好完全反应生成气态水,总共释放能量 (保留3位有效数字);
(保留3位有效数字);(4)光催化制氢是能源研究热点.一种光催化水分解制取氢气的机理如图所示.

①该转化过程中,
②由图可知,
 转化为
转化为 的催化剂是
的催化剂是A.
 B.
B. C.
C. D.紫外线
D.紫外线
您最近一年使用:0次
名校
解题方法
2 . 碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质。请回答下列问题:
(1)有机物M经过太阳光光照可转化成N,转化过程如下: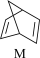

 ΔH=+88.6kJ·mol-1。,则M、N相比,较稳定的是
ΔH=+88.6kJ·mol-1。,则M、N相比,较稳定的是___________ 。
(2)已知CH3OH(l)的燃烧热ΔH=-726.5kJ·mol-1,CH3OH(l)+ O2(g)===CO2(g)+2H2(g)ΔH=-akJ·mol-1,则a
O2(g)===CO2(g)+2H2(g)ΔH=-akJ·mol-1,则a___________ 726.5(填“>”“<”或“=”)。
(3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1molCl2参与反应时释放出145kJ热量,写出该反应的热化学方程式:___________ 。
(4)根据下表中键能数据估算CH4(g)+4F2(g)===CF4(g)+4HF(g)的反应热ΔH为___________ 。
(1)有机物M经过太阳光光照可转化成N,转化过程如下:


 ΔH=+88.6kJ·mol-1。,则M、N相比,较稳定的是
ΔH=+88.6kJ·mol-1。,则M、N相比,较稳定的是(2)已知CH3OH(l)的燃烧热ΔH=-726.5kJ·mol-1,CH3OH(l)+
 O2(g)===CO2(g)+2H2(g)ΔH=-akJ·mol-1,则a
O2(g)===CO2(g)+2H2(g)ΔH=-akJ·mol-1,则a(3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1molCl2参与反应时释放出145kJ热量,写出该反应的热化学方程式:
(4)根据下表中键能数据估算CH4(g)+4F2(g)===CF4(g)+4HF(g)的反应热ΔH为
| 化学键 | C—H | C—F | H—F | F—F |
| 键能/(kJ·mol-1) | a | b | c | d |
您最近一年使用:0次
2020-12-14更新
|
150次组卷
|
2卷引用:广东省潮州湘桥区南春中学2021-2022学年高二上学期第一次月考化学试题
3 . 在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子。使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ·mol-1表示。请认真观察下图,然后回答问题。

(1)图中反应是________ (填“吸热”或“放热”)反应,该反应的ΔH=________ (用含E1、E2的代数式表示)。
(2)已知:H2(g)+ O2(g)===H2O(g)ΔH=-241.8kJ·mol-1,该反应的活化能为167.2kJ·mol-1,则其逆反应的活化能为
O2(g)===H2O(g)ΔH=-241.8kJ·mol-1,该反应的活化能为167.2kJ·mol-1,则其逆反应的活化能为________________ 。
(3)对于同一反应,图中虚线(II)与实线(I)相比,活化能________ (填“升高”“降低”或“不变”),对反应热是否有影响?________ ,原因是____________________________________________

(1)图中反应是
(2)已知:H2(g)+
 O2(g)===H2O(g)ΔH=-241.8kJ·mol-1,该反应的活化能为167.2kJ·mol-1,则其逆反应的活化能为
O2(g)===H2O(g)ΔH=-241.8kJ·mol-1,该反应的活化能为167.2kJ·mol-1,则其逆反应的活化能为(3)对于同一反应,图中虚线(II)与实线(I)相比,活化能
您最近一年使用:0次
2020-09-24更新
|
459次组卷
|
3卷引用:广东省湛江市雷州市第二中学2020-2021学年高二上学期第一次月考化学试题
2020高三·全国·专题练习
名校
4 . 合金贮氢材料具有优异的吸收氢性能,在配合氢能的开发中起到重要作用。
(1)一定温度下,某贮氢合金(M)的贮氢过程如图所示,纵轴为平衡时氢气的压强(p),横轴表示固相中氢原子与金属原子的个数比(H/M)。
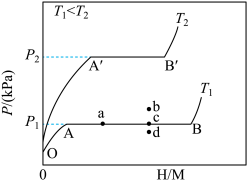
在OA段,氢溶解于M中形成固溶体MHx,随着氢气压强的增大,H/M逐渐增大;在AB段,MHx与氢气发生氢化反应生成氢化物MHy,氢化反应方程式为:zMHx(s)+H2(g)=ZMHy(s)△H(Ⅰ);在B点,氢化反应结束,进一步增大氢气压强,H/M几乎不变。反应(Ⅰ)中z=___ (用含x和y的代数式表示)。温度为T1时,2g某合金4min内吸收氢气240mL,吸氢速率v=___ mL•g-1•min。反应的焓变△H1__ 0(填“>”“<”或“=”)。
(2)η表示单位质量贮氢合金在氢化反应阶段的最大吸氢量占其总吸氢量的比例,则温度为T1、T2时,η(T1)____ η(T2)(填“>”“<”或“=”)。当反应(Ⅰ)处于图中a点时,保持温度不变,向恒容体系中通入少量氢气,达到平衡后反应(Ⅰ)可能处于图中的___ 点(填“b”“c”或“d”),该贮氢合金可通过___ 或___ 的方式释放氢气。
(1)一定温度下,某贮氢合金(M)的贮氢过程如图所示,纵轴为平衡时氢气的压强(p),横轴表示固相中氢原子与金属原子的个数比(H/M)。

在OA段,氢溶解于M中形成固溶体MHx,随着氢气压强的增大,H/M逐渐增大;在AB段,MHx与氢气发生氢化反应生成氢化物MHy,氢化反应方程式为:zMHx(s)+H2(g)=ZMHy(s)△H(Ⅰ);在B点,氢化反应结束,进一步增大氢气压强,H/M几乎不变。反应(Ⅰ)中z=
(2)η表示单位质量贮氢合金在氢化反应阶段的最大吸氢量占其总吸氢量的比例,则温度为T1、T2时,η(T1)
您最近一年使用:0次
2020-04-16更新
|
303次组卷
|
4卷引用:广东省深圳中学2020年高中毕业班教学质量监测卷理科综合化学试题
广东省深圳中学2020年高中毕业班教学质量监测卷理科综合化学试题(已下线)专题十一 化学反应速率和化学平衡(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训天津市南开中学2020届高三教学质量监测理科综合化学部分新疆昌吉市第九中学2021届高三下学期开学考试化学试题
5 . 填写下列空格。
(1)已知拆开1molH-H键、1molCl-Cl键、1molH-Cl键分别需要吸收的能量为436.4kJ、242.7kJ、431.8kJ。则由H2和Cl2反应生成1molHCl需要____ (填“放出”或“吸收”)___ kJ的热量。
(2)H2可以在Cl2中安静地燃烧。甲、乙两图中,能表示该反应能量变化的是图____ (填“甲”或“乙”)。

(3)已知:H2与Cl2在光照条件下会发生爆炸。同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的∆H___ (填“相等”或“不相等”)。
(1)已知拆开1molH-H键、1molCl-Cl键、1molH-Cl键分别需要吸收的能量为436.4kJ、242.7kJ、431.8kJ。则由H2和Cl2反应生成1molHCl需要
(2)H2可以在Cl2中安静地燃烧。甲、乙两图中,能表示该反应能量变化的是图

(3)已知:H2与Cl2在光照条件下会发生爆炸。同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的∆H
您最近一年使用:0次
10-11高二下·广东中山·期中
6 . 2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= -99kJ·mol-1。请回答下列问题:
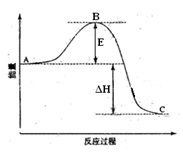
(1)图中A表示__________ 。E的大小对该反应的反应热_______ (填“有”或“无”)影响。该反应通常用V2O5作催化剂,加V2O5会使图中B点______ (填“升高”还是“降低”),△H______ (填“变大”、“变小”或“不变”)。
(2)图中△H=_____________ kJ·mol-1。

(1)图中A表示
(2)图中△H=
您最近一年使用:0次
2016-12-09更新
|
278次组卷
|
4卷引用:2010-2011学年广东省中山市桂山中学高二下期中考试化学试卷
(已下线)2010-2011学年广东省中山市桂山中学高二下期中考试化学试卷2015-2016学年吉林省辽源市田家炳高中高一下期中化学试卷山西省运城市景胜中学2020-2021学年高二9月月考化学试题湖北省黄冈市麻城第二中学2021-2022学年高一下学期4月月考化学试题
10-11高二上·广东·期中
解题方法
7 . 已知下热化学方程式:
①H2(g)+1/2O2(g)= H2O(l) ⊿H1= —285.8 kJ/mol
②H2(g)+1/2O2(g)= H2O(g) ⊿H2= —241.8kJ/mol
③C(s)+1/2O2(g) = CO(g) ⊿H3= —110.5kJ/mol
④C(s)+ O2(g) = CO2(g) ⊿H4= —393.5kJ/mol
回答下列问题:
(1)比较⊿H1,⊿H2,⊿H3,⊿H4的大小_______________
(2)上述反应中属于放热的是_______
(3)H2的燃烧热为________________ ,C的燃烧热为_______________
(4)燃烧10g H2生成液态水,放出的热量为_________________________
(5)CO的燃烧热为_________ ,其热化学方程式为__________________
(6)分别燃烧1mol C,H2,CO;充分燃烧后它们放出的热量分别为Q1,Q2,Q3
试比较Q1,Q2,Q3的大小___________________________
①H2(g)+1/2O2(g)= H2O(l) ⊿H1= —285.8 kJ/mol
②H2(g)+1/2O2(g)= H2O(g) ⊿H2= —241.8kJ/mol
③C(s)+1/2O2(g) = CO(g) ⊿H3= —110.5kJ/mol
④C(s)+ O2(g) = CO2(g) ⊿H4= —393.5kJ/mol
回答下列问题:
(1)比较⊿H1,⊿H2,⊿H3,⊿H4的大小
(2)上述反应中属于放热的是
(3)H2的燃烧热为
(4)燃烧10g H2生成液态水,放出的热量为
(5)CO的燃烧热为
(6)分别燃烧1mol C,H2,CO;充分燃烧后它们放出的热量分别为Q1,Q2,Q3
试比较Q1,Q2,Q3的大小
您最近一年使用:0次
13-14高三·全国·课时练习
名校
解题方法
8 . 碳是形成化合物种类最多的元素,其单质及其部分化合物是人类生产生活的主要能源物质。请回答下列问题:
(1)有机物M经过太阳光光照可转化成N,转化过程如下:
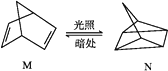
ΔH=+88.6 kJ·mol-1,则M、N相比,较稳定的是__________ 。
(2)CH3OH+O2(g) =CO2(g)+2H2O(g) ΔH=-akJ·mol-1,则a________ (填“>”“<”或“=”)238.6。(已知甲醇的燃烧热为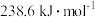 )
)
(3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145 kJ热量,写出该反应的热化学方程式:____________________________ 。
(4)将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s) ===2Al2O3(s)+3TiC(s) ΔH= -1 176 kJ·mol-1,则反应过程中,每转移1 mol电子放出的热量为_____________ 。
(1)有机物M经过太阳光光照可转化成N,转化过程如下:

ΔH=+88.6 kJ·mol-1,则M、N相比,较稳定的是
(2)CH3OH+O2(g) =CO2(g)+2H2O(g) ΔH=-akJ·mol-1,则a
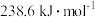 )
) (3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145 kJ热量,写出该反应的热化学方程式:
(4)将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s) ===2Al2O3(s)+3TiC(s) ΔH= -1 176 kJ·mol-1,则反应过程中,每转移1 mol电子放出的热量为
您最近一年使用:0次
2016-12-08更新
|
2132次组卷
|
14卷引用:【全国百强校】广东仲元中学2017-2018学年高二下学期期中考试(理)化学试题
【全国百强校】广东仲元中学2017-2018学年高二下学期期中考试(理)化学试题(已下线)2014年高考化学一轮复习课后规范训练6-1练习卷山西省实验中学2017-2018学年高二上学期10月月考化学试题重庆市九校联盟2017-2018学年高二上学期期中考试化学试题(已下线)二轮复习 专题8 化学反应中与能量变化 押题专练河北省安平中学2017-2018学年高一下学期期末考试化学试题12018-2019学年人教版高二化学选修四章:化学反应与能量末测试题2018-2019学年人教版高中化学选修四 章末综合测评1 化学反应与能量四川省成都经济技术开发区实验中学校2019届高三上学期入学考试化学试题河南省鹤壁市淇县第一中学2018-2019学年高二(普通班)上学期第一次月考化学试题(已下线)《2018-2019学年同步单元双基双测AB卷》第一单元 化学反应与能量单元测试(A卷)【全国百强校】福建省三明市第一中学2018-2019学年高二上学期第一次月考化学试题高二人教版选修4 期末学业测评(二)辽宁省普兰店市第一中学2019届高三上学期期中考试化学试题
11-12高二上·广东·期中
9 . 在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子。使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ·mol-1表示。请认真观察右图,然后回答问题。

(1)图中所示反应是_________ (填“吸热”或“放热”)反应,该反应_____________ (填“需要”或“不需要”)加热,该反应的△H =______________________ (用含E1、E2的代数式表示)。
(2)已知热化学方程式:H2(g)+ O2(g) =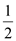 H2O(g) △H =-241.8 kJ·mol-1,该反应的活化能为167.2 kJ·mol-1,则其逆反应的活化能为
H2O(g) △H =-241.8 kJ·mol-1,该反应的活化能为167.2 kJ·mol-1,则其逆反应的活化能为____________________ 。

(1)图中所示反应是
(2)已知热化学方程式:H2(g)+ O2(g) =
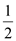 H2O(g) △H =-241.8 kJ·mol-1,该反应的活化能为167.2 kJ·mol-1,则其逆反应的活化能为
H2O(g) △H =-241.8 kJ·mol-1,该反应的活化能为167.2 kJ·mol-1,则其逆反应的活化能为
您最近一年使用:0次
2011-12-15更新
|
488次组卷
|
5卷引用:2011-2012学年广东省培正中学高二上学期期中考试化学试卷
(已下线)2011-2012学年广东省培正中学高二上学期期中考试化学试卷(已下线)2011-2012学年江西上饶中学高一重点班下期末考试化学试卷湖南省常德市石门县第二中学2019-2020学年高二上学期第二次月考化学试题河南省新乡县高级中学2021-2022学年高二上学期第一次月考化学试题陕西省宜君县高级中学2021-2022学年高二上学期第一次月考化学(理)试题
11-12高二上·广东·期中
10 . 甲醛是一种重要的化工产品,可利用甲醇催化脱氢制备气态甲醛。甲醛与气态甲醇转化的能量关系如图所示:

(1)甲醇催化脱氢转化为甲醛的反应是____ (填“吸热”或“放热”)反应.
(2)过程Ⅰ与过程Ⅱ的反应热是否相同?____ ,理由是__________________________ 。
(3)合成甲醇的主要反应为:CO(g)+2H2(g) CH3OH(g)△H<0,其化学平衡常数K和温度T的关系如下表所示:
CH3OH(g)△H<0,其化学平衡常数K和温度T的关系如下表所示:
T1、T2、T3的大小关系为_________________________

(1)甲醇催化脱氢转化为甲醛的反应是
(2)过程Ⅰ与过程Ⅱ的反应热是否相同?
(3)合成甲醇的主要反应为:CO(g)+2H2(g)
 CH3OH(g)△H<0,其化学平衡常数K和温度T的关系如下表所示:
CH3OH(g)△H<0,其化学平衡常数K和温度T的关系如下表所示:| T/℃ | T1 | T2 | T3 |
| K | 1/1000 | 1/40 | 25 |
T1、T2、T3的大小关系为
您最近一年使用:0次



