名校
解题方法
1 . 填空
(1)硫元素广泛存在于自然界中,常与铁、铜等金属元素形成硫化物。黄铁矿( )中S元素的化合价为
)中S元素的化合价为_______ ,黄铜矿( )中Fe元素化合价为
)中Fe元素化合价为_______ 。
(2)氢氟酸是HF的水溶液,工业上用氢氟酸溶蚀玻璃生产磨砂玻璃,其反应原理是_______ (用化学方程式表示)。
(3)天然橡胶的主要成分是聚异戊二烯,其结构简式如下。

写出聚异戊二烯单体的结构简式_______ 。
(4)乙酸乙酯是一种常用的萃取剂。请写出由乙醇和乙酸生成乙酸乙酯的化学方程式_______ 。
(5)工业制氢的一个重要反应是利用 还原
还原 。已知:
。已知:
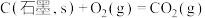



则表示 燃烧热的热化学方程式为
燃烧热的热化学方程式为_______ 。
(6)已知: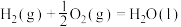
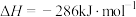

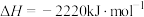
在常温常压下, 和
和 的混合气体共3mol完全燃烧生成
的混合气体共3mol完全燃烧生成 和液态水放出2792kJ的热量,则该混合气体中,
和液态水放出2792kJ的热量,则该混合气体中, 和
和 的体积比为
的体积比为_______ 。
(1)硫元素广泛存在于自然界中,常与铁、铜等金属元素形成硫化物。黄铁矿(
 )中S元素的化合价为
)中S元素的化合价为 )中Fe元素化合价为
)中Fe元素化合价为(2)氢氟酸是HF的水溶液,工业上用氢氟酸溶蚀玻璃生产磨砂玻璃,其反应原理是
(3)天然橡胶的主要成分是聚异戊二烯,其结构简式如下。

写出聚异戊二烯单体的结构简式
(4)乙酸乙酯是一种常用的萃取剂。请写出由乙醇和乙酸生成乙酸乙酯的化学方程式
(5)工业制氢的一个重要反应是利用
 还原
还原 。已知:
。已知: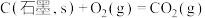



则表示
 燃烧热的热化学方程式为
燃烧热的热化学方程式为(6)已知:
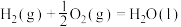
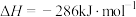

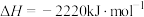
在常温常压下,
 和
和 的混合气体共3mol完全燃烧生成
的混合气体共3mol完全燃烧生成 和液态水放出2792kJ的热量,则该混合气体中,
和液态水放出2792kJ的热量,则该混合气体中, 和
和 的体积比为
的体积比为
您最近一年使用:0次
名校
解题方法
2 . 周期表中ⅤA族元素及其化合物作用广泛。氨是重要的化工原料,广泛用于生产铵盐、硝酸、纯碱、医药等;肼 的燃烧热为
的燃烧热为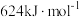 ,是常用的火箭燃料;氮和磷都是植物生长的营养元素,单质磷可由磷酸钙、石英砂和碳粉在电弧炉中熔烧制得;砷化镓是典型的二代半导体材料,在700~900℃条件下,
,是常用的火箭燃料;氮和磷都是植物生长的营养元素,单质磷可由磷酸钙、石英砂和碳粉在电弧炉中熔烧制得;砷化镓是典型的二代半导体材料,在700~900℃条件下, 与
与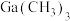 通过化学气相沉积可制得砷化镓晶体;铅锑合金一般用作铅蓄电池的负极材料。下列化学反应表示正确的是
通过化学气相沉积可制得砷化镓晶体;铅锑合金一般用作铅蓄电池的负极材料。下列化学反应表示正确的是
 的燃烧热为
的燃烧热为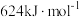 ,是常用的火箭燃料;氮和磷都是植物生长的营养元素,单质磷可由磷酸钙、石英砂和碳粉在电弧炉中熔烧制得;砷化镓是典型的二代半导体材料,在700~900℃条件下,
,是常用的火箭燃料;氮和磷都是植物生长的营养元素,单质磷可由磷酸钙、石英砂和碳粉在电弧炉中熔烧制得;砷化镓是典型的二代半导体材料,在700~900℃条件下, 与
与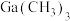 通过化学气相沉积可制得砷化镓晶体;铅锑合金一般用作铅蓄电池的负极材料。下列化学反应表示正确的是
通过化学气相沉积可制得砷化镓晶体;铅锑合金一般用作铅蓄电池的负极材料。下列化学反应表示正确的是A.肼的燃烧: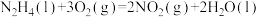  |
B.制单质磷: |
C.制砷化镓晶体: |
D.铅蓄电池放电时的负极反应: |
您最近一年使用:0次
2023-02-11更新
|
445次组卷
|
4卷引用:重庆市2023-2024学年高二下学期开学考试化学试题
名校
解题方法
3 . 下列说法正确的是
A.甲烷的摩尔燃烧焓为 =-890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) =-890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)  = -890.3kJ/mol = -890.3kJ/mol |
B.500℃、30MPa下,将0.5molN2(g)和1.5molH2(g)置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为N2(g)+3H2(g) 2NH3(g) 2NH3(g)  = -38.6kJ/mol = -38.6kJ/mol |
| C.中和反应的反应热实验中将环形玻璃搅拌棒改为铁质搅拌器对实验结果没有影响 |
D.已知C(s)+O2(g)=CO2(g)  = - a kJ/mol,C(s)+ = - a kJ/mol,C(s)+ O2(g)=CO(g) O2(g)=CO(g)  = - b kJ/mol,则a>b = - b kJ/mol,则a>b |
您最近一年使用:0次
2022-12-09更新
|
243次组卷
|
2卷引用:2024届重庆市乌江新高考协作体高三下学期模拟预测化学试题
名校
解题方法
4 . 当今,世界多国相继规划了碳达峰、碳中和的时间节点。因此,研发二氧化碳利用技术,降低空气中二氧化碳含量成为研究热点。
I. 在一定温度下,CO2溶于水的过程及其平衡常数为:
CO2(g) CO2(aq) K1=
CO2(aq) K1=
CO2(aq)+H2O(l) H+(aq)+HCO
H+(aq)+HCO (aq) K2
(aq) K2
其中p为CO2(g)的平衡压强,c(CO2)为CO2在水溶液中的平衡浓度。
(1)CO2(g) CO2(aq)的焓变ΔH
CO2(aq)的焓变ΔH_______ 0(填“>”“=”或“<”)。
(2)CO2在水中的溶解度(以物质的量浓度表示)为c总,则c总=_______ (用平衡压强p和上述平衡常数表示,忽略H2O和HCO 的电离)。
的电离)。
Ⅱ.利用CO2与H2在催化剂作用下合成甲醇。
主反应:CO2 (g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
副反应:CO2(g) +H2(g) CO(g) +H2O(g)
CO(g) +H2O(g)
(3)已知:CH3OH(l) CH3OH(g) ΔH= + 138kJ/mol,
CH3OH(g) ΔH= + 138kJ/mol,
H2O(l) H2O (g) ΔH= + 40.8kJ/mol,
H2O (g) ΔH= + 40.8kJ/mol,
H2(g)和CH3OH(l)的燃烧热分别为―285.8kJ/mol、―726kJ/mol, 则主反应的ΔH=_______ kJ/ mol。
(4)在恒温的两个相同的刚性密闭容器中,分别按照CO2、H2的体积比1 :5以及CO2、H2、H2O(g)(H2O的作用是活化催化剂)的体积比1:5:8反应相同的时间,所得产物的选择性[如甲醇的选择性= 100%] 如图所示:
100%] 如图所示:

①向反应体系中加入H2O(g)能够显著提高甲醇选择性的原因:_______ 。
②向上述刚性密闭容器中按照体积比1 :5:8充入CO2、H2、H2O(g), 在450K下达平衡时,CO2的转化率为50%,CH3OH选择性为90%,则副反应的平衡常数K=_______ 。(保留小数点后3位)
(5)在饱和KHCO3电解液中,电解活化的CO2也可以制备CH3OH,其原理如图所示,则阴极的电极反应式为_______ 。

I. 在一定温度下,CO2溶于水的过程及其平衡常数为:
CO2(g)
 CO2(aq) K1=
CO2(aq) K1=
CO2(aq)+H2O(l)
 H+(aq)+HCO
H+(aq)+HCO (aq) K2
(aq) K2其中p为CO2(g)的平衡压强,c(CO2)为CO2在水溶液中的平衡浓度。
(1)CO2(g)
 CO2(aq)的焓变ΔH
CO2(aq)的焓变ΔH(2)CO2在水中的溶解度(以物质的量浓度表示)为c总,则c总=
 的电离)。
的电离)。Ⅱ.利用CO2与H2在催化剂作用下合成甲醇。
主反应:CO2 (g)+3H2(g)
 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)副反应:CO2(g) +H2(g)
 CO(g) +H2O(g)
CO(g) +H2O(g)(3)已知:CH3OH(l)
 CH3OH(g) ΔH= + 138kJ/mol,
CH3OH(g) ΔH= + 138kJ/mol, H2O(l)
 H2O (g) ΔH= + 40.8kJ/mol,
H2O (g) ΔH= + 40.8kJ/mol,H2(g)和CH3OH(l)的燃烧热分别为―285.8kJ/mol、―726kJ/mol, 则主反应的ΔH=
(4)在恒温的两个相同的刚性密闭容器中,分别按照CO2、H2的体积比1 :5以及CO2、H2、H2O(g)(H2O的作用是活化催化剂)的体积比1:5:8反应相同的时间,所得产物的选择性[如甲醇的选择性=
 100%] 如图所示:
100%] 如图所示:
①向反应体系中加入H2O(g)能够显著提高甲醇选择性的原因:
②向上述刚性密闭容器中按照体积比1 :5:8充入CO2、H2、H2O(g), 在450K下达平衡时,CO2的转化率为50%,CH3OH选择性为90%,则副反应的平衡常数K=
(5)在饱和KHCO3电解液中,电解活化的CO2也可以制备CH3OH,其原理如图所示,则阴极的电极反应式为

您最近一年使用:0次
2022-04-13更新
|
567次组卷
|
2卷引用:重庆市巴蜀中学校2021-2022学年高三下学期适应性月考(八)化学试题
名校
5 . C和H2在生产、生活、科技中是非常重要的燃料。已知:
①2C(s)+O2(g)=2CO(g) ΔH=-221kJ·mol-1
②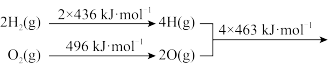 2H2O(g)
2H2O(g)
下列推断正确的是
①2C(s)+O2(g)=2CO(g) ΔH=-221kJ·mol-1
②
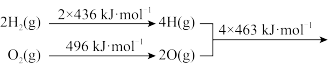 2H2O(g)
2H2O(g)下列推断正确的是
| A.C(s)的燃烧热为110.5kJ·mol-1 |
| B.2H2(g)+O2(g)=2H2O(g) ΔH>0,ΔS<0,该反应是非自发反应 |
| C.C(s)+H2O(g)=CO(g)+H2(g) ΔH=+131.5kJ·mol-1 |
| D.将2molH2O(g)分解成H2(g)和O2(g),至少需要提供4×463kJ的热量 |
您最近一年使用:0次
2022-02-20更新
|
1001次组卷
|
5卷引用:三峡名校联盟2021-2022学年高二上学期联考化学试题
名校
解题方法
6 . CO2催化加氢合成CH4的反应为CO2(g)+4H2(g)=CH4(g)+2H2O(g) ΔH
已知:①CH4(g)+2O2(g)⇌CO2(g)+2H2O(g) ΔH1=-802.0kJ·mol-1
②CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH2=+41.2kJ·mol-1
③2CO(g)+O2(g)⇌2CO2(g) ΔH3=-566.0kJ·mol-1
下列有关说法正确的是
已知:①CH4(g)+2O2(g)⇌CO2(g)+2H2O(g) ΔH1=-802.0kJ·mol-1
②CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH2=+41.2kJ·mol-1
③2CO(g)+O2(g)⇌2CO2(g) ΔH3=-566.0kJ·mol-1
下列有关说法正确的是
| A.CH4的摩尔燃烧焓为802.0kJ·mol-1 |
| B.ΔH=+165.2kJ·mol-1 |
| C.使用催化剂是为了提高CO2加氢时原料的平衡转化率 |
| D.反应②能自发进行,其原因是ΔS>0 |
您最近一年使用:0次
2021-11-20更新
|
464次组卷
|
8卷引用:重庆育才中学2021-2022学年高二上学期第二次定时练习化学试题
重庆育才中学2021-2022学年高二上学期第二次定时练习化学试题江苏省南通市如皋中学2020-2021学年高二下学期第二次阶段考试化学试题(已下线)作业06 化学反应的调控-2021年高二化学暑假作业(人教版2019)(已下线)第二章 第四节 化学反应进行的方向(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版选修4)河南省洛阳市豫西名校2021-2022学年高二上学期第一次联考化学试题河北深州市长江中学2021-2022学年高二上学期10月月考化学(理)试题福建省三明市教研联盟校2021-2022学年高二上学期期中联考化学试题上海市行知中学2022-2023学年高二上学期期中考试化学(加试)试题
解题方法
7 . X、Y、Z、P、Q、W、R、T是元素周期表短周期中的常见主族元素,且原子序数依次增大,其相关信息如下表:
(1)R在元素周期表中的位置为 ;将Q、W、Z、Y的简单离子的半径从大到小排序___________________________________________(用离子符号表示)
(2)T的单质易溶于XT4中,理由是:____________________________________________。
(3)根据下表中信息,判断下列化合物固态的晶体类型(填“离子晶体”… 等):
(4)任意写出一个由Y、Z元素分别与氢元素形成的10电子粒子间相互反应的离子方程式:___________。
(5)在25℃、101 kPa下,已知13.5 g的W固体单质在Z2气体中完全燃烧后恢复至原状态,放热419 kJ,写出表示W单质燃烧热的热化学方程式 。
(6)化合物P2R溶液在空气中长期放置,与氧气反应会生成与过氧化钠的结构相似的物质P2R2,其溶液显黄色,则P2R2的电子式为 ,用化学方程式表示P2R溶液在空气中的变质过程 。
| 元素 | 相关信息 |
| X | 其一种同位素,可被用作相对原子质量的标准 |
| Y | 其最高价氧化物对应水化物能与其气态氢化物相互间发生化合反应 |
| P | 是短周期中(除稀有气体外)原子半径最大的元素 |
| Q | 存在质量数为25,中子数为13的核素 |
| W | 位于周期表第13列 |
| R | 与Z同族,且最高价氧化物对应水化物的浓溶液常温下与W单质会出现钝化现象 |
(1)R在元素周期表中的位置为 ;将Q、W、Z、Y的简单离子的半径从大到小排序___________________________________________(用离子符号表示)
(2)T的单质易溶于XT4中,理由是:____________________________________________。
(3)根据下表中信息,判断下列化合物固态的晶体类型(填“离子晶体”… 等):
| 化合物 | X3Y4 | R2T2 |
| 晶体类型 | ||
| 熔点/℃ | >3600 | -76 |
(4)任意写出一个由Y、Z元素分别与氢元素形成的10电子粒子间相互反应的离子方程式:___________。
(5)在25℃、101 kPa下,已知13.5 g的W固体单质在Z2气体中完全燃烧后恢复至原状态,放热419 kJ,写出表示W单质燃烧热的热化学方程式 。
(6)化合物P2R溶液在空气中长期放置,与氧气反应会生成与过氧化钠的结构相似的物质P2R2,其溶液显黄色,则P2R2的电子式为 ,用化学方程式表示P2R溶液在空气中的变质过程 。
您最近一年使用:0次
8 . 下列说法正确的是

Ⅱ:
且a、b、c均大于零,则断开1 mol H-Cl键所需的能量为(a+b+c)kJ

Ⅱ:

且a、b、c均大于零,则断开1 mol H-Cl键所需的能量为(a+b+c)kJ
| A.需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应 |
| B.若 2C(s)+O2(g)=2CO(g) △H=-221.0 kJ/mol,则碳的燃烧热为110.5 kJ/mol |
| C.右图可表示水分解过程中的能量变化 |
| D.已知:Ⅰ:对于反应:H2(g)+Cl2(g)=2HCl (g) △H=-a kJ/mol, |
您最近一年使用:0次
解题方法
9 . 按要求填空
(1)下列ΔH表示物质燃烧热的是_______ ;表示反应中和热ΔH=-57.3 kJ·mol-1的是_______ 。(填“ΔH1”、“ΔH2”和“ΔH3”等)
E.NaOH(aq)+HCl(aq) = NaCl(aq)+H2O(l) ΔH5
F.2NaOH(aq)+H2SO4(aq) = Na2SO4(aq)+2H2O(l) ΔH6
(2)在25℃、101kPa下,16.0g甲醇燃烧生成CO2和液态水时放热363.0kJ。则表示甲醇燃烧热的热化学方程式为______________________________________ 。
(3)化学反应的能量变化(ΔH)与反应物和生成物的键能有关(键能可以简单理解为断开1mol化学键时所需吸收的能量),下表是部分化学键的键能数据:
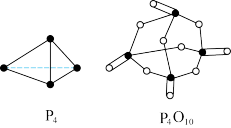
已知白磷(P4)的燃烧热为2378kJ/mol,白磷完全燃烧的产物(P4O10)的结构如上图所示,则上表中a=_____ (保留到整数)。
(1)下列ΔH表示物质燃烧热的是
| A.C(s)+1/2O2(g) = CO(g)ΔH1 |
| B.2H2(g)+O2(g) = 2H2O(l)ΔH2 |
| C.C(s)+O2(g)= CO2(g)ΔH3 |
D.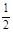 Ba(OH)2(aq)+ Ba(OH)2(aq)+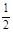 H2SO4(aq) = H2SO4(aq) = 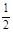 BaSO4(s)+H2O(l)ΔH4 BaSO4(s)+H2O(l)ΔH4 |
F.2NaOH(aq)+H2SO4(aq) = Na2SO4(aq)+2H2O(l) ΔH6
(2)在25℃、101kPa下,16.0g甲醇燃烧生成CO2和液态水时放热363.0kJ。则表示甲醇燃烧热的热化学方程式为
(3)化学反应的能量变化(ΔH)与反应物和生成物的键能有关(键能可以简单理解为断开1mol化学键时所需吸收的能量),下表是部分化学键的键能数据:
| 化学键 | P—P | P—O | O=O | P=O |
| 键能kJ/mol | a | 360 | 500 | 434 |

已知白磷(P4)的燃烧热为2378kJ/mol,白磷完全燃烧的产物(P4O10)的结构如上图所示,则上表中a=
您最近一年使用:0次



