名校
解题方法
1 . 环氧乙烷( ,简称EO)是在有机合成中常用的试剂。EO常温下易燃易爆,其爆炸极限为3~100%。近年来,常用以乙烯、氧气、氮气混合气投料的乙烯氧化法制备EO。部分涉及反应为:
,简称EO)是在有机合成中常用的试剂。EO常温下易燃易爆,其爆炸极限为3~100%。近年来,常用以乙烯、氧气、氮气混合气投料的乙烯氧化法制备EO。部分涉及反应为:


副反应:


(1)已知

 ,则EO的燃烧热为
,则EO的燃烧热为(2)在温度为T,压强为
 的环境下,欲提高乙烯的平衡转化率,需
的环境下,欲提高乙烯的平衡转化率,需(3)向温度为T,体积为V的容器中加入投料比为2:3:2.8的乙烯、氧气、氮气。已知平衡后:
 ,
,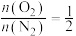 (其中二碳化合物为分子中含两个碳原子的化合物)。忽略其他反应,乙烯的平衡转化率为
(其中二碳化合物为分子中含两个碳原子的化合物)。忽略其他反应,乙烯的平衡转化率为(4)以Ag为催化剂的反应机理如下:
反应Ⅰ:
 慢
慢反应Ⅱ:
 快
快反应Ⅲ:
 快
快①定能够提高主反应反应速率的措施有
A.降低温度 B.通入惰性气体
C.增大
 浓度 D.增大
浓度 D.增大 浓度
浓度②加入1,2-二氯乙烷会发生
 。一定条件下,反应经过一定时间后,EO产率及选择性与1,2-二氯乙烷浓度关系如图。1,2-二氯乙烷能使EO产量先增加后降低的原因是
。一定条件下,反应经过一定时间后,EO产率及选择性与1,2-二氯乙烷浓度关系如图。1,2-二氯乙烷能使EO产量先增加后降低的原因是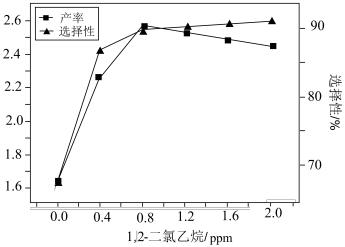
您最近一年使用:0次
2 . 下列热化学方程式中说法正确的是
A. 的燃烧热是 的燃烧热是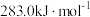 ,则: ,则: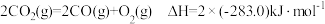 |
B.已知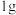 液态肼和足量液态过氧化氢反应生成氮气和水蒸气时放出 液态肼和足量液态过氧化氢反应生成氮气和水蒸气时放出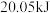 的热量,则: 的热量,则: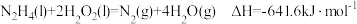 |
C.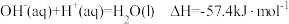 ,则含 ,则含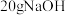 的稀溶液与过量浓硫酸完全反应,放出的热量为 的稀溶液与过量浓硫酸完全反应,放出的热量为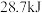 |
D.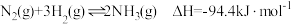 ,在密闭容器中充入 ,在密闭容器中充入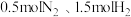 ,充分反应后放出 ,充分反应后放出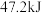 的热量 的热量 |
您最近一年使用:0次
3 . 能源是国民经济发展的重要基础。请根据所学知识回答下列问题:
Ⅰ.在标准状况下,1.68L家用燃料(仅由C、H两种元素组成的某气体)质量为1.2g,在25℃和101kPa下完全燃烧生成 和
和 时,放出66.77kJ的热量。
时,放出66.77kJ的热量。
(1)该气体的分子式为___________ 。该气体的燃烧热
___________ 。(保留一位小数)
Ⅱ.火箭发射时可以用肼( ,液态)作燃料,
,液态)作燃料, 作氧化剂,二者反应生成
作氧化剂,二者反应生成 和水蒸气。
和水蒸气。
已知:
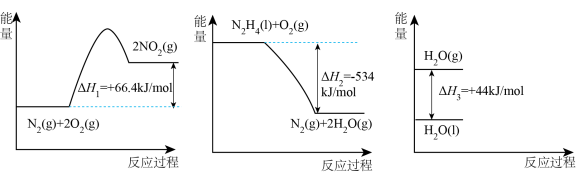
(2)请写出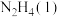 与
与 反应的热化学方程式
反应的热化学方程式___________ 。
(3)32g液态肼与足量 反应生成氮气和液态水时,放出的热量是
反应生成氮气和液态水时,放出的热量是___________ kJ。
(4)上述反应用于火箭推进器的原因:①能快速产生大量气体;②___________ 。
Ⅲ.氢能是一种极具发展潜力的清洁能源。 可用CO在高温下与水蒸气反应制得,是目前大规模制取氢气的方法之一
可用CO在高温下与水蒸气反应制得,是目前大规模制取氢气的方法之一
已知:在25℃、101kPa下,
①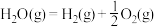
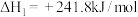
②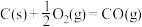
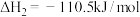
③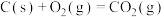

(5)25℃、101kPa下,CO与水蒸气反应转化为 和
和 的热化学方程式为
的热化学方程式为___________ 。
Ⅰ.在标准状况下,1.68L家用燃料(仅由C、H两种元素组成的某气体)质量为1.2g,在25℃和101kPa下完全燃烧生成
 和
和 时,放出66.77kJ的热量。
时,放出66.77kJ的热量。(1)该气体的分子式为

Ⅱ.火箭发射时可以用肼(
 ,液态)作燃料,
,液态)作燃料, 作氧化剂,二者反应生成
作氧化剂,二者反应生成 和水蒸气。
和水蒸气。已知:

(2)请写出
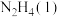 与
与 反应的热化学方程式
反应的热化学方程式(3)32g液态肼与足量
 反应生成氮气和液态水时,放出的热量是
反应生成氮气和液态水时,放出的热量是(4)上述反应用于火箭推进器的原因:①能快速产生大量气体;②
Ⅲ.氢能是一种极具发展潜力的清洁能源。
 可用CO在高温下与水蒸气反应制得,是目前大规模制取氢气的方法之一
可用CO在高温下与水蒸气反应制得,是目前大规模制取氢气的方法之一已知:在25℃、101kPa下,
①
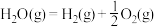
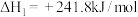
②
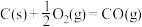
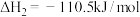
③
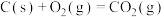

(5)25℃、101kPa下,CO与水蒸气反应转化为
 和
和 的热化学方程式为
的热化学方程式为
您最近一年使用:0次
名校
解题方法
4 . 填空
(1)硫元素广泛存在于自然界中,常与铁、铜等金属元素形成硫化物。黄铁矿( )中S元素的化合价为
)中S元素的化合价为_______ ,黄铜矿( )中Fe元素化合价为
)中Fe元素化合价为_______ 。
(2)氢氟酸是HF的水溶液,工业上用氢氟酸溶蚀玻璃生产磨砂玻璃,其反应原理是_______ (用化学方程式表示)。
(3)天然橡胶的主要成分是聚异戊二烯,其结构简式如下。

写出聚异戊二烯单体的结构简式_______ 。
(4)乙酸乙酯是一种常用的萃取剂。请写出由乙醇和乙酸生成乙酸乙酯的化学方程式_______ 。
(5)工业制氢的一个重要反应是利用 还原
还原 。已知:
。已知:
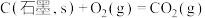



则表示 燃烧热的热化学方程式为
燃烧热的热化学方程式为_______ 。
(6)已知: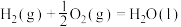
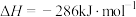

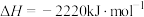
在常温常压下, 和
和 的混合气体共3mol完全燃烧生成
的混合气体共3mol完全燃烧生成 和液态水放出2792kJ的热量,则该混合气体中,
和液态水放出2792kJ的热量,则该混合气体中, 和
和 的体积比为
的体积比为_______ 。
(1)硫元素广泛存在于自然界中,常与铁、铜等金属元素形成硫化物。黄铁矿(
 )中S元素的化合价为
)中S元素的化合价为 )中Fe元素化合价为
)中Fe元素化合价为(2)氢氟酸是HF的水溶液,工业上用氢氟酸溶蚀玻璃生产磨砂玻璃,其反应原理是
(3)天然橡胶的主要成分是聚异戊二烯,其结构简式如下。

写出聚异戊二烯单体的结构简式
(4)乙酸乙酯是一种常用的萃取剂。请写出由乙醇和乙酸生成乙酸乙酯的化学方程式
(5)工业制氢的一个重要反应是利用
 还原
还原 。已知:
。已知: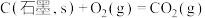



则表示
 燃烧热的热化学方程式为
燃烧热的热化学方程式为(6)已知:
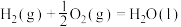
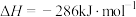

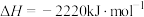
在常温常压下,
 和
和 的混合气体共3mol完全燃烧生成
的混合气体共3mol完全燃烧生成 和液态水放出2792kJ的热量,则该混合气体中,
和液态水放出2792kJ的热量,则该混合气体中, 和
和 的体积比为
的体积比为
您最近一年使用:0次
名校
解题方法
5 . 下列热化学方程式正确的是
| A.31g白磷比31g红磷能量多bkJ,P4(s)=4P(s) △H=-4bkJ•mol-1 |
B.2molSO2、1molO2混合反应后,放出热量akJ,则2SO2(g)+O2(g) 2SO3(g) △H=-akJ•mol-1 2SO3(g) △H=-akJ•mol-1 |
| C.H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ•mol-1,则H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+2H2O(l) △H=-114.6kJ•mol-1 |
D.H2的燃烧热为akJ•mol-1,则H2(g)+ O2(g)=H2O(g) △H=-akJ•mol-1 O2(g)=H2O(g) △H=-akJ•mol-1 |
您最近一年使用:0次
2023-03-19更新
|
1173次组卷
|
2卷引用:吉林省长春外国语学校2023-2024学年高二上学期11月期中考试化学试题
名校
解题方法
6 . 下列说法正确的是
A.甲烷的摩尔燃烧焓为 =-890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) =-890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)  = -890.3kJ/mol = -890.3kJ/mol |
B.500℃、30MPa下,将0.5molN2(g)和1.5molH2(g)置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为N2(g)+3H2(g) 2NH3(g) 2NH3(g)  = -38.6kJ/mol = -38.6kJ/mol |
| C.中和反应的反应热实验中将环形玻璃搅拌棒改为铁质搅拌器对实验结果没有影响 |
D.已知C(s)+O2(g)=CO2(g)  = - a kJ/mol,C(s)+ = - a kJ/mol,C(s)+ O2(g)=CO(g) O2(g)=CO(g)  = - b kJ/mol,则a>b = - b kJ/mol,则a>b |
您最近一年使用:0次
2022-12-09更新
|
244次组卷
|
2卷引用:福建省厦门市国祺中学2021-2022学年高二上学期期中考试化学试题
名校
解题方法
7 . 以下说法中,正确的有几项
Ⅰ.中和反应反应热的测定实验
①为了保证盐酸完全被 中和,采用浓度稍大的
中和,采用浓度稍大的 溶液,使碱稍稍过量
溶液,使碱稍稍过量
②在大烧杯底部垫泡沫塑料(或纸条),以达到保温、隔热、减少实验过程中热量损失的目的,也可在保温杯中进行
③混合溶液时,应将 溶液一次倒入小烧杯,盖好盖板
溶液一次倒入小烧杯,盖好盖板
④混合溶液后,用环形金属搅拌棒轻轻搅动溶液,并准确读取混合溶液的最高温度
⑤单次实验需要记录3次温度计读数
Ⅱ.燃烧热、中和热、能源
⑥101kpa时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热
⑦若酸碱中和反应的离子方程式可以写成 时,中和热为
时,中和热为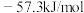
⑧如果有一元弱酸或弱碱参加中和反应,其中和热所放出热量一般都高于
⑨现阶段探索的新能源有太阳能、氢能、风能、地热能、海洋能和生物质能等,它们资源丰富,可以再生,没有污染或很少污染,很可能成为未来的主要能源
⑩燃煤发电是从煤中的化学能开始的一系列能量转换过程,主要包括化学能、热能、机械能、电能
⑪利用高纯单质硅的半导体性能,可以制成光电池,将光能(如太阳光能)直接转换为电能
Ⅰ.中和反应反应热的测定实验
①为了保证盐酸完全被
 中和,采用浓度稍大的
中和,采用浓度稍大的 溶液,使碱稍稍过量
溶液,使碱稍稍过量②在大烧杯底部垫泡沫塑料(或纸条),以达到保温、隔热、减少实验过程中热量损失的目的,也可在保温杯中进行
③混合溶液时,应将
 溶液一次倒入小烧杯,盖好盖板
溶液一次倒入小烧杯,盖好盖板④混合溶液后,用环形金属搅拌棒轻轻搅动溶液,并准确读取混合溶液的最高温度
⑤单次实验需要记录3次温度计读数
Ⅱ.燃烧热、中和热、能源
⑥101kpa时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热
⑦若酸碱中和反应的离子方程式可以写成
 时,中和热为
时,中和热为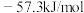
⑧如果有一元弱酸或弱碱参加中和反应,其中和热所放出热量一般都高于

⑨现阶段探索的新能源有太阳能、氢能、风能、地热能、海洋能和生物质能等,它们资源丰富,可以再生,没有污染或很少污染,很可能成为未来的主要能源
⑩燃煤发电是从煤中的化学能开始的一系列能量转换过程,主要包括化学能、热能、机械能、电能
⑪利用高纯单质硅的半导体性能,可以制成光电池,将光能(如太阳光能)直接转换为电能
| A.7 | B.8 | C.9 | D.10 |
您最近一年使用:0次
2022-11-17更新
|
955次组卷
|
3卷引用:内蒙古第一机械制造(集团)有限公司第一中学2022-2023学年高二上学期11月线上期中考试化学试题
名校
解题方法
8 . 利用“萨巴蒂尔反应”[
 ]可在空间站上清除宇航员呼出的
]可在空间站上清除宇航员呼出的 ,并产生供空间站在轨运行的火箭燃料。
,并产生供空间站在轨运行的火箭燃料。
已知:
试回答下列问题:
(1)①表示CO(g)燃烧热的热化学方程式:_______ 。
②C(s)燃烧仅生成CO(g)的热化学方程式:_______ ,当有6gC(s)完全燃烧时,放出_______ kJ热量。
(2)①若2mol由CO(g)、 和
和 组成的混合气体完全燃烧生成
组成的混合气体完全燃烧生成 和
和 ,则其放出的热量(Q)的取值范围是
,则其放出的热量(Q)的取值范围是_______ 。
②等质量的CO(g)、 和
和 完全燃烧生成
完全燃烧生成 和
和 时,放出的热量(Q)由大到小的顺序为
时,放出的热量(Q)由大到小的顺序为_______ (用化学式表示)。
(3)每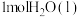 转化为
转化为 时需要吸收热量44kJ,则反应
时需要吸收热量44kJ,则反应

_______  。此反应逆反应活化能
。此反应逆反应活化能 ,则正反应活化能为
,则正反应活化能为_______ (填含a的代数式) 。
。

 ]可在空间站上清除宇航员呼出的
]可在空间站上清除宇航员呼出的 ,并产生供空间站在轨运行的火箭燃料。
,并产生供空间站在轨运行的火箭燃料。已知:
| 物质 | CO(g) |  |  | C(s) |
燃烧热/( ) ) | 283 | 285.8 | 890.3 | 393 |
(1)①表示CO(g)燃烧热的热化学方程式:
②C(s)燃烧仅生成CO(g)的热化学方程式:
(2)①若2mol由CO(g)、
 和
和 组成的混合气体完全燃烧生成
组成的混合气体完全燃烧生成 和
和 ,则其放出的热量(Q)的取值范围是
,则其放出的热量(Q)的取值范围是②等质量的CO(g)、
 和
和 完全燃烧生成
完全燃烧生成 和
和 时,放出的热量(Q)由大到小的顺序为
时,放出的热量(Q)由大到小的顺序为(3)每
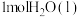 转化为
转化为 时需要吸收热量44kJ,则反应
时需要吸收热量44kJ,则反应

 。此反应逆反应活化能
。此反应逆反应活化能 ,则正反应活化能为
,则正反应活化能为 。
。
您最近一年使用:0次
2022-11-08更新
|
439次组卷
|
3卷引用:河北省邢台市南和区第一中学2022-2023学年高二上学期期中考试化学试题
名校
解题方法
9 . 研究含碳、氮的物质间转化的热效应,在日常生活与工业生产中均有很重要的意义。
(1)已知:H2O(l)= H2O(g) △H= +44.0kJ·mol-1,甲烷完全燃烧与不完全燃烧的热效应如下图所示。
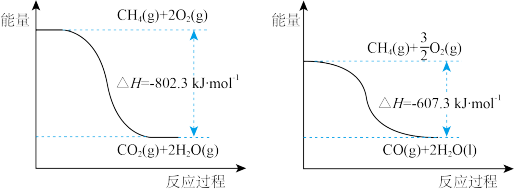
①写出表示甲烷燃烧热的热化学方程式:_______ 。
②CO的燃烧热△H=_______ kJ·mol-1。
(2)已知拆开1 molH-H、1 molN-H、1 mol N ≡N化学键需要的能量分别是436 kJ、391kJ、946kJ, 则N2与H2反应生成NH3的热化学方程式为_______ 。
(3)以NH3、CO2为原料生产尿素[CONH2)2]的反应历程与能量变化示意图如下。
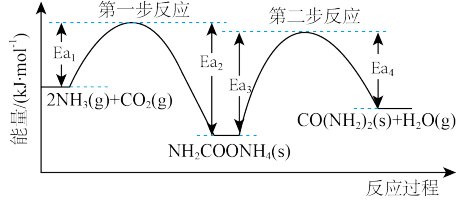
①第一步反应的热化学方程式为_______ 。
②第二步反应的△H_______ 0(填“>”、“<”或“=”)。
③从图象分析决定生产尿素的总反应的反应速率的步骤是第_______ 步反应。
(1)已知:H2O(l)= H2O(g) △H= +44.0kJ·mol-1,甲烷完全燃烧与不完全燃烧的热效应如下图所示。

①写出表示甲烷燃烧热的热化学方程式:
②CO的燃烧热△H=
(2)已知拆开1 molH-H、1 molN-H、1 mol N ≡N化学键需要的能量分别是436 kJ、391kJ、946kJ, 则N2与H2反应生成NH3的热化学方程式为
(3)以NH3、CO2为原料生产尿素[CONH2)2]的反应历程与能量变化示意图如下。

①第一步反应的热化学方程式为
②第二步反应的△H
③从图象分析决定生产尿素的总反应的反应速率的步骤是第
您最近一年使用:0次
2022-09-06更新
|
806次组卷
|
6卷引用: 山东省济宁市泗水县2022-2023学年高二上学期期中考试化学试题
10 . 苯乙烯是一种重要的有机化工原料,可广泛用于合成橡胶,工程塑料及制药等。工业上可通过乙苯催化脱氢来制取苯乙烯,反应方程式如下:
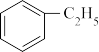 (g)
(g)
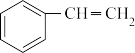 (g)+H2(g) ΔH
(g)+H2(g) ΔH
(1)已知部分物质的燃烧热数据如下表:
则
_______ 。
(2)下列关于反应的说法正确的是_______(填序号)
(3)工业装置通常采用铁基氧化物催化剂,通入过热水蒸气(615~645℃)、水油比(水与乙苯质量比)1.4~1.8、常压的条件下发生乙苯的催化脱氢反应。
①反应中通入水蒸气的作用是_______ 。
②将物质的量分数组成为m%乙苯(g)、n% 的气体通入反应器,在温度t、压强p下进行反应。平衡时,乙苯的转化率为
的气体通入反应器,在温度t、压强p下进行反应。平衡时,乙苯的转化率为 ,则苯乙烯的分压为
,则苯乙烯的分压为_______ ,平衡常数
_______ (以分压表示,分压=总压×物质的量分数)
(4)近年来,有研究者发现若将上述生产过程中通入 改为通入
改为通入 ,通入
,通入 后会发生反应
后会发生反应 。在常压下,分别按投料比为仅乙苯,乙苯
。在常压下,分别按投料比为仅乙苯,乙苯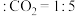 ,乙苯
,乙苯 ,测得乙苯的平衡转化率与温度的关系如下图。
,测得乙苯的平衡转化率与温度的关系如下图。
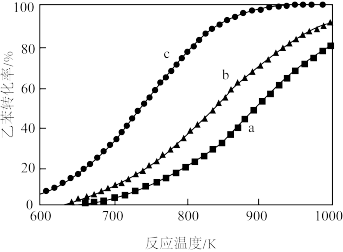
则乙苯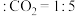 对应的曲线为
对应的曲线为_______ (填“a”,“b”或“c”),理由是_______ 。
 (g)
(g)
 (g)+H2(g) ΔH
(g)+H2(g) ΔH(1)已知部分物质的燃烧热数据如下表:
| 物质 | 乙苯 | 苯乙烯 | 氢气 |
燃烧热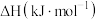 | -4610.2 | -4441.8 | -285.8 |

(2)下列关于反应的说法正确的是_______(填序号)
| A.高温有利于反应自发进行 |
| B.工业生产中应尽可能提高反应温度,并增大压强,以提高原料的利用率 |
| C.恒温恒容条件下,反应达到平衡后,向体系中再充入乙苯蒸气,乙苯的转化率将增大 |
| D.选择合适的催化剂可以缩短达到平衡的时间,但不会提高生成物中苯乙烯的含量 |
①反应中通入水蒸气的作用是
②将物质的量分数组成为m%乙苯(g)、n%
 的气体通入反应器,在温度t、压强p下进行反应。平衡时,乙苯的转化率为
的气体通入反应器,在温度t、压强p下进行反应。平衡时,乙苯的转化率为 ,则苯乙烯的分压为
,则苯乙烯的分压为
(4)近年来,有研究者发现若将上述生产过程中通入
 改为通入
改为通入 ,通入
,通入 后会发生反应
后会发生反应 。在常压下,分别按投料比为仅乙苯,乙苯
。在常压下,分别按投料比为仅乙苯,乙苯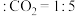 ,乙苯
,乙苯 ,测得乙苯的平衡转化率与温度的关系如下图。
,测得乙苯的平衡转化率与温度的关系如下图。
则乙苯
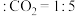 对应的曲线为
对应的曲线为
您最近一年使用:0次



