1 . 已知101kPa、25℃下,1 mol可燃物完全燃烧生成稳定的 化合物时所放出的热量,叫做该物质的燃烧热。已知葡萄糖[C6H12O6(s)]的燃烧热为2804 kJ·mol-1。图中能正确表示反应:6CO2(g)+6H2O(g)=C6H12O6(s)+6O2(g)的能量变化曲线的是
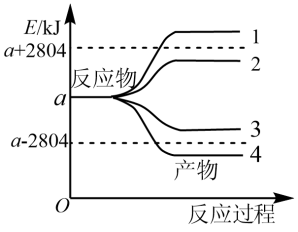
| A.曲线1 | B.曲线2 | C.曲线3 | D.曲线4 |
您最近一年使用:0次
2023-06-26更新
|
521次组卷
|
2卷引用:湖北省新高考联盟2023-2024学年高二上学期8月开学联考化学试题
2 . 苯乙烯是生产塑料和合成橡胶的重要有机原料,国内外目前生产苯乙烯的方法主要是乙苯催化脱氢法,反应方程式为:
(1)已知部分物质的燃烧热数据如下表,利用表中数据计算
_______ (用a、b、c表示) 。
。
(2)实际生产过程中,通常向乙苯中掺混氮气( 不参与反应),保持体系总压为100kPa下进行反应,不同投料比m下乙苯的平衡转化率随反应温度变化关系如图所示。(其中投料比m为原料气中乙苯和
不参与反应),保持体系总压为100kPa下进行反应,不同投料比m下乙苯的平衡转化率随反应温度变化关系如图所示。(其中投料比m为原料气中乙苯和 的物质的量之比,取值分别为1∶0、1∶1、1∶5、1∶9)
的物质的量之比,取值分别为1∶0、1∶1、1∶5、1∶9)
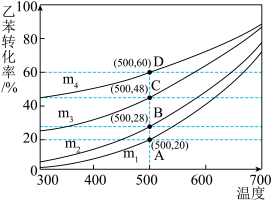
①在乙苯中掺混氮气的目的是_______ 。
②投料比m为1∶0的曲线是_______ (填曲线标号)。
③若一定的投料比,反应温度恒定时,并保持体系总压为常压的条件下进行反应,下列事实能作为该反应达到平衡的依据的是_______ (填字母)。
A.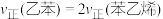
B.容器内气体密度不再变化
C.容器内苯乙烯与 的分子数之比不再变化
的分子数之比不再变化
D.容器内气体的平均相对分子质量不再变化
(3)近年来,有研究者发现若将上述生产过程中通入 改为通入
改为通入 ,在
,在 气氛中乙苯催化脱氢制苯乙烯更容易进行,反应历程如图:
气氛中乙苯催化脱氢制苯乙烯更容易进行,反应历程如图:

①该过程中发生反应的化学方程式为_______ 。
②根据反应历程分析,催化剂表面酸碱性对乙苯脱氢反应性能影响较大,如果催化剂表面碱性太强,会降低乙苯的转化率,碱性太强使乙苯转化率降低的原因是_______ (说出一点即可)。
③在600℃下,向恒容密闭容器中充入2mol乙苯和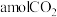 ,平衡时乙苯的转化率为50%,且容器内气体总物质的量为5mol,则
,平衡时乙苯的转化率为50%,且容器内气体总物质的量为5mol,则
_______ 。

(1)已知部分物质的燃烧热数据如下表,利用表中数据计算

 。
。| 物质 | 燃烧热 |
| 乙苯 |  |
| 苯乙烯 |  |
| 氢气 | 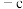 |
(2)实际生产过程中,通常向乙苯中掺混氮气(
 不参与反应),保持体系总压为100kPa下进行反应,不同投料比m下乙苯的平衡转化率随反应温度变化关系如图所示。(其中投料比m为原料气中乙苯和
不参与反应),保持体系总压为100kPa下进行反应,不同投料比m下乙苯的平衡转化率随反应温度变化关系如图所示。(其中投料比m为原料气中乙苯和 的物质的量之比,取值分别为1∶0、1∶1、1∶5、1∶9)
的物质的量之比,取值分别为1∶0、1∶1、1∶5、1∶9)
①在乙苯中掺混氮气的目的是
②投料比m为1∶0的曲线是
③若一定的投料比,反应温度恒定时,并保持体系总压为常压的条件下进行反应,下列事实能作为该反应达到平衡的依据的是
A.
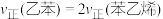
B.容器内气体密度不再变化
C.容器内苯乙烯与
 的分子数之比不再变化
的分子数之比不再变化 D.容器内气体的平均相对分子质量不再变化
(3)近年来,有研究者发现若将上述生产过程中通入
 改为通入
改为通入 ,在
,在 气氛中乙苯催化脱氢制苯乙烯更容易进行,反应历程如图:
气氛中乙苯催化脱氢制苯乙烯更容易进行,反应历程如图:
①该过程中发生反应的化学方程式为
②根据反应历程分析,催化剂表面酸碱性对乙苯脱氢反应性能影响较大,如果催化剂表面碱性太强,会降低乙苯的转化率,碱性太强使乙苯转化率降低的原因是
③在600℃下,向恒容密闭容器中充入2mol乙苯和
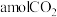 ,平衡时乙苯的转化率为50%,且容器内气体总物质的量为5mol,则
,平衡时乙苯的转化率为50%,且容器内气体总物质的量为5mol,则
您最近一年使用:0次
名校
解题方法
3 . 周期表中ⅤA族元素及其化合物作用广泛。氨是重要的化工原料,广泛用于生产铵盐、硝酸、纯碱、医药等;肼 的燃烧热为
的燃烧热为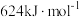 ,是常用的火箭燃料;氮和磷都是植物生长的营养元素,单质磷可由磷酸钙、石英砂和碳粉在电弧炉中熔烧制得;砷化镓是典型的二代半导体材料,在700~900℃条件下,
,是常用的火箭燃料;氮和磷都是植物生长的营养元素,单质磷可由磷酸钙、石英砂和碳粉在电弧炉中熔烧制得;砷化镓是典型的二代半导体材料,在700~900℃条件下, 与
与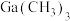 通过化学气相沉积可制得砷化镓晶体;铅锑合金一般用作铅蓄电池的负极材料。下列化学反应表示正确的是
通过化学气相沉积可制得砷化镓晶体;铅锑合金一般用作铅蓄电池的负极材料。下列化学反应表示正确的是
 的燃烧热为
的燃烧热为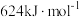 ,是常用的火箭燃料;氮和磷都是植物生长的营养元素,单质磷可由磷酸钙、石英砂和碳粉在电弧炉中熔烧制得;砷化镓是典型的二代半导体材料,在700~900℃条件下,
,是常用的火箭燃料;氮和磷都是植物生长的营养元素,单质磷可由磷酸钙、石英砂和碳粉在电弧炉中熔烧制得;砷化镓是典型的二代半导体材料,在700~900℃条件下, 与
与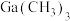 通过化学气相沉积可制得砷化镓晶体;铅锑合金一般用作铅蓄电池的负极材料。下列化学反应表示正确的是
通过化学气相沉积可制得砷化镓晶体;铅锑合金一般用作铅蓄电池的负极材料。下列化学反应表示正确的是A.肼的燃烧: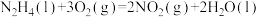  |
B.制单质磷: |
C.制砷化镓晶体: |
D.铅蓄电池放电时的负极反应: |
您最近一年使用:0次
2023-02-11更新
|
446次组卷
|
4卷引用:重庆市2023-2024学年高二下学期开学考试化学试题
4 . 氢能是极具发展潜力的清洁能源,以氢燃料为代表的燃料电池有良好的应用前景。
(1) 时,
时,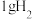 燃烧生成
燃烧生成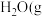 )放热
)放热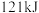 ,
, 蒸发吸热
蒸发吸热 ,表示
,表示 燃烧热的热化学方程式为
燃烧热的热化学方程式为_______ 。
(2)工业上常用甲烷水蒸气重整制备氢气,体系中发生如下反应。
Ⅰ.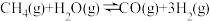
Ⅱ.
①下列操作中,能提高 平衡转化率的是
平衡转化率的是_______ (填标号)。
A.增加 用量 B.恒温恒压下通入惰性气体
用量 B.恒温恒压下通入惰性气体
C.移除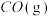 D.加入催化剂
D.加入催化剂
②恒温恒压条件下,1molCH4(g)和1molH2O(g)反应达平衡时, 的转化率为
的转化率为 ,
, 的物质的量为
的物质的量为 ,则反应Ⅰ的平衡常数
,则反应Ⅰ的平衡常数
_______ (写出含有α、b的计算式;对于反应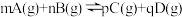 ,
,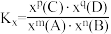 ,x为物质的量分数)。其他条件不变,
,x为物质的量分数)。其他条件不变, 起始量增加到
起始量增加到 ,达平衡时,
,达平衡时,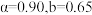 ,平衡体系中
,平衡体系中 的物质的量分数为
的物质的量分数为_______ (结果保留两位有效数字)。
(3)氢氧燃料电池中氢气在_______ (填“正”或“负”)极发生反应。
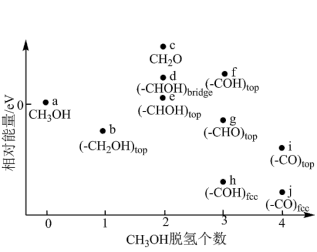
(4)在允许 自由迁移的固体电解质燃料电池中,
自由迁移的固体电解质燃料电池中,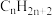 放电的电极反应式为
放电的电极反应式为_______ 。
(5)甲醇燃料电池中,吸附在催化剂表面的甲醇分子逐步脱氢得到CO,四步可能脱氢产物及其相对能量如图,则最可行途径为a→_______ (用 等代号表示)。
等代号表示)。
(1)
 时,
时,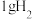 燃烧生成
燃烧生成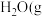 )放热
)放热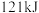 ,
, 蒸发吸热
蒸发吸热 ,表示
,表示 燃烧热的热化学方程式为
燃烧热的热化学方程式为(2)工业上常用甲烷水蒸气重整制备氢气,体系中发生如下反应。
Ⅰ.
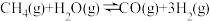
Ⅱ.

①下列操作中,能提高
 平衡转化率的是
平衡转化率的是A.增加
 用量 B.恒温恒压下通入惰性气体
用量 B.恒温恒压下通入惰性气体C.移除
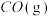 D.加入催化剂
D.加入催化剂②恒温恒压条件下,1molCH4(g)和1molH2O(g)反应达平衡时,
 的转化率为
的转化率为 ,
, 的物质的量为
的物质的量为 ,则反应Ⅰ的平衡常数
,则反应Ⅰ的平衡常数
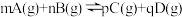 ,
,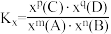 ,x为物质的量分数)。其他条件不变,
,x为物质的量分数)。其他条件不变, 起始量增加到
起始量增加到 ,达平衡时,
,达平衡时, ,平衡体系中
,平衡体系中 的物质的量分数为
的物质的量分数为(3)氢氧燃料电池中氢气在
(4)在允许
 自由迁移的固体电解质燃料电池中,
自由迁移的固体电解质燃料电池中, 放电的电极反应式为
放电的电极反应式为(5)甲醇燃料电池中,吸附在催化剂表面的甲醇分子逐步脱氢得到CO,四步可能脱氢产物及其相对能量如图,则最可行途径为a→
 等代号表示)。
等代号表示)。
您最近一年使用:0次
2022-07-01更新
|
10095次组卷
|
9卷引用:天津市耀华中学2023-2024学年高三下学期开学验收考化学试卷
天津市耀华中学2023-2024学年高三下学期开学验收考化学试卷(已下线)专题14 化学反应原理综合题-2022年高考真题模拟题分项汇编(已下线)2022年新高考河北省高考真题化学试题(部分试题)2022年河北省高考真题化学试题(已下线)热点情景汇编-专题十二 原理应用中的新概念(已下线)2022年河北省高考真题变式题(14-18)(已下线)专题17 原理综合题(已下线)专题17 原理综合题陕西省西安市西北工业大学附属中学2023-2024学年高二上学期第一次月考化学试题
名校
解题方法
5 . 化学反应过程中发生物质变化的同时,常常伴有能量的变化。这种能量的变化常以热量的形式表现出来,叫作反应热。由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等。
(1)下列∆H表示物质燃烧热的是_______ ;不能表示物质中和热的是_______ 。(填字母)
A.H2(g)+ O2(g)=2H2O(g) ∆H1
O2(g)=2H2O(g) ∆H1
B.C(s)+ O2(g)=CO(g) ∆H2
O2(g)=CO(g) ∆H2
C.CH4(g)+2O2g)=CO2(g)+2H2O(l) ∆H3
D.C(s)+O2(g)=CO2(g) ∆H4
E.C6H12O6(s)+3O2(g)=6CO(g)+6H2O(1) ∆H5
F.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ∆H6
G.2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l) ∆H7
H.CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) ∆H8
(2)2.00 g C2H2气体完全燃烧生成液态水和CO2气体,放出99.8kJ的热量,写出该反应燃烧热的热化学方程式:_______
(3)充分燃烧一定量的丁烷放出的热量为Q,生成的CO2恰好与100mL浓度为4mol∙L-1的KOH溶液完全反应生成正盐。则燃烧lmol丁烷放出的热量为_______ 。
(4)4.4g丙烷完全燃烧生成的CO2与100 mL浓度为4mol∙L-1的KOH溶液恰好完全反应,则反应后的溶液中酸式盐的物质的量是_______ mol
(5)氢能源有可能实现能源的贮存,也有可能实现经济,高效的输送。研究表明过渡金属型氢化物(又称间充氢化物),在这类氢化物中,氢原子填充在金属的晶格间隙之间,其组成不固定,通常是非化学计量的,如,LaH2.76、TiH1.73、CeH2.69、ZrH1.98、PrH2.65、TaH0.78。已知标准状况下,1体积的钯粉大约可吸附840体积的氢气(钯粉的密度为10.64g∙cm-3,相对原子质量为106.4),试写出钯(Pd)的氢化物的化学式_____ 。
(1)下列∆H表示物质燃烧热的是
A.H2(g)+
 O2(g)=2H2O(g) ∆H1
O2(g)=2H2O(g) ∆H1 B.C(s)+
 O2(g)=CO(g) ∆H2
O2(g)=CO(g) ∆H2C.CH4(g)+2O2g)=CO2(g)+2H2O(l) ∆H3
D.C(s)+O2(g)=CO2(g) ∆H4
E.C6H12O6(s)+3O2(g)=6CO(g)+6H2O(1) ∆H5
F.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ∆H6
G.2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l) ∆H7
H.CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) ∆H8
(2)2.00 g C2H2气体完全燃烧生成液态水和CO2气体,放出99.8kJ的热量,写出该反应燃烧热的热化学方程式:
(3)充分燃烧一定量的丁烷放出的热量为Q,生成的CO2恰好与100mL浓度为4mol∙L-1的KOH溶液完全反应生成正盐。则燃烧lmol丁烷放出的热量为
(4)4.4g丙烷完全燃烧生成的CO2与100 mL浓度为4mol∙L-1的KOH溶液恰好完全反应,则反应后的溶液中酸式盐的物质的量是
(5)氢能源有可能实现能源的贮存,也有可能实现经济,高效的输送。研究表明过渡金属型氢化物(又称间充氢化物),在这类氢化物中,氢原子填充在金属的晶格间隙之间,其组成不固定,通常是非化学计量的,如,LaH2.76、TiH1.73、CeH2.69、ZrH1.98、PrH2.65、TaH0.78。已知标准状况下,1体积的钯粉大约可吸附840体积的氢气(钯粉的密度为10.64g∙cm-3,相对原子质量为106.4),试写出钯(Pd)的氢化物的化学式
您最近一年使用:0次
6 . 下列依据热化学方程式得出的结论正确的是( )
| A.已知2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·mol-1,则氢气的燃烧热为241.8 kJ·mol-1 |
| B.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出的热量小于57.3 kJ |
| C.已知2C(s)+2O2(g)=2CO2(g) ΔH=a 2C(s)+O2(g)=2CO(g) ΔH=b,则a>b |
| D.已知P4(白磷,s)=4P(红磷,s) ΔH<0,则白磷比红磷稳定 |
您最近一年使用:0次
2019-12-24更新
|
503次组卷
|
7卷引用:云南省玉溪市元江县第一中学2018-2019学年高二下学期开学考试化学试题
名校
解题方法
7 . 下列有关热化学方程式的叙述正确的是
| A.已知甲烷的燃烧热为890.3 kJ﹒mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=2CO2(g)+2H2O(g) ΔH=-890.3kJ/mol |
| B.已知C(石墨,s)=C(金刚石,s)ΔH>0,则金刚石比石墨稳定 |
| C.已知中和热为ΔH=-57.4kJ/mol,则1mol稀硫酸和足量稀NaOH溶液反应的反应热就是中和热 |
| D.已知S(g)+O2(g)=SO2(g) ΔH1;S(s)+O2(g)=SO2(g) ΔH2,则ΔH1<ΔH2; |
您最近一年使用:0次
2019-11-27更新
|
1492次组卷
|
26卷引用:安徽省凤阳县二中2018-2019学年高二下学期开学摸底考试化学试题
安徽省凤阳县二中2018-2019学年高二下学期开学摸底考试化学试题2016届宁夏大学附属中学高三上学期第三次月考理综化学试卷2015-2016学年浙江省杭州二中高二上学期期末化学试卷2016届江西省上高二中高三下4月半月考理综化学试卷2016-2017学年河北省唐山一中高二上10月月考化学卷2016-2017学年西藏山南二中高二上学期期中化学试卷福建省福州市闽侯县2016-2017学年高二下学期期末考试化学试题黑龙江省哈尔滨市第六中学2018届高三上学期期中考试化学试题湖南省衡阳县第四中学2018-2019学年高二第一学期实验班9月月考化学试题【全国百强校】黑龙江省哈尔滨市第六中学2019届高三上学期期中考试化学试题河北省唐山一中2019届高三上学期期中考试化学试题山西运城盐湖五中2018-2019学年高二第一学期9月月考化学试题甘肃省永昌四中2019-2020学年高二上学期期中考试化学试题辽宁省辽河油田第二高级中学2020届高三11月月考化学试题云南省曲靖会泽县第一中学2018-2019学年高二下学期第一次质检考试化学试题辽宁省大连市一〇三中学2020届高三上学期12月月考化学试题2019年秋高三化学复习强化练习—— 中和热浙江省桐庐分水高级中学2018-2019学年高二下学期期中考试化学试题安徽省滁州市新锐学校2019-2020学年高二上学期期末考试理综化学试卷福建省建瓯市芝华中学2020-2021学年高二上学期期中考试化学(选考班)试题江西省抚州市金溪县第一中学2020-2021学年高二上学期第一次月考化学试题天津市第三中学2021-2022学年高二上学期期中考试化学试题辽宁省渤海大学附属高级中学2021-2022学年高一下学期第二次阶段性考试化学试题湖北省南漳县第二中学2021-2022学年高二上学期期中考试化学试题广西百色民族高级中学2022-2023学年高二上学期10月阶段检测化学试题(已下线)专题01 反应热、焓变与热化学方程式【考点清单】(讲+练)-2023-2024学年高二化学期中考点大串讲(人教版2019选择性必修1)
名校
8 . 下列推论正确的是
| A.2C(s)+O2(g)=2CO(g) ΔH=-221kJ·mol-1,则碳的燃烧热的数值大于110.5kJ·mol-1 |
| B.C(石墨,s)=C(金刚石,s) ΔH=+1.9kJ·mol-1,则金刚石比石墨稳定 |
| C.OH-(aq) + H+(aq) = H2O(l) ΔH=-57.4kJ·mol-1,则:含20gNaOH的稀溶液与过量稀醋酸完全反应,放出的热量为28.7kJ |
| D.S(g)+O2(g)=SO2(g) ΔH1;S(s)+O2===SO2(g) ΔH2,则ΔH1>ΔH2 |
您最近一年使用:0次
2019-06-22更新
|
1217次组卷
|
7卷引用:湖北省襄阳五中2020-2021学年高二上学期入学考试化学试题
湖北省襄阳五中2020-2021学年高二上学期入学考试化学试题四川省宁南中学2018-2019学年高二下学期第一次月考化学试题河北省保定市唐县第一中学2018-2019学年高一下学期期中考试化学试题云南省玉溪市玉溪一中2019-2020学年高二上学期第一次月考化学试题(已下线)专题05 化学反应与能量——备战2021年高考化学纠错笔记(已下线)专题09 化学反应与能量变化-备战2022年高考化学学霸纠错(全国通用)黑龙江省齐齐哈尔市第八中学校2023-2024学年高二下学期三月月考化学试题
名校
9 . 下列关于各图的叙述正确的是
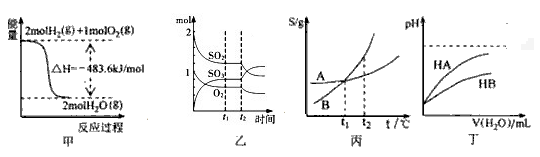

| A.图甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8 kJ•mol-1 |
B.图乙表示一定条件下进行的反应2SO2+O2 2SO3各成分的物质的量变化,t2时刻改变的条件一定是缩小容器体积 2SO3各成分的物质的量变化,t2时刻改变的条件一定是缩小容器体积 |
| C.图丙表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数ω(B)>ω(A) |
| D.图丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度的NaB溶液的pH |
您最近一年使用:0次
10 . 下列热化学方程式或离子方程式正确的是
| A.已知H2的标准燃烧热ΔH=-285.8 kJ·mol-1,则用热化学方程式可表示为:H2(g)+1/2O2(g)===H2O(g)ΔH=-285.8 kJ·mol-1 |
| B.NaClO溶液与FeCl2溶液混合:Fe2++2ClO-+2H2O===Fe(OH)2↓+2HClO |
C.NH4HSO3溶液与足量NaOH溶液共热:NH4++H++2OH- NH3↑+2H2O NH3↑+2H2O |
| D.用足量KMnO4溶液吸收SO2气体:2MnO4-+5SO2+2H2O===2Mn2++5SO42-+4H+ |
您最近一年使用:0次
2016-12-09更新
|
996次组卷
|
3卷引用:2016届山东省临清二中新高三开学初模拟检测化学试卷



