名校
解题方法
1 . 化学反应与能量以及化学平衡原理是中学化学学习的重要内容。请回答下列问题:
⑴已知:CH4、H2的燃烧热(△H)分别为-890.3 kJ/mol、-285.8kJ/mol,则CO2和H2反应生成CH4和H2O(l)的热化学方程式是_________________________________ 。
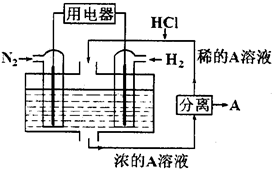
⑵设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示。电池正极的电极反应式是_____________ ,A是______________ 。
⑶25 ℃时,向含amol NH4Cl的水溶液滴加bL氨水后溶液呈中性,则所滴加氨水的浓度为________ mol·L-1。(NH3·H2O的电离平衡常数取Kb=2×10-5)
⑷甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上可用合成气制备甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
如图是该反应在不同温度下CO的转化率随时间变化的曲线。

①该反应的焓变△H_______ 0 (填“>”、“<”或“=”)。
②T1和T2温度下的平衡常数大小关系是K1_______ K2(填“>”、“<”或“=”)。
③若容器容积不变,下列措施可增加甲醇产率的是_________ 。
A.升高温度
B.将CH3OH(g)从体系中分离
C.使用合适的催化剂
D.充入He,使体系总压强增大
⑴已知:CH4、H2的燃烧热(△H)分别为-890.3 kJ/mol、-285.8kJ/mol,则CO2和H2反应生成CH4和H2O(l)的热化学方程式是
⑵设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示。电池正极的电极反应式是

⑶25 ℃时,向含amol NH4Cl的水溶液滴加bL氨水后溶液呈中性,则所滴加氨水的浓度为
⑷甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上可用合成气制备甲醇,反应方程式为CO(g)+2H2(g)
 CH3OH(g)
CH3OH(g)如图是该反应在不同温度下CO的转化率随时间变化的曲线。

①该反应的焓变△H
②T1和T2温度下的平衡常数大小关系是K1
③若容器容积不变,下列措施可增加甲醇产率的是
A.升高温度
B.将CH3OH(g)从体系中分离
C.使用合适的催化剂
D.充入He,使体系总压强增大
您最近一年使用:0次
名校
2 . 发射“神六“时用肼(N2H4)作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气。
已知:N2(g) + 2O2(g) = 2NO2(g); △H = + 67.7kJ/mol
N2H4(g) + O2(g) = N2(g) + 2H2O(g); △H = – 534kJ/mol
下列关于肼和NO2反应的热化学方程式中,正确的是
已知:N2(g) + 2O2(g) = 2NO2(g); △H = + 67.7kJ/mol
N2H4(g) + O2(g) = N2(g) + 2H2O(g); △H = – 534kJ/mol
下列关于肼和NO2反应的热化学方程式中,正确的是
| A.2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(l);△H = – 1135.7kJ/mol |
| B.2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(g);△H = – 1000.3kJ/mol |
| C.N2H4(g) + NO2(g) =3/2N2(g) + 2H2O(l);△H = – 568.35kJ/mol |
| D.2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(g);△H = – 1135.7kJ/mol |
您最近一年使用:0次
2017-11-11更新
|
199次组卷
|
4卷引用:福建省莆田第一中学2017-2018学年高二下学期期初考试化学试题
名校
3 . 有科学家预言,氢能将成为21世纪的主要能源,而且是一种理想的绿色能源。
(1)氢能被称为绿色能源的原因是________________ (任答一点)
(2)在101kPa下,1g氢气完全燃烧生成液态水放出142.9kJ的热量,请回答下列问题
①该反应反应物总能量______________ 生成物总能量(填“大于”,“小于”或“等于”)
②氢气的燃烧热为______________
③该反应的热化学方程式为__________________________________________________
④若1mol氢气完全燃烧生成1mol气态水放出241kJ的热量,已知H-O键能为463 kJ·mol-1,O=O键能为498 kJ·mol-1,计算H-H键能为_____________ kJ·mol-1
(3)氢能的存储是氢能利用的前提,科学家研究出一种储氢合金Mg2Ni,已知:
Mg(s)+H2(g)=MgH2(s) ΔH1=-74.5kJ·mol-1;
Mg2Ni(s)+2H2(g)=Mg2NiH4(s) ΔH2=-64.4kJ·mol-1;
Mg2Ni(s)+2MgH2(s)=2Mg(s)+Mg2NiH4(s) ΔH3。
则ΔH3=____________ kJ·mol-1
(1)氢能被称为绿色能源的原因是
(2)在101kPa下,1g氢气完全燃烧生成液态水放出142.9kJ的热量,请回答下列问题
①该反应反应物总能量
②氢气的燃烧热为
③该反应的热化学方程式为
④若1mol氢气完全燃烧生成1mol气态水放出241kJ的热量,已知H-O键能为463 kJ·mol-1,O=O键能为498 kJ·mol-1,计算H-H键能为
(3)氢能的存储是氢能利用的前提,科学家研究出一种储氢合金Mg2Ni,已知:
Mg(s)+H2(g)=MgH2(s) ΔH1=-74.5kJ·mol-1;
Mg2Ni(s)+2H2(g)=Mg2NiH4(s) ΔH2=-64.4kJ·mol-1;
Mg2Ni(s)+2MgH2(s)=2Mg(s)+Mg2NiH4(s) ΔH3。
则ΔH3=
您最近一年使用:0次
2017-05-20更新
|
1078次组卷
|
6卷引用:福建省德化县第一中学2022-2023学年高二上学期开学检测化学试题
名校
4 . (Ⅰ)50mL0.5mol·L-1的盐酸与50mL0.55mol·L-1的NaOH溶液在下图所示的位置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,可知下图装置有三处不妥之处,请指出____________ 。

(2)在测定中和热的实验中,计算反应热时需要的数据有_________
①酸的浓度和体积 ②碱的浓度和体积 ③比热容 ④反应前后溶液的温度差 ⑤操作所需时间
A.①②③⑤ B. ①②③④ C. ②③④⑤ D. ①③④⑤
(3)实验中改用60mL0.50mol·L-1的盐酸跟50mL0.55mol·L-1的NaOH溶液进行反应,与上述实验相比,所求中和热_________ (填“相等”或“不相等”),所放出的热量________ (填“相等”或“不相等”)。
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会______ (填“偏大”、“偏小”或“无影响”).
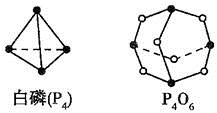
(Ⅱ)(5)化学反应可视为旧键断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量,已知白磷和P4O6 的分子结构如下图所示,现提供以下化学键的键能: :
: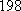 kJ·mol-1,
kJ·mol-1, :
: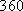 kJ·mol-1,
kJ·mol-1,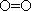 :
: kJ·mol-1,则反应P4(白磷) +3O2=P4O6的热化学反应方程式为
kJ·mol-1,则反应P4(白磷) +3O2=P4O6的热化学反应方程式为__________________ 。
(6)肼(N2H4)可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)═N2O4(l) △H1═-19.5kJ•mol-1
②N2H4(l)+O2(g)═N2(g)+2H2O(g) △H2═-534.2kJ•mol-1
写出肼和N2O4反应的热化学方程式___________________ 。
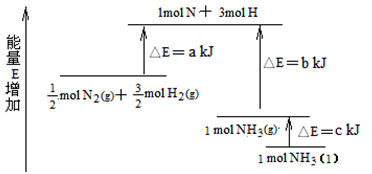
(7)化学反应N2+3H2 2NH3的能量变化如图所示,该反应生成NH3(I)的热化学方程式是
2NH3的能量变化如图所示,该反应生成NH3(I)的热化学方程式是______________ 。
(1)从实验装置上看,可知下图装置有三处不妥之处,请指出

(2)在测定中和热的实验中,计算反应热时需要的数据有
①酸的浓度和体积 ②碱的浓度和体积 ③比热容 ④反应前后溶液的温度差 ⑤操作所需时间
A.①②③⑤ B. ①②③④ C. ②③④⑤ D. ①③④⑤
(3)实验中改用60mL0.50mol·L-1的盐酸跟50mL0.55mol·L-1的NaOH溶液进行反应,与上述实验相比,所求中和热
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会
(Ⅱ)(5)化学反应可视为旧键断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量,已知白磷和P4O6 的分子结构如下图所示,现提供以下化学键的键能:
 :
: kJ·mol-1,
kJ·mol-1, :
: kJ·mol-1,
kJ·mol-1,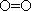 :
: kJ·mol-1,则反应P4(白磷) +3O2=P4O6的热化学反应方程式为
kJ·mol-1,则反应P4(白磷) +3O2=P4O6的热化学反应方程式为
(6)肼(N2H4)可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)═N2O4(l) △H1═-19.5kJ•mol-1
②N2H4(l)+O2(g)═N2(g)+2H2O(g) △H2═-534.2kJ•mol-1
写出肼和N2O4反应的热化学方程式
(7)化学反应N2+3H2
 2NH3的能量变化如图所示,该反应生成NH3(I)的热化学方程式是
2NH3的能量变化如图所示,该反应生成NH3(I)的热化学方程式是
您最近一年使用:0次
2017-02-23更新
|
694次组卷
|
2卷引用:福建省厦门第一中学2016-2017学年高二下学期开学考试理综-化学试题
名校
5 . 已知1 mol白磷(s)转化为1 mol红磷,放出18.39 kJ热量,又知:
4P(白、s)+5O2(g)=2P2O5 (s) △H1①
4P(红、s)+5O2(g)=2P2O5 (s) △H2②
则△H1和△H2的关系正确的是:
4P(白、s)+5O2(g)=2P2O5 (s) △H1①
4P(红、s)+5O2(g)=2P2O5 (s) △H2②
则△H1和△H2的关系正确的是:
| A.△H1<△H2 | B.△H1>△H2 | C.△H1=△H2 | D.无法确定 |
您最近一年使用:0次
2017-02-23更新
|
142次组卷
|
3卷引用:福建省厦门第一中学2016-2017学年高二下学期开学考试理综-化学试题
6 . 已知: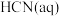 与
与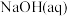 反应的
反应的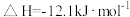 ;
;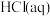 与
与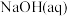 反应的
反应的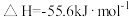 。则
。则 在水溶液中电离的
在水溶液中电离的 等于
等于
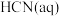 与
与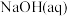 反应的
反应的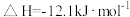 ;
;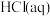 与
与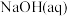 反应的
反应的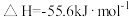 。则
。则 在水溶液中电离的
在水溶液中电离的 等于
等于A.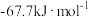 | B. |
C.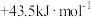 | D.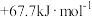 |
您最近一年使用:0次
2016-12-09更新
|
1958次组卷
|
72卷引用:福建省龙岩第一中学2021-2022学年高二上学期开学考试化学试题
福建省龙岩第一中学2021-2022学年高二上学期开学考试化学试题山东省济南市历城第二中学2017-2018学年高二下学期开学考试化学试题福建省晋江市南侨中学2018-2019学年高二下学期第二次月考化学试题福建省晋江市南侨中学2019-2020学年高二上学期第一阶段考试化学试题甘肃省民勤县第一中学2020-2021学年高二下学期(理)开学考试化学试题福建省龙岩第一中学2022-2023学年高二上学期第一次月考(普通班)化学试题(已下线)2010年长春外国语学校高二第一学期期末考试化学试卷(已下线)2011-2012学年湖北省荆州中学高二上学期期中考试化学试卷(已下线)2011—2012学年黑龙江哈九中度高二上学期期中考试化学试卷(已下线)2013-2014广东汕头市金山中学第一学期期末高二化学试卷(已下线)2014-2015学年甘肃省兰州一中高二上学期期中考试化学卷(已下线)2014秋湖北省武汉市部分重点中学高二上学期期中联考化学试卷2014-2015陕西省西安市庆安高级中学高二上学期期末化学试卷2014-2015陕西省西安市一中高二上学期期末化学试卷2014-2015陕西省西安市七十中高二上学期期末考试化学试卷2015-2016学年河北省行唐启明中学高二上学期第一次月考化学试卷2015-2016学年湖南省浏阳、攸县一中高二上期中联考化学试卷2015-2016学年江西省丰城中学高二上学期期中考试化学试卷2015-2016学年广西宾阳县宾阳中学高二5月月考化学试卷2016-2017学年青海师大附中高二上期中化学试卷河南省中原名校(即豫南九校)2017-2018学年高二上学期第一次联考化学试题河南省八市2017-2018学年高二上学期第一次质量检测化学试题山西省大同市第一中学2017-2018学年高二上学期期中考试化学试题内蒙古巴彦淖尔市第一中学2017-2018学年高二上学期期中考试(A卷)化学试题四川省南充高级中学2017-2018学年高二12月月考化学试题安徽省淮北市第一中学2017-2018学年高二下学期第一次月考化学试题1人教版高二化学选修四专题:化学反应热的计算同步练习卷【全国百强校】安徽省铜陵市第一中学2018-2019学年高二上学期10月月考化学试题【全国百强校】河南省信阳市高级中学2018-2019学年高二上学期10月月考化学试题2【校级联考】湖北省孝感市七校教学联盟2018-2019学年高二上学期期中联合考试化学试题河南省上蔡县第二高级中学2018-2019学年高二上学期期中考试化学试题河北安平中学2018-2019学年高二下学期期末考试化学试题(已下线)2019年9月1日《每日一题》人教选修4—— 每周一测浙江省宁波诺丁汉大学附属中学2017-2018学年高二上学期期中考试化学试题云南省保山市第一中学2018-2019学年高二下学期期末化学试题宁夏吴忠中学2019-2020学年高二上学期期中考试化学试题河北省沧州市泊头市第一中学2019-2020学年高二月考检测化学试题四川省雅安市2019-2020学年高二上学期期末检测化学试题河北省泊头市第一中学2019-2020学年高二上学期期末模拟考试化学试卷陕西省榆林市绥德县绥德中学2019-2020高二下学期第一次阶段性测试化学试题河南省驻马店市2018-2019学年高二上学期期末考试化学试题吉林省白城市洮南市第一中学2020-2021学年高二上学期第一次月考化学试题河北省保定市唐县第一中学2020-2021学年高二9月月考化学试题(已下线)【全国百强校】广西桂林市第十八中学2018-2019学年高二下学期期中段考化学试题陕西省汉中市洋县中学2018-2019学年高二上学期第一次月考化学试题河南省豫北名校2020-2021学年高二上学期11月质量检测化学试题江苏省南京市第十二中学2020-2021学年高二上学期第一次学情调研测试化学试题广西南宁市上林县中学2020-2021学年高二上学期期末考试化学试题江苏省海安市实验中学2021-2022学年高二上学期第一次月考化学试题广西浦北中学2021-2022学年高二上学期第一次月考化学试题(已下线)必考点01 化学反应的热效应-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版2019选择性必修1)重庆市第七中学校2021-2022学年高二上学期期中考试化学试题山东省青岛第二中学2019-2020学年高二上学期期中考试化学试题四川省乐山沫若中学2022-2023学年高二上学期第二次月考(期中考试)化学试题天津市第二中学2022-2023学年高二上学期期中检测化学试题安徽省合肥市肥东县综合高中2022-2023学年高二上学期11月期中考试化学试题2010年普通高等学校招生全国统一考试理综化学部分(新课标全国I卷)2010年普通高等学校招生全国统一考试(课标Ⅰ卷)理综化学部分全解全析2010年普通高等学校招生全国统一考试(湖南卷)理综化学部分全解全析2010年高考化学试题分项专题七 化学反应中的能量变化(已下线)2012届贵州省遵义四中高三第一次月考理科综合试卷(化学部分)(已下线)2012届山东省济宁一中高三上学期第二次定时练习化学试卷(已下线)2011-2012学年吉林省长春市十一高中高一下学期期末考试化学试卷(已下线)2013-2014黑龙江省大庆铁人中学高一下学期期末考试化学试卷(已下线)2013-2014学年辽宁省抚顺市六校联合体高一下学期期末考试化学试卷(已下线)2015届安徽省黄山市徽州一中高三第一次月考化学试卷2016届河北省枣强中学高三上学期期中测试化学试卷高中化学人教版 选修四 第一章 化学反应与能量 第三节 化学反应热的计算 化学反应热的计算第二课时(反应热的计算)2020届高三化学选修4二轮专题练——盖斯定律的应用【选择精编25题】2020届高三化学知识点强化训练—盖斯定律黑龙江省八校2022届高三上学期期中联合考试化学试题安徽省安庆二中2022-2023学年高一下学期5月月考化学试题



