名校
解题方法
1 . I.直接将CO2转化为有机物并非植物的“专利”,科学家通过多种途径实现了CO2合成甲醛,总反应为CO2(g)+2H2(g) HCHO(g)+H2O(g) ∆H。转化步骤如图1所示:
HCHO(g)+H2O(g) ∆H。转化步骤如图1所示:
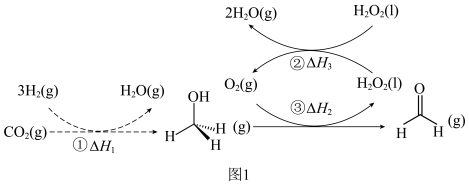
(1)已知2H2(g)+O2(g)=2H2O(g) ∆H4,则总反应的∆H=_______ (用图1中焓变以及∆H4表示)。
II.利用工业尾气(含硫氧化物与氮氧化物)制备Na2S2O4和NH4NO3,实现了“变废为宝”并保护了自然环境。如图是相关的工艺流程(Ce为铈元素,有Ce4+与Ce3+):
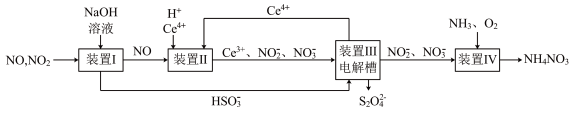
请回答下列问题:
(2)装置III中发生反应的离子方程式是:_______ 。
(3)日常生活中,常用硝酸铵和水,硝酸铵和水合碳酸钠作冷敷袋,试写出硝酸铵和水合碳酸钠(Na2CO3•10H2O)反应的化学方程式_______ (该反应中产生了两种气体)。
(4)已知,装置III中电解时,使用的电源为室温钠-硫电池,其结构如图所示。
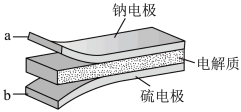
将钠箔置于聚苯并咪唑膜上作为一个电极,表面喷涂有硫黄粉末(S8)的炭化纤维素纸作为另一电极。工作时,在硫电极发生反应: S8+e-→
S8+e-→ S
S ,
, S
S +e-→S
+e-→S ,2Na++
,2Na++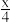 S
S +2(1-
+2(1-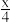 )e-→Na2Sx。该电池放电时正极反应式为
)e-→Na2Sx。该电池放电时正极反应式为_______ 。有人提出用常温下的液体甲醇一空气燃料电池(ZrO2作为固体电解质)替代钠-硫电池。当有0.5mol甲醇消耗时,负极消耗O2-为_______ mol;在O2不足时原电池会发生负极区固体电解质堵塞,导致堵塞的物质是_______ 。
 HCHO(g)+H2O(g) ∆H。转化步骤如图1所示:
HCHO(g)+H2O(g) ∆H。转化步骤如图1所示:
(1)已知2H2(g)+O2(g)=2H2O(g) ∆H4,则总反应的∆H=
II.利用工业尾气(含硫氧化物与氮氧化物)制备Na2S2O4和NH4NO3,实现了“变废为宝”并保护了自然环境。如图是相关的工艺流程(Ce为铈元素,有Ce4+与Ce3+):

请回答下列问题:
(2)装置III中发生反应的离子方程式是:
(3)日常生活中,常用硝酸铵和水,硝酸铵和水合碳酸钠作冷敷袋,试写出硝酸铵和水合碳酸钠(Na2CO3•10H2O)反应的化学方程式
(4)已知,装置III中电解时,使用的电源为室温钠-硫电池,其结构如图所示。

将钠箔置于聚苯并咪唑膜上作为一个电极,表面喷涂有硫黄粉末(S8)的炭化纤维素纸作为另一电极。工作时,在硫电极发生反应:
 S8+e-→
S8+e-→ S
S ,
, S
S +e-→S
+e-→S ,2Na++
,2Na++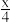 S
S +2(1-
+2(1-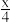 )e-→Na2Sx。该电池放电时正极反应式为
)e-→Na2Sx。该电池放电时正极反应式为
您最近一年使用:0次
名校
解题方法
2 . 氮氧化物对环境有着巨大的危害,一种利用尿素[CO(NH2)2]脱硝的反应原理为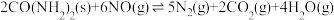 △H<0,回答下列问题:
△H<0,回答下列问题:
(1)T℃时,往2L的恒容密闭容器中加入5molCO(NH2)2(s)和3 mol NO(g),容器内混合气体总物质的量随时间的变化如图所示。
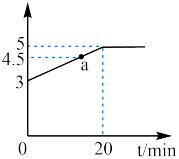
①20min末,容器内N2的物质的量为_______ mol;0~20min内,NO的平均反应速率为_______ mol·L-l·min-l。
②a点时v正_______ (填“>”、“<”或“=”)v逆,此时NO的转化率为_______ %;平衡时与初始时容器内的压强比为_______ 。
(2)向恒温恒容的密闭容器中,加入一定量的CO(NH2)2(s)和NO(g),能够说明该反应达到平衡的是_______(填标号)。
(3)汽车尾气中含有CO和NO等有害气体,三元催化转化器可将汽车尾气中的CO和NO转化为CO2和N2,每生成14gN2,反应放出373kJ热量,该反应的热化学方程式为_______ 。
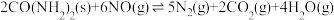 △H<0,回答下列问题:
△H<0,回答下列问题:(1)T℃时,往2L的恒容密闭容器中加入5molCO(NH2)2(s)和3 mol NO(g),容器内混合气体总物质的量随时间的变化如图所示。

①20min末,容器内N2的物质的量为
②a点时v正
(2)向恒温恒容的密闭容器中,加入一定量的CO(NH2)2(s)和NO(g),能够说明该反应达到平衡的是_______(填标号)。
| A.混合气体的密度不再改变 | B.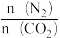 不再改变 不再改变 |
| C.混合气体中,H2O的物质的量分数不再改变 | D.3v正(NO)=v逆(CO2) |
您最近一年使用:0次
2023-08-31更新
|
138次组卷
|
5卷引用:福建省部分名校2023-2024学年高二上学期入学联考化学试题
名校
解题方法
3 . CO2与CH4的催化重整有利于减少空气中的CO2,实现碳中和。
已知:①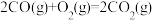 △H1=akJ·mol-1
△H1=akJ·mol-1
② △H2=bkJ·mol-1
△H2=bkJ·mol-1
③ △H3=ckJ·mol-1
△H3=ckJ·mol-1
则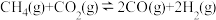 的△H4为
的△H4为
已知:①
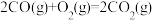 △H1=akJ·mol-1
△H1=akJ·mol-1②
 △H2=bkJ·mol-1
△H2=bkJ·mol-1③
 △H3=ckJ·mol-1
△H3=ckJ·mol-1则
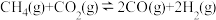 的△H4为
的△H4为| A.(-a-b+c)kJ·mol-1 | B.(a+b-c)kJ·mol-1 |
| C.(-a+b-c)kJ·mol-1 | D.(a-b-c)kJ·mol-1 |
您最近一年使用:0次
2023-08-31更新
|
258次组卷
|
3卷引用:福建省部分名校2023-2024学年高二上学期入学联考化学试题
4 . 下列事实得出的相应结论正确的是
| 选项 | 事实 | 结论 |
| A | 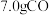 在足量 在足量 中完全燃烧放出70.8kJ的热量 中完全燃烧放出70.8kJ的热量 | 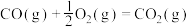 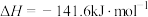 |
| B |   | 向密闭容器中通入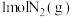 、 、 ,反应达到平衡时放出92.4kJ热量 ,反应达到平衡时放出92.4kJ热量 |
| C | 将铜片插入 溶液中,铜片逐渐变小,直至消失 溶液中,铜片逐渐变小,直至消失 | 以Cu、石墨棒为电极,以 溶液为电解质溶液可设计原电池 溶液为电解质溶液可设计原电池 |
| D | 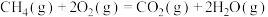    | 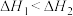 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-07-05更新
|
124次组卷
|
3卷引用:福建省泉州市永春第一中学2023-2024学年高二上学期开学考试化学试题
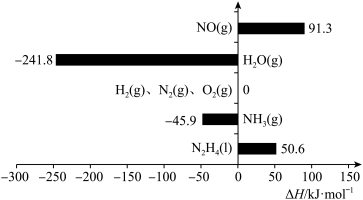
5 . 已知:在标准压强 、
、 下,由最稳定的单质合成1mol物质B的反应焓变,叫作物质B的标准摩尔生成焓,用
下,由最稳定的单质合成1mol物质B的反应焓变,叫作物质B的标准摩尔生成焓,用 表示。部分物质的
表示。部分物质的 说有如图所示关系。
说有如图所示关系。 的标准摩尔生成焓为0。下列有关判断不正确的是( )
的标准摩尔生成焓为0。下列有关判断不正确的是( )
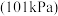 、
、 下,由最稳定的单质合成1mol物质B的反应焓变,叫作物质B的标准摩尔生成焓,用
下,由最稳定的单质合成1mol物质B的反应焓变,叫作物质B的标准摩尔生成焓,用 表示。部分物质的
表示。部分物质的 说有如图所示关系。
说有如图所示关系。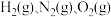 的标准摩尔生成焓为0。下列有关判断不正确的是( )
的标准摩尔生成焓为0。下列有关判断不正确的是( )
A.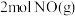 的能量大于 的能量大于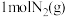 与 与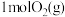 的能量之和 的能量之和 |
B.合成氨反应的热化学方程式为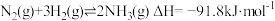 |
C. 催化氧化的热化学方程式为 催化氧化的热化学方程式为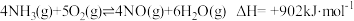 |
D.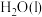 的 的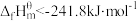 |
您最近一年使用:0次
2022-10-16更新
|
345次组卷
|
5卷引用:福建省泉州市永春第一中学2023-2024学年高二上学期开学考试化学试题
名校
解题方法
6 . 在湿法炼锌的电解循环液中,较高浓度的 会腐蚀阳极板而增大电解能耗。向电解循环液中同时加入Cu和
会腐蚀阳极板而增大电解能耗。向电解循环液中同时加入Cu和 ,可生成CuCl沉淀除去
,可生成CuCl沉淀除去 ,降低对电解的影响,反应原理如下:
,降低对电解的影响,反应原理如下:
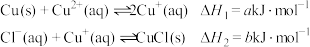
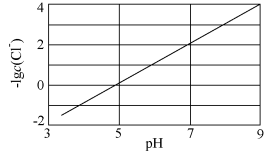
实验测得电解循环液pH对溶液中残留 的影响如图所示。下列说法正确的是
的影响如图所示。下列说法正确的是
 会腐蚀阳极板而增大电解能耗。向电解循环液中同时加入Cu和
会腐蚀阳极板而增大电解能耗。向电解循环液中同时加入Cu和 ,可生成CuCl沉淀除去
,可生成CuCl沉淀除去 ,降低对电解的影响,反应原理如下:
,降低对电解的影响,反应原理如下: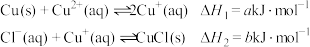
实验测得电解循环液pH对溶液中残留
 的影响如图所示。下列说法正确的是
的影响如图所示。下列说法正确的是
A.溶液pH增大, 增大 增大 |
B.反应达到平衡时,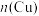 越多, 越多, 越小 越小 |
C.向电解液中加入稀硫酸,有利于 的去除 的去除 |
D.除 的反应为 的反应为 |
您最近一年使用:0次
2022-09-22更新
|
204次组卷
|
2卷引用:福建省莆田第二十四中学2021-2022学年高二下学期开学摸底考试化学(1卷)试题
7 . 纳米级Cu2O由于具有优良的催化性能而受关注,表中为制取Cu2O的两种方法:
(1)工业上常用方法b制取Cu2O而很少用方法a,其原因是反应条件不易控制,若控温不当易生成____ 而使Cu2O产率降低。
(2)已知:①2Cu(s)+ O2(g)=Cu2O(s) △H1=-169kJ·mol-1
O2(g)=Cu2O(s) △H1=-169kJ·mol-1
②C(s)+ O2(g)=CO(g) △H2=-110.5kJ·mol-1
O2(g)=CO(g) △H2=-110.5kJ·mol-1
③Cu(s)+ O2(g)=CuO(s) △H3=-157kJ·mol-1
O2(g)=CuO(s) △H3=-157kJ·mol-1
则方法a中发生的反应:2CuO(s)+C(s)=Cu2O(s)+CO(g) △H=____ 。
(3)方法b是用液态肼燃料电池为电源,通过离子交换膜电解法控制电解液中OH—的浓度来制备纳米Cu2O,装置如图所示:
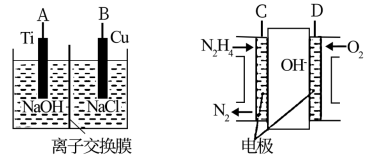
①上述装置中B电极应连____ (填“C”或“D”)电极。
②该离子交换膜为____ (填“阴”或“阳”)离子交换膜,该电解池的阴极反应式____ 。
③原电池中负极反应式为____ 。
| 方法a | 用炭粉在高温条件下还原CuO |
| 方法b | 电解法,反应为2Cu+H2O Cu2O+H2↑ Cu2O+H2↑ |
(1)工业上常用方法b制取Cu2O而很少用方法a,其原因是反应条件不易控制,若控温不当易生成
(2)已知:①2Cu(s)+
 O2(g)=Cu2O(s) △H1=-169kJ·mol-1
O2(g)=Cu2O(s) △H1=-169kJ·mol-1②C(s)+
 O2(g)=CO(g) △H2=-110.5kJ·mol-1
O2(g)=CO(g) △H2=-110.5kJ·mol-1③Cu(s)+
 O2(g)=CuO(s) △H3=-157kJ·mol-1
O2(g)=CuO(s) △H3=-157kJ·mol-1则方法a中发生的反应:2CuO(s)+C(s)=Cu2O(s)+CO(g) △H=
(3)方法b是用液态肼燃料电池为电源,通过离子交换膜电解法控制电解液中OH—的浓度来制备纳米Cu2O,装置如图所示:

①上述装置中B电极应连
②该离子交换膜为
③原电池中负极反应式为
您最近一年使用:0次
8 . I.发射卫星时可用肼( )为燃料,用二氧化氮为氧化剂,这两种物质反应生成氮气和水蒸气。已知:
)为燃料,用二氧化氮为氧化剂,这两种物质反应生成氮气和水蒸气。已知:

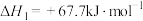

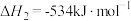

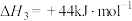
(1)写出肼与二氧化氮反应生成液态水的热化学方式_______ 。若该反应放出131.17kJ的热量时,电子转移的数目为:_______ 。
(2)上述反应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是_______ 。
II.电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(3)请用下图所示仪器装置设计一个包括:电解饱和食盐水并测定电解时产生的氢气的体积和检验氯气的氧化性的实验装置。
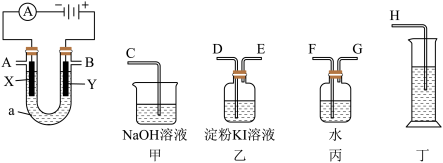
①所选仪器连接时,各接口的顺序是(填各接口的字母代号):_______ 。
A接______、_______接_______;B接_______、_______接_______;
体现氯气的氧化性的实验现象为:_______ ,甲中发生反应的离子方程式为_______ ,电解一段时间后,用丁测得气体体积为280mL(标准状况下);此时溶液的体积为500mL,则溶液中NaOH物质的量浓度是_______ ,需加入_______ g(结果保留一位小数)的_______ (填化学式)可使溶液复原。
②实验时,电极材料为铁电极与石墨电极,装置中的石墨电极为_______ 极(填X、Y),此电解反应的离子方程式为_______ 。
 )为燃料,用二氧化氮为氧化剂,这两种物质反应生成氮气和水蒸气。已知:
)为燃料,用二氧化氮为氧化剂,这两种物质反应生成氮气和水蒸气。已知:
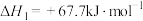

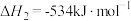

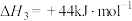
(1)写出肼与二氧化氮反应生成液态水的热化学方式
(2)上述反应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是
II.电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(3)请用下图所示仪器装置设计一个包括:电解饱和食盐水并测定电解时产生的氢气的体积和检验氯气的氧化性的实验装置。

①所选仪器连接时,各接口的顺序是(填各接口的字母代号):
A接______、_______接_______;B接_______、_______接_______;
体现氯气的氧化性的实验现象为:
②实验时,电极材料为铁电极与石墨电极,装置中的石墨电极为
您最近一年使用:0次
名校
解题方法
9 . 汽车内燃机工作时引起反应: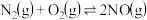 ,是导致汽车尾气中含有NO的原因之一、已知断裂某些共价键需要的能量如表:
,是导致汽车尾气中含有NO的原因之一、已知断裂某些共价键需要的能量如表:
(1)机动车发动机工作时会引发 和
和 的反应,该反应是
的反应,该反应是_______ (填“放热”或“吸热”)反应。
(2) 与
与 合成NO的热化学方程式可以表示为
合成NO的热化学方程式可以表示为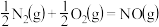
 ,则
,则
_______ 。
(3)NO与CO反应的热化学方程式可以表示为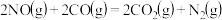
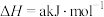 ,但该反应的速率很小,若使用机动车尾气催化转化器,尾气中的NO与CO可以转化成无害物质排封。上述反应在使用“催化转化器”后,a
,但该反应的速率很小,若使用机动车尾气催化转化器,尾气中的NO与CO可以转化成无害物质排封。上述反应在使用“催化转化器”后,a_______ (填“增大”“减小”或“不变”)。
(4)已知:①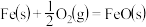
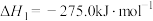 ;
;
②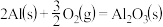
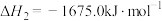 。
。
Al和FeO发生铝热反应的热化学方程式是_______ 。
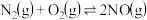 ,是导致汽车尾气中含有NO的原因之一、已知断裂某些共价键需要的能量如表:
,是导致汽车尾气中含有NO的原因之一、已知断裂某些共价键需要的能量如表:| 断裂的共价键 | O=O | N≡N | N-O |
| 需要的能量 | 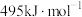 | 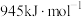 | 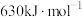 |
 和
和 的反应,该反应是
的反应,该反应是(2)
 与
与 合成NO的热化学方程式可以表示为
合成NO的热化学方程式可以表示为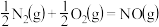
 ,则
,则
(3)NO与CO反应的热化学方程式可以表示为
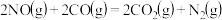
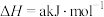 ,但该反应的速率很小,若使用机动车尾气催化转化器,尾气中的NO与CO可以转化成无害物质排封。上述反应在使用“催化转化器”后,a
,但该反应的速率很小,若使用机动车尾气催化转化器,尾气中的NO与CO可以转化成无害物质排封。上述反应在使用“催化转化器”后,a(4)已知:①
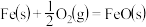
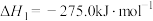 ;
;②
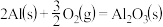
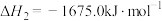 。
。Al和FeO发生铝热反应的热化学方程式是
您最近一年使用:0次
10 . 氮的氧化物在生产、生活中有广泛应用。
Ⅰ.已知汽车气缸中氮及其化合物发生如下反应:
 (常温下平衡常数为K1)
(常温下平衡常数为K1)
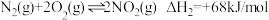 (常温下平衡常数为K2)
(常温下平衡常数为K2)
(1)则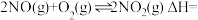
_______  ;常温下平衡常数K=
;常温下平衡常数K=_______ (用K1、K2来表示)
Ⅱ.四氧化二氮(N2O4)可作为运载火箭的推进剂,将4 mol N2O4放入2 L恒容密闭容器中发生反应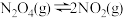 ,平衡体系中N2O4的体积分数(
,平衡体系中N2O4的体积分数( )随温度的变化如图所示:
)随温度的变化如图所示:
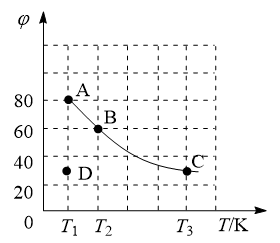
(2)D点v(正)_______ v(逆)(填“>”“=”或“<”)。
(3)A、B、C点中平衡常数K的值最大的是_______ 点。T2时,N2O4的平衡转化率为_______ ;若达平衡时间为5 s,则此时间内的N2O4平均反应速率为_______ 。
(4)若其条件不变,在 原平衡基础上,再加入一定量NO2,达到新平衡时,与原平衡相比,NO2的体积分数
原平衡基础上,再加入一定量NO2,达到新平衡时,与原平衡相比,NO2的体积分数_______ (填“增大”“不变”或“减小”)。
Ⅲ.碳的很多化合物在生产、生活中有广泛应用,对其进行综合利用是目前研究的热点之一。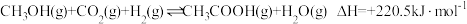 ;中科院化学所研究了该反应的反应历程,如图所示:
;中科院化学所研究了该反应的反应历程,如图所示:
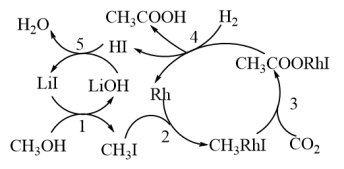
(5)反应历程中,能降低反应活化能的物质有_______ (填化学式);中间产物有_______ 种。
(6)第4步反应的化学方程式为_______ 。
Ⅰ.已知汽车气缸中氮及其化合物发生如下反应:
 (常温下平衡常数为K1)
(常温下平衡常数为K1)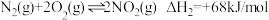 (常温下平衡常数为K2)
(常温下平衡常数为K2)(1)则
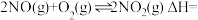
 ;常温下平衡常数K=
;常温下平衡常数K=Ⅱ.四氧化二氮(N2O4)可作为运载火箭的推进剂,将4 mol N2O4放入2 L恒容密闭容器中发生反应
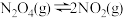 ,平衡体系中N2O4的体积分数(
,平衡体系中N2O4的体积分数( )随温度的变化如图所示:
)随温度的变化如图所示:
(2)D点v(正)
(3)A、B、C点中平衡常数K的值最大的是
(4)若其条件不变,在
 原平衡基础上,再加入一定量NO2,达到新平衡时,与原平衡相比,NO2的体积分数
原平衡基础上,再加入一定量NO2,达到新平衡时,与原平衡相比,NO2的体积分数Ⅲ.碳的很多化合物在生产、生活中有广泛应用,对其进行综合利用是目前研究的热点之一。
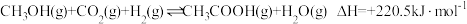 ;中科院化学所研究了该反应的反应历程,如图所示:
;中科院化学所研究了该反应的反应历程,如图所示:
(5)反应历程中,能降低反应活化能的物质有
(6)第4步反应的化学方程式为
您最近一年使用:0次
2022-01-15更新
|
188次组卷
|
4卷引用:福建省龙岩第一中学2021-2022学年高二下学期开学考化学试题
福建省龙岩第一中学2021-2022学年高二下学期开学考化学试题天津市和平区2021-2022学年高二上学期线上期末质量检测化学试题(已下线)专题03 化学反应的方向与化学反应的调控-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(天津专用)(已下线)专项02 化学反应速率与化学平衡-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(天津专用)



