1 . 化学链燃烧( )是利用载氧体将空气中的氧传输至燃料的新技术,与传统燃烧方式相比,避免了空气和燃料的直接接触,有利于高效捕集
)是利用载氧体将空气中的氧传输至燃料的新技术,与传统燃烧方式相比,避免了空气和燃料的直接接触,有利于高效捕集 。基于
。基于 载氧体的甲烷化学链燃烧技术示意图如下。
载氧体的甲烷化学链燃烧技术示意图如下。
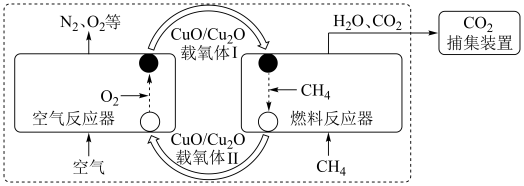
空气反应器与燃料反应器中发生的反应分别为:
①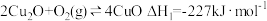
②
(1)反应

_______  。
。
(2)反应②的平衡常数表达式
_______ 。
(3)氧的质量分数:载氧体Ⅰ_______ (填“>”“=”或“<”)载氧体Ⅱ。
(4)往盛有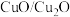 载氧体的刚性密闭容器中充入空气【氧气的物质的量分数
载氧体的刚性密闭容器中充入空气【氧气的物质的量分数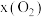 为21%】,发生反应①。平衡时
为21%】,发生反应①。平衡时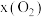 随反应温度T变化的曲线如图所示。
随反应温度T变化的曲线如图所示。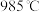 时
时 的平衡转化率
的平衡转化率
_______ (保留2位有效数字)。
(5)根据下图,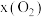 随温度升高而增大的原因是
随温度升高而增大的原因是_______ 。反应温度必须控制在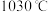 以下,原因是
以下,原因是_______ 。

(6)载氧体掺杂改性,可加快化学链燃烧速率。使用不同掺杂的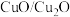 载氧体,反应②活化能如下表所示。
载氧体,反应②活化能如下表所示。
由表中数据判断:使用_______ (填“氧化铝”或“膨润土”)掺杂的载氧体反应较快;使用氧化铝或者膨润土掺杂的载氧体,单位时间内燃料反应器释放的热量分别为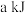 、
、 ,则a
,则a_______ b(填“>”“=”或“<”)。
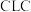 )是利用载氧体将空气中的氧传输至燃料的新技术,与传统燃烧方式相比,避免了空气和燃料的直接接触,有利于高效捕集
)是利用载氧体将空气中的氧传输至燃料的新技术,与传统燃烧方式相比,避免了空气和燃料的直接接触,有利于高效捕集 。基于
。基于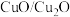 载氧体的甲烷化学链燃烧技术示意图如下。
载氧体的甲烷化学链燃烧技术示意图如下。
空气反应器与燃料反应器中发生的反应分别为:
①
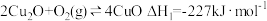
②

(1)反应


 。
。(2)反应②的平衡常数表达式

(3)氧的质量分数:载氧体Ⅰ
(4)往盛有
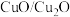 载氧体的刚性密闭容器中充入空气【氧气的物质的量分数
载氧体的刚性密闭容器中充入空气【氧气的物质的量分数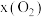 为21%】,发生反应①。平衡时
为21%】,发生反应①。平衡时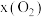 随反应温度T变化的曲线如图所示。
随反应温度T变化的曲线如图所示。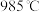 时
时 的平衡转化率
的平衡转化率
(5)根据下图,
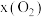 随温度升高而增大的原因是
随温度升高而增大的原因是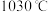 以下,原因是
以下,原因是
(6)载氧体掺杂改性,可加快化学链燃烧速率。使用不同掺杂的
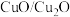 载氧体,反应②活化能如下表所示。
载氧体,反应②活化能如下表所示。| 载氧体掺杂物质 | 氧化铝 | 膨润土 |
活化能/ |  | 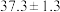 |
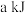 、
、 ,则a
,则a
您最近一年使用:0次
2021-11-09更新
|
5660次组卷
|
7卷引用:福建省龙岩第一中学2021-2022学年高二下学期开学考试(实验班)化学试题
福建省龙岩第一中学2021-2022学年高二下学期开学考试(实验班)化学试题福建省福州市福建师范大学附属中学2022-2023学年高二下学期期末化学试题2021年新高考福建化学高考真题北京市铁路第二中学2022-2023学年高二上学期期中检测化学试题(已下线)专题15 化学反应原理综合题-三年(2020-2022)高考真题分项汇编(已下线)专题17 原理综合题(已下线)专题17 原理综合题
2 . Ⅰ.用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
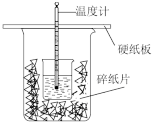
(1)从实验装置上看,图中尚缺少的一种玻璃用品是___________ ;由图可知此装置除了两烧杯没有填满碎泡沫塑料外,还有何不妥之处,应如何改正?___________ ;
(2)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会___________ (填“偏大”、“偏小”、“无影响”)。
Ⅱ.回答下列问题
(3)已知:①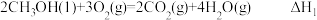 ,
,
②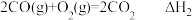 ,
,
③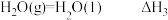 。
。
则反应 的
的 =
=___________ (用含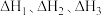 的式子表示)。
的式子表示)。
(4)某些化学键的键能如表所示:
试回答下列问题:
已知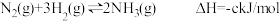 ,则N-H键的键能是
,则N-H键的键能是___________ kJ/mol (用含有a、b、c的式子表示)。
(5)1molNO2气体和1molCO气体反应生成CO2气体和NO气体过程中的能量变化如图所示,请写出NO2与CO反应的热化学方程式:___________ 。

(6)家用液化气的主要成分之一是丁烷(C4H10)。常温常压条件下,1g丁烷气体完全氧化生成CO2气体和液态水时放出热量50kJ,则表示丁烷燃烧热 的热化学方程式为___________ 。

(1)从实验装置上看,图中尚缺少的一种玻璃用品是
(2)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会
Ⅱ.回答下列问题
(3)已知:①
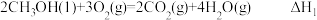 ,
,②
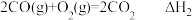 ,
,③
 。
。则反应
 的
的 =
= 的式子表示)。
的式子表示)。(4)某些化学键的键能如表所示:
| 化学键 | H-H |  |
| 键能/(kJ/mol) | a | b |
已知
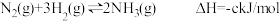 ,则N-H键的键能是
,则N-H键的键能是(5)1molNO2气体和1molCO气体反应生成CO2气体和NO气体过程中的能量变化如图所示,请写出NO2与CO反应的热化学方程式:

(6)家用液化气的主要成分之一是丁烷(C4H10)。常温常压条件下,1g丁烷气体完全氧化生成CO2气体和液态水时放出热量50kJ,则表示丁烷
您最近一年使用:0次
名校
3 . I.(1)发射卫星时可用肼(N2H4)为燃料,用二氧化氮为氧化剂,这两种物质反应生成氮气和水蒸气。已知:
N2(g)+2O2(g)=2NO2(g) △H1= +67.7 kJ•mol-1
N2H4(g) +O2(g)=N2(g)+2H2O(g) △H2=-534 kJ•mol-1
H2O(l)= H2O(g) △H3=+44 kJ•mol-1
(1)写出肼与二氧化氮反应生成液态水的热化学方式___________ 。
(2)上述反应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是___________ 。
II. 电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(3)请用下图方框内所示仪器装置设计一个包括:电解饱和食盐水并测定电解时产生的氢气的体积和检验氯气的氧化性的实验装置。
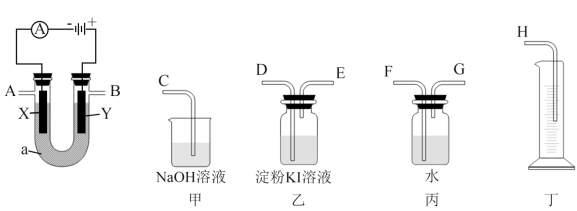
①所选仪器连接时,各接口的顺序是(填各接口的字母代号):
A接___________ 、___________ 接___________ ;B接___________ 、___________ 接___________ ;体现氯气的氧化性的实验现象为:___________ 甲中发生反应的离子方程式为___________
②实验时,电极材料为铁电极与石墨电极,装置中的石墨电极为___________ 极(填X、Y),此电解反应的离子方程式为___________ 。
③要使电解后溶液恢复到电解前的状态,则需加入(或通入)___________ 。
N2(g)+2O2(g)=2NO2(g) △H1= +67.7 kJ•mol-1
N2H4(g) +O2(g)=N2(g)+2H2O(g) △H2=-534 kJ•mol-1
H2O(l)= H2O(g) △H3=+44 kJ•mol-1
(1)写出肼与二氧化氮反应生成液态水的热化学方式
(2)上述反应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是
II. 电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(3)请用下图方框内所示仪器装置设计一个包括:电解饱和食盐水并测定电解时产生的氢气的体积和检验氯气的氧化性的实验装置。

①所选仪器连接时,各接口的顺序是(填各接口的字母代号):
A接
②实验时,电极材料为铁电极与石墨电极,装置中的石墨电极为
③要使电解后溶液恢复到电解前的状态,则需加入(或通入)
您最近一年使用:0次
名校
解题方法
4 . 化学在能源开发与利用中起着十分关键的作用。
(1)下列制氢气方法中最节能的是___________(填序号)。
(2)蕴藏在海底的“可燃冰”是高压下形成的外观像冰的甲烷水合物固体。甲烷气体氧化和水汽化的热化学方程式分别为:
①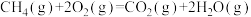
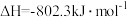
②
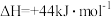
则3.2kg“可燃冰”(分子式为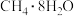 )释放的甲烷气体完全氧化生成二氧化碳气体和液态水时放出的热量为
)释放的甲烷气体完全氧化生成二氧化碳气体和液态水时放出的热量为___________ 。
(3)家用液化气的主要成分之一是丁烷(C4H10)。常温常压条件下,1g丁烷完全燃烧生成CO2气体和液态水时放出热量50kJ,则表示丁烷摩尔燃烧焓的热化学方程式为___________ 。(摩尔燃烧焓指在一定反应温度和压强下,1mol纯物质完全氧化为同温下的指定产物时的焓变)
(4)0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中氧化生成固态三氧化二硼和液态水时放出649.5kJ热量,其热化学方程式为___________ 。
(5)标准摩尔生成焓是指在25℃和101kPa时,最稳定的单质生成1mol化合物的焓变。已知25℃和101kPa时下列反应:
①

②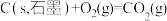

③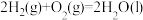

写出乙烷标准摩尔生成焓的焓变 =
=___________ (用含 、
、 、
、 的式子表示)。
的式子表示)。
(1)下列制氢气方法中最节能的是___________(填序号)。
A.电解水制氢气: |
B.高温使水分解制氢气: |
C.太阳光催化分解水制氢气: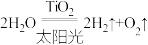 |
D.天然气制氢气: |
①
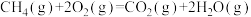
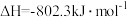
②

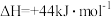
则3.2kg“可燃冰”(分子式为
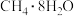 )释放的甲烷气体完全氧化生成二氧化碳气体和液态水时放出的热量为
)释放的甲烷气体完全氧化生成二氧化碳气体和液态水时放出的热量为(3)家用液化气的主要成分之一是丁烷(C4H10)。常温常压条件下,1g丁烷完全燃烧生成CO2气体和液态水时放出热量50kJ,则表示丁烷摩尔燃烧焓的热化学方程式为
(4)0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中氧化生成固态三氧化二硼和液态水时放出649.5kJ热量,其热化学方程式为
(5)标准摩尔生成焓是指在25℃和101kPa时,最稳定的单质生成1mol化合物的焓变。已知25℃和101kPa时下列反应:
①


②
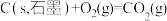

③

写出乙烷标准摩尔生成焓的焓变
 =
= 、
、 、
、 的式子表示)。
的式子表示)。
您最近一年使用:0次
名校
解题方法
5 . 根据如下能量关系示意图,下列说法正确的是
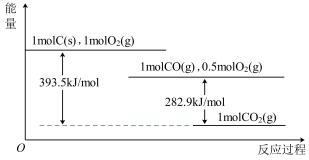

| A.1 mol C(s)与1 mol O2(g)的能量之和为393.5 kJ |
| B.由C→CO的热化学方程式为:2C(s)+O2(g) = 2CO(g) ΔH= −221.2 kJ∙mol−1 |
| C.反应2CO(g)+O2(g) =2CO2(g)中,生成物的总能量大于反应物的总能量 |
| D.将1 mol C(s)磨成粉末后,反应更加剧烈,说明粉碎可以改变ΔH |
您最近一年使用:0次
2020-06-28更新
|
173次组卷
|
3卷引用:福建省龙岩第一中学2021-2022学年高二上学期开学考试化学试题
6 . 发展新能源、改善空气质量等一直是化学研究的热点。回答下列问题:
(1)甲醇是可再生的清洁能源,可利用CO2与H2合成甲醇:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)。该反应历程如图所示。

上述合成甲醇的反应的有机副产物有__________ ;由于该反应速率较慢,需要加入催化剂使反应速率加快,主要降低下列变化中________ (填字母)的能量变化。
A.*CO+*OH→*CO+*H2O B.*CO→*OCH
C.*OCH2→*OCH3 D.*OCH3→*CH3OH
(2)焦炭与水蒸气在恒容密闭容器中反应,可制合成气,主要反应(I)、(II)的lg KP(KP为以分压表示的平衡常数)与T的关系如图所示。
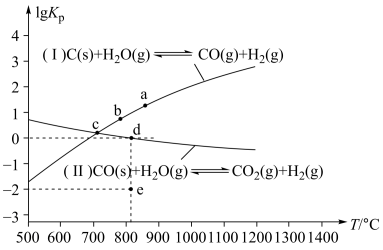
①反应(I)的△H______ 0(填“>”、“=”或“<”);
②在容积为10 L密闭容器中充入1 mol CO、1 mol H2O只发生反应(II),反应5分钟到达图中d点,请计算0~5 min时,CO平均反应速率________ ;此时CO的转化率为________ ;已知:反应速率v=v正-v逆=k正·x(CO)·x(H2O)-k逆·x(CO2)·x(H2),k正、k逆分别为正、逆反应速率常数,x为物质的量分数,计算e处的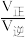 =
=______ ;
③c点时,若反应容器中CO浓度为0.1 mol/L,则CO2浓度为________ (填数值)。
(1)甲醇是可再生的清洁能源,可利用CO2与H2合成甲醇:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)。该反应历程如图所示。

上述合成甲醇的反应的有机副产物有
A.*CO+*OH→*CO+*H2O B.*CO→*OCH
C.*OCH2→*OCH3 D.*OCH3→*CH3OH
(2)焦炭与水蒸气在恒容密闭容器中反应,可制合成气,主要反应(I)、(II)的lg KP(KP为以分压表示的平衡常数)与T的关系如图所示。

①反应(I)的△H
②在容积为10 L密闭容器中充入1 mol CO、1 mol H2O只发生反应(II),反应5分钟到达图中d点,请计算0~5 min时,CO平均反应速率
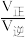 =
=③c点时,若反应容器中CO浓度为0.1 mol/L,则CO2浓度为
您最近一年使用:0次
2020-06-19更新
|
299次组卷
|
3卷引用:福建省莆田第二十四中学2021-2022学年高二下学期开学摸底考试化学(2卷)试题
名校
解题方法
7 . 氯原子对O3的分解有催化作用:
O3+Cl=ClO+O2 ΔH1
ClO+O=Cl+O2 ΔH2
该反应的能量变化如图所示,下列叙述中正确的是( )
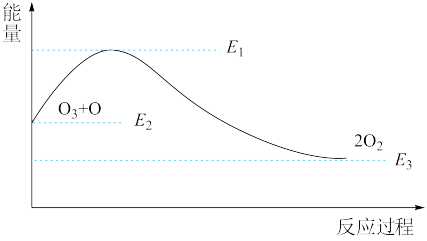
O3+Cl=ClO+O2 ΔH1
ClO+O=Cl+O2 ΔH2
该反应的能量变化如图所示,下列叙述中正确的是( )

| A.反应O3+O=2O2的ΔH=E1-E2 |
| B.反应O3+O=2O2的ΔH=E2-E3 |
| C.反应O3+O=2O2是吸热反应 |
| D.反应O3+O=2O2的ΔH=ΔH1+ΔH2 |
您最近一年使用:0次
2020-06-15更新
|
207次组卷
|
3卷引用:福建省德化县第一中学2022-2023学年高二上学期开学检测化学试题
福建省德化县第一中学2022-2023学年高二上学期开学检测化学试题安徽省潜山第二中学2019-2020学年高二下学期开学考试化学试题(已下线)1.3.1 盖斯定律(重点练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)
8 . 室温下,CuSO4·5H2O(s)、CuSO4(s)与其水溶液之间转化的焓变关系如图:
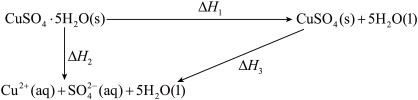
已知CuSO4·5H2O(s)溶于水,溶液温度降低;CuSO4(s)溶于水,溶液温度升高。
下列有关说法不正确的是

已知CuSO4·5H2O(s)溶于水,溶液温度降低;CuSO4(s)溶于水,溶液温度升高。
下列有关说法不正确的是
| A.△H2=△H1+△H3 |
| B.1mol CuSO4(s)的总能量大于1mol Cu2+(aq)与1mol SO42-(aq)的总能量 |
| C.△H2<△H1 |
| D.从硫酸铜溶液中析出CuSO4·5H2O(s)的反应焓变△H>0 |
您最近一年使用:0次
2019-12-25更新
|
100次组卷
|
2卷引用:福建省莆田第二十四中学2021-2022学年高二下学期开学摸底考试化学(2卷)试题
名校
9 . 肼(N2H4)在不同条件下分解产物不同,200℃时在Cu表面分解的机理如图。已知200℃时:反应Ⅰ:3N2H4(g)=N2(g)+4NH3(g) ΔH1=−32.9 kJ·mol−1;反应Ⅱ:N2H4(g)+H2(g)=2NH3(g) ΔH2=−41.8kJ·mol−1

下列说法不正确的是

下列说法不正确的是
| A.图所示过程①是放热反应 |
| B.反应Ⅱ的能量过程示意图如图所示 |
| C.断开3 molN2H4(g)的化学键吸收的能量大于形成1molN2(g)和4molNH3(g)的化学键释放的能量 |
| D.200℃时,肼分解生成氮气和氢气的热化学方程式为N2H4(g)=N2(g)+2H2(g) ΔH=+50.7 kJ·mol−1 |
您最近一年使用:0次
2019-04-13更新
|
2236次组卷
|
13卷引用:福建省宁化第一中学2021-2022学年高二上学期开学考试化学试题
福建省宁化第一中学2021-2022学年高二上学期开学考试化学试题福建省三明市第二中学2022-2023学年高二上学期开学适应性练习化学试题四川省成都外国语学校2019-2020学年高二上学期期中考试化学试题山东省临沂市罗庄区2019-2020学年高二上学期期末考试化学试题(已下线)第01章 化学反应与能量(A卷基础篇)——2020-2021学年高二化学选修四同步单元AB卷(人教版)人教版(2019)高二化学选择性必修1第一章 化学反应的热效应 过综合 章末素养综合检测湖南省宁乡市四校联考2022-2023学年高二上学期10月月考化学试题湖南省南雅中学2023-2024学年高二上学期第一次月考化学试题广西南宁沛鸿民族中学2023-2024学年高二上学期10月月考化学试题【全国百强校】浙江省杭州市第二中学2019届高三第二学期选考模拟卷化学试题(已下线)专题07 化学反应中的能量变化——2019年高考真题和模拟题化学分项汇编(已下线)专题6.1 化学能与热能(练)——2020年高考化学一轮复习讲练测吉林省长春汽车经济技术开发区第六中学2019-2020学年高一下学期期末考试化学试题
名校
10 . 下列有关《化学反应原理》的内容说法不正确 的是
| A.应用盖斯定律,可计算某些难以直接测量的反应的焓变 |
| B.向FeCl3与CuCl2溶液中加入碱式碳酸铜调节pH可以除去溶液中的FeCl3 |
| C.使用催化剂,可以增大活化分子百分数,加快反应速率 |
| D.为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可。 |
您最近一年使用:0次



