1 .  催化重整对温室气体的减排具有重要意义,其反应为:
催化重整对温室气体的减排具有重要意义,其反应为: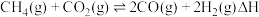 。回答下列问题:
。回答下列问题:
(1)已知相关物质的燃烧热(
 ):
):
则 催化重整反应的
催化重整反应的
_______  。
。
(2)将原料按初始组成
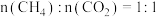 充入密闭容器中,保持体系压强为
充入密闭容器中,保持体系压强为
 发生反应。达到平衡时,
发生反应。达到平衡时,
 体积分数与温度的关系如图所示。
体积分数与温度的关系如图所示。
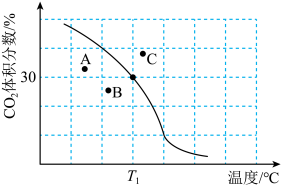
①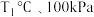 下,n(平衡时气体):n(初始气体)=
下,n(平衡时气体):n(初始气体)=_______ 。该温度下,此反应的平衡常数
_______ 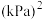 (以分压表示,分压=总压强×气体成分的物质的量分数。保留1位小数)。
(以分压表示,分压=总压强×气体成分的物质的量分数。保留1位小数)。
②若A、B、C三点表示不同温度和压强下达到平衡时 的体积分数,则
的体积分数,则_______ 点对应的平衡常数最小,理由是_______ 。
(3)其他条件相同,在不同催化剂(A、B)作用下,反应
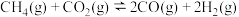 进行相同时间后,
进行相同时间后,
 的产率随反应温度的变化如图所示。
的产率随反应温度的变化如图所示。

①在催化剂A、B作用下,它们正、逆反应活化能差值分别用 表示,则
表示,则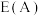
_______ 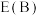 (填“>”“<”或“=”,下同)。
(填“>”“<”或“=”,下同)。
②y点对应的
_______ z点对应的 。
。
(4) 和
和
 都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:
都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:
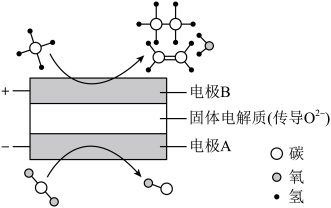
①阴极的电极反应式为_______ 。
②若生成的乙烯和乙烷的体积比为 ,则消耗的
,则消耗的 和
和 的体积比为
的体积比为_______ 。
 催化重整对温室气体的减排具有重要意义,其反应为:
催化重整对温室气体的减排具有重要意义,其反应为: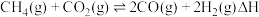 。回答下列问题:
。回答下列问题:(1)已知相关物质的燃烧热(
 ):
):| 物质 | 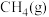 | 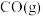 |  |
燃烧热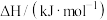 |  |  |  |
 催化重整反应的
催化重整反应的
 。
。(2)将原料按初始组成
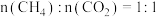 充入密闭容器中,保持体系压强为
充入密闭容器中,保持体系压强为 发生反应。达到平衡时,
发生反应。达到平衡时, 体积分数与温度的关系如图所示。
体积分数与温度的关系如图所示。
①
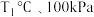 下,n(平衡时气体):n(初始气体)=
下,n(平衡时气体):n(初始气体)=
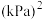 (以分压表示,分压=总压强×气体成分的物质的量分数。保留1位小数)。
(以分压表示,分压=总压强×气体成分的物质的量分数。保留1位小数)。②若A、B、C三点表示不同温度和压强下达到平衡时
 的体积分数,则
的体积分数,则(3)其他条件相同,在不同催化剂(A、B)作用下,反应
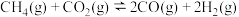 进行相同时间后,
进行相同时间后, 的产率随反应温度的变化如图所示。
的产率随反应温度的变化如图所示。
①在催化剂A、B作用下,它们正、逆反应活化能差值分别用
 表示,则
表示,则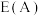
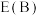 (填“>”“<”或“=”,下同)。
(填“>”“<”或“=”,下同)。②y点对应的

 。
。(4)
 和
和 都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:
都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:
①阴极的电极反应式为
②若生成的乙烯和乙烷的体积比为
 ,则消耗的
,则消耗的 和
和 的体积比为
的体积比为
您最近一年使用:0次
2023-10-29更新
|
663次组卷
|
4卷引用:广西北海市2024届高三一模考试化学试题
2 . 在催化剂作用下H2(g)可将烟气中的SO2(g)还原成S(s)。回答下列问题:
(1)已知:
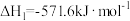

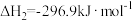
则H2(g)还原烟气中的SO2(g)的热化学方程式为___________ 。
(2)在容积为10L的容器中充入1mol SO2(g)与2mol H2(g)的混合气体,发生反应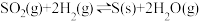
 。
。
①恒容时,反应经过4s后达到平衡,此时测得H2O(g)的物质的量为1.2mol。则0~4s内,v(H2)=___________ mol/(L·s),平衡时,c(SO2)=___________ mol/L;若平衡后升高温度,SO2的转化率将___________ (填“增 大”“减小”或“不变”)。
②恒温时,压强p与SO2的平衡转化率α如图所示,该温度下,该反应的平衡常数K=___________ L/mol;平衡状态由A变到B,平衡常数K(A) ___________ (填“>”“<”或“=”)K(B)。
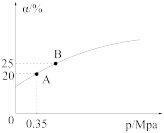
③若在恒温恒容密闭容器中发生上述反应,下列可作为该反应达到平衡状态的标志是___________ (填标号)。
A.压强不再变化
B.密度不再变化
C.气体的平均相对分子质量不再变化
D.SO2的消耗速率与H2的消耗速率之比为1∶2
(1)已知:

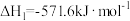

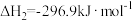
则H2(g)还原烟气中的SO2(g)的热化学方程式为
(2)在容积为10L的容器中充入1mol SO2(g)与2mol H2(g)的混合气体,发生反应
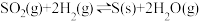
 。
。①恒容时,反应经过4s后达到平衡,此时测得H2O(g)的物质的量为1.2mol。则0~4s内,v(H2)=
②恒温时,压强p与SO2的平衡转化率α如图所示,该温度下,该反应的平衡常数K=

③若在恒温恒容密闭容器中发生上述反应,下列可作为该反应达到平衡状态的标志是
A.压强不再变化
B.密度不再变化
C.气体的平均相对分子质量不再变化
D.SO2的消耗速率与H2的消耗速率之比为1∶2
您最近一年使用:0次
2021-11-02更新
|
551次组卷
|
4卷引用:广西北海市2021-2022学年高三上学期第一次化学模拟考试理综化学试题
3 . 磷石膏是湿法生产磷酸的固体废弃物,用磷石膏生产硫酸或硫,既可减少对环境的污染又可使资源循环利用。回答下列问题:
(1)用焦炭、硫磺等均可还原磷石膏。已知下列反应:
I.CaSO4(s)+2C(s)=CaS(s)+2CO2(g) △H1=+226 kJ∙mol−1
II.3CaSO4(s)+CaS(s)=4CaO(s)+4SO2(g) △H2=a kJ∙mol−1
III.3CaS(s)+CaSO4(s)=4CaO(s)+4S(s) △H3=b kJ∙mol−1
①反应(I)能在___________ (填“低温”“高温”或“任何温度”)下自发进行。
②用硫磺还原CaSO4反应为2CaSO4(s)+S(s)=2CaO(s)+3SO2(g),其△H=___________ kJ·mol-1(用含a、b的代数式表示)。
(2)磷石膏转氨法制硫酸的主要反应为CaSO4(s)+(NH4)2CO3 CaCO3(s)+(NH4)2SO4,该反应的平衡常数K=
CaCO3(s)+(NH4)2SO4,该反应的平衡常数K=___________ [已知:Ksp(CaCO3)=2.5×10−9,Ksp(CaSO4)=3.2×10−7]。
(3)一氧化碳还原CaSO4可发生下列反应,其lg Kp与温度(T)的关系如图所示(Kp为以分压表示的平衡常数)。
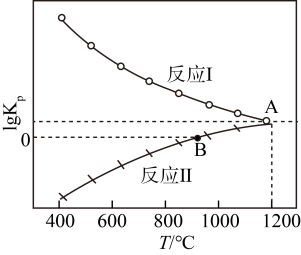
I.SO2(g)+3CO(g) 2CO2(g)+COS(g)
2CO2(g)+COS(g)
II.CaSO4(s)+CO(g) CaO(s)+CO2(g)+SO2(g)
CaO(s)+CO2(g)+SO2(g)
①△H>0的反应是___________ (填“I”或“II”)。
②在交点A处,气体分压间满足的关系是:p(COS)=___________ 。
③在恒温恒容密闭容器中进行反应(I),能说明已达到平衡状态的是___________ (填字母)。
a.2v(CO)正=3v(CO2)正 b.气体的密度不再随时间变化
c.气体的压强不再随时间变化 d. 的值不再随时间而变化
的值不再随时间而变化
④若在1.0 L的恒容密闭容器中加入1 mol CaSO4,并充入1 mol CO,只发生反应II,在B点时气体总压强为1 MPa,则此时CaSO4转化率为___________ (已知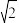 ≈1.41)。
≈1.41)。
(1)用焦炭、硫磺等均可还原磷石膏。已知下列反应:
I.CaSO4(s)+2C(s)=CaS(s)+2CO2(g) △H1=+226 kJ∙mol−1
II.3CaSO4(s)+CaS(s)=4CaO(s)+4SO2(g) △H2=a kJ∙mol−1
III.3CaS(s)+CaSO4(s)=4CaO(s)+4S(s) △H3=b kJ∙mol−1
①反应(I)能在
②用硫磺还原CaSO4反应为2CaSO4(s)+S(s)=2CaO(s)+3SO2(g),其△H=
(2)磷石膏转氨法制硫酸的主要反应为CaSO4(s)+(NH4)2CO3
 CaCO3(s)+(NH4)2SO4,该反应的平衡常数K=
CaCO3(s)+(NH4)2SO4,该反应的平衡常数K=(3)一氧化碳还原CaSO4可发生下列反应,其lg Kp与温度(T)的关系如图所示(Kp为以分压表示的平衡常数)。

I.SO2(g)+3CO(g)
 2CO2(g)+COS(g)
2CO2(g)+COS(g)II.CaSO4(s)+CO(g)
 CaO(s)+CO2(g)+SO2(g)
CaO(s)+CO2(g)+SO2(g)①△H>0的反应是
②在交点A处,气体分压间满足的关系是:p(COS)=
③在恒温恒容密闭容器中进行反应(I),能说明已达到平衡状态的是
a.2v(CO)正=3v(CO2)正 b.气体的密度不再随时间变化
c.气体的压强不再随时间变化 d.
 的值不再随时间而变化
的值不再随时间而变化④若在1.0 L的恒容密闭容器中加入1 mol CaSO4,并充入1 mol CO,只发生反应II,在B点时气体总压强为1 MPa,则此时CaSO4转化率为
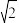 ≈1.41)。
≈1.41)。
您最近一年使用:0次
2020-12-15更新
|
654次组卷
|
2卷引用:广西北海市2021届高三第一次模拟考试化学试题
解题方法
4 . H2S广泛存在于许多燃气和工业废气中,脱除其中的H2S既可回收硫又可防止产生污染。回答下列问题:
(1)Tretford氧化法脱H2S,包括H2S的吸收、氧化析硫、焦钒酸钠的氧化等。
①焦钒酸钠的化学式为Na2V4O9,其中钒元素的化合价为_______ ;
②已知H2S、H2CO3的电离常数如下表所示:
纯碱溶液吸收H2S的离子方程式为______________ 。
(2)Claus氧化回收硫的反应原理为:2H2S(g)+O2(g)=2S(g)+2H2O(g) △H1
2H2S(g)+3O2(g)=2SO2(g)+2H2O(g) △H2=-1124 kJ/mol
2H2S(g) +SO2(g)=S(g) +2H2O(g) △H3=- 233 kJ/mol
则△H1=_______ kJ/mol。
(3)H2S分解反应2H2S(g) 2H2(g)+S2(g)在无催化剂及Al2O3催化下,H2S在反应器中不同温度时反应,每间隔相同时间测定一次H2S的转化率,其转化率与温度的关系如图所示:
2H2(g)+S2(g)在无催化剂及Al2O3催化下,H2S在反应器中不同温度时反应,每间隔相同时间测定一次H2S的转化率,其转化率与温度的关系如图所示:

①该反应的△H_______ (填“>”或“<”)0。
②在不加催化剂时,温度越高H2S的转化率越接近平衡时的转化率,原因是___________ ;在约1100 °C时,有无Al2O3催化,其转化率几乎相等,是因为___________ 。
③若起始时在恒容密闭容器中只充入H2S,在A点达到平衡时,若此时气体总压强为p,则此温度反应的平衡常数Kp=______ (Kp为以分压表示的平衡常数,气体分压=气体总压×体积分数,列出含p的代数式)。
(1)Tretford氧化法脱H2S,包括H2S的吸收、氧化析硫、焦钒酸钠的氧化等。
①焦钒酸钠的化学式为Na2V4O9,其中钒元素的化合价为
②已知H2S、H2CO3的电离常数如下表所示:
| Ka1 | Ka2 | |
| H2S | 9.1×10-8 | 1.1×10-12 |
| H2CO3 | 4.3×10-7 | 5.61×10-11 |
纯碱溶液吸收H2S的离子方程式为
(2)Claus氧化回收硫的反应原理为:2H2S(g)+O2(g)=2S(g)+2H2O(g) △H1
2H2S(g)+3O2(g)=2SO2(g)+2H2O(g) △H2=-1124 kJ/mol
2H2S(g) +SO2(g)=S(g) +2H2O(g) △H3=- 233 kJ/mol
则△H1=
(3)H2S分解反应2H2S(g)
 2H2(g)+S2(g)在无催化剂及Al2O3催化下,H2S在反应器中不同温度时反应,每间隔相同时间测定一次H2S的转化率,其转化率与温度的关系如图所示:
2H2(g)+S2(g)在无催化剂及Al2O3催化下,H2S在反应器中不同温度时反应,每间隔相同时间测定一次H2S的转化率,其转化率与温度的关系如图所示:
①该反应的△H
②在不加催化剂时,温度越高H2S的转化率越接近平衡时的转化率,原因是
③若起始时在恒容密闭容器中只充入H2S,在A点达到平衡时,若此时气体总压强为p,则此温度反应的平衡常数Kp=
您最近一年使用:0次
解题方法
5 . 钼(Mo)是一种难熔稀有金属,我国的钼储量居世界第二。钼及其合金在冶金,农业、电器、化工、环保等方面有着广泛的应用。
(1)Mo可被发烟硝酸氧化,产物MoOF4 和MoO2F2物质的量比为1:1,完成下列方程式:
____Mo+____HF+_____HNO3=_______MoO2F2+_______MoOF4+NO2↑+_____________,___________
(2) 已知:
①2Mo(s)+3O2(g)=2MoO3(s) ΔH1
②MoS2(s) +2O2(g)==Mo(s)+2SO2(g) ΔH2
③2MoS2(s)+7O2(g)==2MoO3(s)+4SO2(g) ΔH3
则ΔH3=_______ (用含ΔH1、ΔH2的代数式表示),在反应③中若有0.2molMoS2参加反应,则转移电子_____ mol。
(3)密闭容器中用Na2CO3(s)作固硫剂,同时用一定量的氢气还原钼矿(MoS2) 原理是:MoS2(s)+4H2(g)+2Na2CO3(s)==Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) ΔH
实验测得平衡时的有关变化曲线如图所示
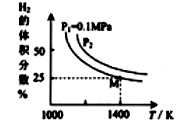
①由图可知,该反应的ΔH____ 0 (填“>”或“<”)。
②如果上述反应在体积不变的密闭容器中达平衡,下列说法错误的是_____ (选填编号)。
A.V正(H2)=V逆(H2O)
B 再加入MoS2,则H2转化率增大
C.容器内气体的密度不变时,一定达平衡状态
D.容器内压强不变时,一定达平衡状态
③由图可知M点时氢气的平衡转化率为_____ (计算结果保留0.1%) 。
④平衡常数可用平衡分压代替平衡浓度计算,气体分压=气体总压×物质的量分数。求图中M点的平衡常数KP=_____ (MPa)2
(1)Mo可被发烟硝酸氧化,产物MoOF4 和MoO2F2物质的量比为1:1,完成下列方程式:
____Mo+____HF+_____HNO3=_______MoO2F2+_______MoOF4+NO2↑+_____________,
(2) 已知:
①2Mo(s)+3O2(g)=2MoO3(s) ΔH1
②MoS2(s) +2O2(g)==Mo(s)+2SO2(g) ΔH2
③2MoS2(s)+7O2(g)==2MoO3(s)+4SO2(g) ΔH3
则ΔH3=
(3)密闭容器中用Na2CO3(s)作固硫剂,同时用一定量的氢气还原钼矿(MoS2) 原理是:MoS2(s)+4H2(g)+2Na2CO3(s)==Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) ΔH
实验测得平衡时的有关变化曲线如图所示

①由图可知,该反应的ΔH
②如果上述反应在体积不变的密闭容器中达平衡,下列说法错误的是
A.V正(H2)=V逆(H2O)
B 再加入MoS2,则H2转化率增大
C.容器内气体的密度不变时,一定达平衡状态
D.容器内压强不变时,一定达平衡状态
③由图可知M点时氢气的平衡转化率为
④平衡常数可用平衡分压代替平衡浓度计算,气体分压=气体总压×物质的量分数。求图中M点的平衡常数KP=
您最近一年使用:0次



