2019高一下·全国·专题练习
名校
解题方法
1 . 工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g) CH3OH(g),反应过程中的能量变化情况如图所示。
CH3OH(g),反应过程中的能量变化情况如图所示。
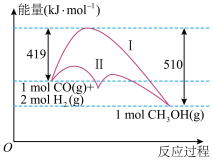
(1)曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。该反应是________ (填“吸热”或“放热”)反应。计算当反应生成1.5 mol CH3OH(g)时,能量变化是________ kJ。
(2)选择适宜的催化剂________ (填“能”或“不能”)改变该反应的反应热。
(3)推测反应CH3OH(g)⇌CO(g)+2H2(g)是________ (填“吸热”或“放热”)反应。
 CH3OH(g),反应过程中的能量变化情况如图所示。
CH3OH(g),反应过程中的能量变化情况如图所示。
(1)曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。该反应是
(2)选择适宜的催化剂
(3)推测反应CH3OH(g)⇌CO(g)+2H2(g)是
您最近一年使用:0次
2019-03-18更新
|
621次组卷
|
4卷引用:人教版2019必修第二册 第六章 本章复习提升
人教版2019必修第二册 第六章 本章复习提升(已下线)2019年3月14日 《每日一题》 必修2 化学反应过程的能量变化图分析2020春(新教材)人教化学第二册第6章 化学反应与能量练习湖北省随州市曾都一中2019-2020学年高一下学期3月月考化学试题
2 . 氨气是一种重要的化学物质,可用于制取化肥和硝酸等。
(1)工业合成氨的热化学方程式为:N2(g)+3H2(g) 2NH3(g) △H=-92 kJ/mol
2NH3(g) △H=-92 kJ/mol
表中a为___________ 。
(2)合成氨原料中的H2可用CO在高温下与水蒸气反应制得。已知在25℃、101 kPa 下:
I. 2C(石墨,s)+O2(g)=2CO(g) △H1=- 222 kJ/mol
II.2H2(g)+O2(g)=2H2O(g) △H2=- 242 kJ/mol
III. C(石墨,s)+ O2(g)=CO2(g) △H3=- 394kJ/mol
①25℃、101 kPa 下CO与水蒸气反应转化为H2的热化学方程式为___________ 。
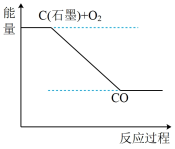
②根据反应I、II、III,下列说法正确的是___________ (填选项字母)。
a.由反应II可以推知:2H2(g)+O2(g)=2H2O(l) △H4,则△H4小于△H2
b.反应III的反应热等于O2分子中化学键断裂时所吸收的总能量与CO2分子中化学键形成时所释放的总能量的差
c.下图可表示反应I的反应过程和能量的关系
 。
。
(1)工业合成氨的热化学方程式为:N2(g)+3H2(g)
 2NH3(g) △H=-92 kJ/mol
2NH3(g) △H=-92 kJ/mol| N-H | H-H | N≡N | |
| 断开1 mol化学键需要吸收的能量/kJ | a | 436 | 946 |
(2)合成氨原料中的H2可用CO在高温下与水蒸气反应制得。已知在25℃、101 kPa 下:
I. 2C(石墨,s)+O2(g)=2CO(g) △H1=- 222 kJ/mol
II.2H2(g)+O2(g)=2H2O(g) △H2=- 242 kJ/mol
III. C(石墨,s)+ O2(g)=CO2(g) △H3=- 394kJ/mol
①25℃、101 kPa 下CO与水蒸气反应转化为H2的热化学方程式为
②根据反应I、II、III,下列说法正确的是
a.由反应II可以推知:2H2(g)+O2(g)=2H2O(l) △H4,则△H4小于△H2
b.反应III的反应热等于O2分子中化学键断裂时所吸收的总能量与CO2分子中化学键形成时所释放的总能量的差
c.下图可表示反应I的反应过程和能量的关系
 。
。
您最近一年使用:0次
3 . 已知: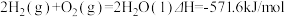 ①
①
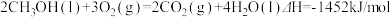 ②
②
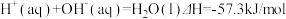
下列说法正确的是
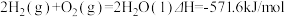 ①
①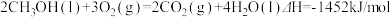 ②
②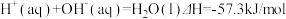
下列说法正确的是
| A.H2(g)的燃烧热为571.6kJ/mol |
| B.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多 |
C.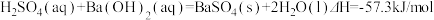 |
D.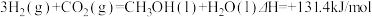 |
您最近一年使用:0次
2021-06-14更新
|
309次组卷
|
3卷引用:四川省南充西南大学实验学校2020-2021学年高一下学期6月月考化学试题
四川省南充西南大学实验学校2020-2021学年高一下学期6月月考化学试题(已下线)第一章 第三节 化学反应热的计算(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版选修4)辽宁省大石桥市第三高级中学等三校2022-2023学年高一下学期5月期中联考化学试题
名校
解题方法
4 . 长征五号B运载火箭是中国近地轨道运载能力最大的新一代运载火箭,承担中国空间站舱段发射任务.采用液氧、液氢作为推进剂.回答下列问题:
(1)与偏二甲肼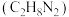 、四氧化二氨推进剂相比,液氢、液氧推进剂的优点是
、四氧化二氨推进剂相比,液氢、液氧推进剂的优点是___________ ;
(2)已知: ;
;
 ;
;
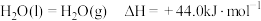 ;
;
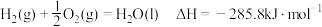 .
.
请写出液氢和液氧生成气态水的热化学方程式:______________ ,氢气的燃烧热
________ ;
(3)如果长征五号B运载火箭所携带的燃料为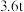 液氢、液氢,且液氢、液氧恰好完全反应生成气态水,总共释放能量
液氢、液氢,且液氢、液氧恰好完全反应生成气态水,总共释放能量________  (保留3位有效数字);
(保留3位有效数字);
(4)光催化制氢是能源研究热点.一种光催化水分解制取氢气的机理如图所示.

①该转化过程中,________ 能转化为化学能;
②由图可知, 转化为
转化为 的催化剂是
的催化剂是________ (填字母)。
A. B.
B. C.
C. D.紫外线
D.紫外线
(1)与偏二甲肼
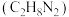 、四氧化二氨推进剂相比,液氢、液氧推进剂的优点是
、四氧化二氨推进剂相比,液氢、液氧推进剂的优点是(2)已知:
 ;
; ;
;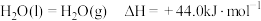 ;
;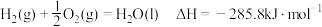 .
.请写出液氢和液氧生成气态水的热化学方程式:

(3)如果长征五号B运载火箭所携带的燃料为
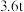 液氢、液氢,且液氢、液氧恰好完全反应生成气态水,总共释放能量
液氢、液氢,且液氢、液氧恰好完全反应生成气态水,总共释放能量 (保留3位有效数字);
(保留3位有效数字);(4)光催化制氢是能源研究热点.一种光催化水分解制取氢气的机理如图所示.

①该转化过程中,
②由图可知,
 转化为
转化为 的催化剂是
的催化剂是A.
 B.
B. C.
C. D.紫外线
D.紫外线
您最近一年使用:0次
名校
5 . 已知白磷和P4O6的分子结构如图所示,又知化学键的键能是形成(或断开)1 mol化学键时释放(或吸收)的能量,现查知P—P键能为198 kJ·mol-1、P—O键能为360 kJ·mol-1、O=O键能为498 kJ·mol-1。若生成1 mol P4O6,则反应P4(白磷)+3O2=P4O6中的能量变化为


| A.吸收1 638 kJ能量 | B.放出1 638 kJ能量 |
| C.吸收126 kJ能量 | D.放出126 kJ能量 |
您最近一年使用:0次
2017-12-22更新
|
1309次组卷
|
10卷引用:广西玉林市直六所普通高中2020-2021学年高一下学期期中联合考试化学试题
广西玉林市直六所普通高中2020-2021学年高一下学期期中联合考试化学试题河北省枣强中学2017-2018学年高一下学期第一次月考化学试题河北省邢台市第二中学2017-2018学年高一下学期第一次月考化学试题吉林省扶余市第一中学2017-2018学年高一下学期期末考试化学试题甘肃省岷县第一中学2018-2019学年高一下学期第一次月考化学试题人教版高中化学必修2第二章《化学反应与能量》测试卷2黑龙江省安达市第七中学2019-2020学年高一3月月考化学试题山西省忻州市第一中学2019-2020学年高一下学期开学考试化学试题云南省峨山彝族自治县第一中学2017-2018学年高二上学期期末市统测模拟考化学试题云南省屏边县民族高级中学2019-2020学年高二上学期开学考试化学试题
解题方法
6 . 计算
(1)焦炭与CO、CO2、H2均是重要的化工原料。由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH1=-49.58 kJ·mol-1
反应Ⅱ:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2=+41.19 kJ·mol-1
反应Ⅲ:CO(g)+2H2(g)=CH3OH(g) ΔH3
则反应Ⅲ的ΔH3=___________ 。
(2)低能耗高效率的合成氨技术开发是实现氨燃料化利用的基础。探索新型合成氨技术是研究热点之一。回答下列问题:
哈伯合成氨在较高温度下以氢气做氢源,氢气可由天然气制备。CH4(g)+H2O(g) CO(g)+3H2(g)
CO(g)+3H2(g)
下表列出了几种化学键的键能:【CO的结构 】
】
298 K时,上述反应的ΔH=___________ 。
(1)焦炭与CO、CO2、H2均是重要的化工原料。由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH1=-49.58 kJ·mol-1
反应Ⅱ:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2=+41.19 kJ·mol-1
反应Ⅲ:CO(g)+2H2(g)=CH3OH(g) ΔH3
则反应Ⅲ的ΔH3=
(2)低能耗高效率的合成氨技术开发是实现氨燃料化利用的基础。探索新型合成氨技术是研究热点之一。回答下列问题:
哈伯合成氨在较高温度下以氢气做氢源,氢气可由天然气制备。CH4(g)+H2O(g)
 CO(g)+3H2(g)
CO(g)+3H2(g)下表列出了几种化学键的键能:【CO的结构
 】
】| 化学键 | H-H | C-H | H-O |  |
| 键能kJ/mol | 436 | 413 | 467 | 1072 |
您最近一年使用:0次
7 . 已知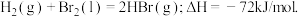 蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如下表:
蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如下表:
则表中a为
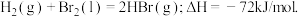 蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如下表:
蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如下表:| H2(g) | Br2(g) | HBr(g) | |
| 1mol分子中的化学键断裂时需要吸收的能量(kJ) | 436 | a | 369 |
| A.404 | B.260 | C.230 | D.200 |
您最近一年使用:0次
2016-12-09更新
|
2035次组卷
|
55卷引用:高中化学苏教2019版必修第二册-专题6 第二单元 第1课时 放热反应与吸热反应
高中化学苏教2019版必修第二册-专题6 第二单元 第1课时 放热反应与吸热反应2010年高考化学试题分项专题七 化学反应中的能量变化2010年高考化学试题分项专题十四 化学计算(已下线)2011-2012学年浙江省金华一中高一下学期期中考试化学试卷(已下线)2012-2013学年浙江省杭州二中高一下学期期中考试化学理科试卷(已下线)2014年高一下学期化学必修2 2-1 化学能与热能练习卷安徽省黄山市2016-2017学年高一下学期期末考试化学试题【全国百强校】北京市第四中学2017-2018学年高一下学期期末考试化学(选考)试题广西壮族自治区田阳高中2019-2020学年高一5月月考化学试题青海省海南州贵德高级中学2020-2021学年高二下学期期中化学试题河南省郑州国庆中学2021-2022学年高二上学期期中考试化学试题重庆市望江中学校2021-2022学年高一下学期期中考试化学试题辽宁省恒仁满族自治县第二高级中学2021-2022学年高二上学期期中考试化学试题2010年普通高等学校招生全国统一考试理综化学部分(重庆卷)(已下线)2010年6月浙江省金温七校高二化学期末卷(已下线)2010年黑龙江省双鸭山一中高三上学期期中考试(化学)(已下线)2010年辽宁省沈阳四校联合体高二上学期期中考试化学卷(已下线)2010年山西省临汾一中高二上学期期中考试化学试题(已下线)2011-2012年福建省福州市罗源一中高二上学期第一次月考化学试卷(已下线)2011-2012年广东省汕头市金山中学高二上学期期中考试化学试卷(理科)(已下线)2011-2012学年甘肃省兰州一中高二上学期期中考试化学(理)试卷(已下线)2012届河北省衡水中学高三第三次调研考试化学试卷(已下线)2011-2012学年福建省南安一中高二上学期期中考试化学试卷(已下线)2011-2012学年福建省南安一中高二上学期期中考试化学(理)试卷(已下线)2011-2012学年山东省莘县实验高中高二上学期期中考试化学试卷(已下线)2014届新疆乌鲁木齐市兵团二中高二(上)期末化学试卷(已下线)2014届浙江省嘉兴一中高二下学期期中考试化学试卷 (已下线)2013-2014安徽省安庆一中、合肥六中第二学期期末联考高二化学试卷(已下线)2015届四川省成都市高新区高三9月月考化学试卷(已下线)2014-2015学年河南鄢陵县第一高中高二上第一次考试化学(A)试卷(已下线)2014-2015学年河南鄢陵县第一高中高二上第一次考试化学(B)试卷2014-2015学年浙江省衢州第二中学高二上学期期中化学试卷2015-2016学年山西太原五中高二上第一周考理科化学试卷2015-2016学年江西省南昌二中高二上第一次月考化学试卷2015-2016学年江西八一、洪都、麻丘中学等高二上期中联考化学试卷2016届甘肃省兰州第一中学高三12月月考化学试卷2015-2016学年山东省烟台市莱山一中高二化学上学期段考试卷2016-2017学年河北正定中学高二上开学考试化学卷2016-2017学年黑龙江省大庆一中高二上开学测化学卷2016-2017学年广东实验中学顺德学校高二上阶段质检化学试卷2016-2017学年辽宁省盘锦高中高二上期中化学卷2017届陕西省师范大学附属中学高三上学期第二次模考化学试卷河北省邢台市第八中学2018-2019学年高二上学期期中考试化学试题高二人教版选修4 第一章 第一节 化学反应与能量的变化山西省应县第一中学校2019-2020学年高二上学期期中考试化学试题2020届高三化学选修4二轮专题练——盖斯定律的应用【选择精编25题】鲁科版(2019)选择性必修1 第1章 化学反应与能量转化 第1节 化学反应的热效应山东省新泰一中东校2020-2021学年高二上学期第一次月考化学试题河北省石家庄市藁城区第一中学2020-2021学年高二上学期第一次月考化学试题江西省抚州市金溪县第一中学2020-2021学年高二上学期第一次月考化学试题浙江省湖州市长兴县等三县2017-2018学年高二上学期期中考试化学试题湖南省宁乡市四校联考2022-2023学年高二上学期10月月考化学试题黑龙江省哈尔滨市第三中学2022-2023学年高二上学期第二次验收化学试题黑龙江省牡丹江市第一高级中学2022-2023学年高二上学期期中考试化学试题山东省菏泽市曹县第一中学2022-2023学年高二上学期12月份阶段检测化学试题
名校
解题方法
8 . 在如图所示的恒温、恒压密闭容器中加入2 mol X和2 mol Y,发生如下反应并达到平衡(X、Y状态未知):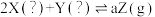 。起始时容器的体积为V L,达到平衡时X、Y、Z的物质的量之比为1:3:2,且容器的体积仍然为V L。请回答下列问题:
。起始时容器的体积为V L,达到平衡时X、Y、Z的物质的量之比为1:3:2,且容器的体积仍然为V L。请回答下列问题:

(1)a=_______ 。
(2)平衡时Y的转化率=_______ 。
(3)X的状态为_______ (填“气态”或“非气态”)。
(4)下列叙述中,能说明上述反应达到平衡状态的是_______ (填标号)。
a.气体密度不变
b.单位时间内消耗2 mol X,同时生成a mol Z
c.Y的转化率不再变化
d.Z的浓度不再变化
(5)已知:
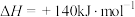

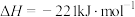
写出 和焦炭、氯气反应生成液态
和焦炭、氯气反应生成液态 和CO气体的热化学方程式:
和CO气体的热化学方程式:_______ 。
(6)依据下表信息,要精制含少量 杂质的
杂质的 ,可采用
,可采用_______ 方法。
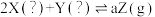 。起始时容器的体积为V L,达到平衡时X、Y、Z的物质的量之比为1:3:2,且容器的体积仍然为V L。请回答下列问题:
。起始时容器的体积为V L,达到平衡时X、Y、Z的物质的量之比为1:3:2,且容器的体积仍然为V L。请回答下列问题:
(1)a=
(2)平衡时Y的转化率=
(3)X的状态为
(4)下列叙述中,能说明上述反应达到平衡状态的是
a.气体密度不变
b.单位时间内消耗2 mol X,同时生成a mol Z
c.Y的转化率不再变化
d.Z的浓度不再变化
(5)已知:

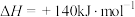

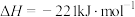
写出
 和焦炭、氯气反应生成液态
和焦炭、氯气反应生成液态 和CO气体的热化学方程式:
和CO气体的热化学方程式:(6)依据下表信息,要精制含少量
 杂质的
杂质的 ,可采用
,可采用 |  | |
| 熔点/℃ | -25.0 | -68.8 |
| 沸点/℃ | 136.4 | 57.6 |
您最近一年使用:0次
解题方法
9 . CH4—CO2催化重整是减少温室气体排放的重要途径。已知以下的热化学反应方程式:
C(s)+2H2(g)=CH4(g) △H1=-75kJ/mol
C(s)+O2(g)=CO2(g) △H2=-394kJ/mol
C(s)+ O2(g)=CO(g) △H3=-111kJ/mol
O2(g)=CO(g) △H3=-111kJ/mol
写出催化重整反应CH4(g)和CO2(g)生成CO(g)和H2(g)的热化学方程式:___________ 。
C(s)+2H2(g)=CH4(g) △H1=-75kJ/mol
C(s)+O2(g)=CO2(g) △H2=-394kJ/mol
C(s)+
 O2(g)=CO(g) △H3=-111kJ/mol
O2(g)=CO(g) △H3=-111kJ/mol写出催化重整反应CH4(g)和CO2(g)生成CO(g)和H2(g)的热化学方程式:
您最近一年使用:0次
名校
10 . 用CO2和H2在一定条件下可转化生成甲醇蒸气和水蒸CO2(g)+3H2(g) CH3OH(g)+H2O(g);ΔH=-akJ/mol
CH3OH(g)+H2O(g);ΔH=-akJ/mol
(1)已知:①3CO(g)+3H2(g) CH3OCH3(g)+CO2(g) ΔH=-247kJ/mol
CH3OCH3(g)+CO2(g) ΔH=-247kJ/mol
②2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH=-24kJ/mol
CH3OCH3(g)+H2O(g) ΔH=-24kJ/mol
③CO(g)+H2O(g) CO2(g)+H2(g) ΔH=-41kJ/mol
CO2(g)+H2(g) ΔH=-41kJ/mol
则a=___________ 。
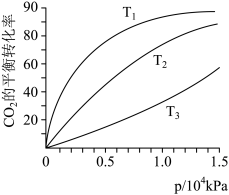
(2)CO2在不同温度下的平衡转化率与压强的关系如下图所示。请写出T1、T2、T3三者的大小关系___________ ,实际生产条件控制在T1、1.3×104kPa左右,选择此压强的理由是___________ 。
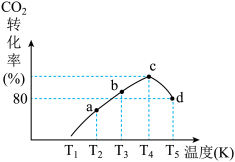
(3)一定条件下,在相同体积的恒容密闭容器中充入1.0molCO2和3.0molH2,相同时间段内测得CO2的转化率随温度变化如图所示:b点v正___________ v逆(填“>”“<”或“=”);温度高于T4,CO2的转化率降低的原因是___________ 。已知容器内的起始压强为200kPa,则图中d点对应温度下反应的平衡常数Kp=___________ (kPa)-2(结果保留两位有效数字)(KP为以分压表示的平衡常数,分压=总压×物质的量分数)
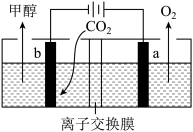
(4)用惰性电极电解强酸性的二氧化碳水溶液可得到甲醇,其原理如下图所示。
①b电极上的电极反应式为___________ ;
②该装置中使用的是___________ (填“阳”或“阴”)离子交换膜。
 CH3OH(g)+H2O(g);ΔH=-akJ/mol
CH3OH(g)+H2O(g);ΔH=-akJ/mol(1)已知:①3CO(g)+3H2(g)
 CH3OCH3(g)+CO2(g) ΔH=-247kJ/mol
CH3OCH3(g)+CO2(g) ΔH=-247kJ/mol②2CH3OH(g)
 CH3OCH3(g)+H2O(g) ΔH=-24kJ/mol
CH3OCH3(g)+H2O(g) ΔH=-24kJ/mol③CO(g)+H2O(g)
 CO2(g)+H2(g) ΔH=-41kJ/mol
CO2(g)+H2(g) ΔH=-41kJ/mol则a=
(2)CO2在不同温度下的平衡转化率与压强的关系如下图所示。请写出T1、T2、T3三者的大小关系

(3)一定条件下,在相同体积的恒容密闭容器中充入1.0molCO2和3.0molH2,相同时间段内测得CO2的转化率随温度变化如图所示:b点v正

(4)用惰性电极电解强酸性的二氧化碳水溶液可得到甲醇,其原理如下图所示。
①b电极上的电极反应式为
②该装置中使用的是

您最近一年使用:0次



