名校
1 . 乙醇的燃烧热为ΔH1,甲醇的燃烧热为ΔH2,且ΔH1<ΔH2,若乙醇和甲醇的混合物1 mol完全燃烧,反应热为ΔH3,则乙醇和甲醇的物质的量之比为
A.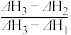 | B.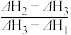 | C.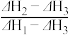 | D. |
您最近一年使用:0次
2019-09-27更新
|
581次组卷
|
8卷引用:陕西省西安市铁一中 学2021-2022学年高一下学期期中考试化学试题
2 . 室温下,将1mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为ΔH1,将1mol的CuSO4(s)溶于水会使溶液温度升高,热效应为ΔH2,CuSO4·5H2O受热分解的化学方程式为:CuSO4·5H2O(s) CuSO4(s)+5H2O(1),热效应为ΔH3.则下列判断正确的是
CuSO4(s)+5H2O(1),热效应为ΔH3.则下列判断正确的是
 CuSO4(s)+5H2O(1),热效应为ΔH3.则下列判断正确的是
CuSO4(s)+5H2O(1),热效应为ΔH3.则下列判断正确的是| A.ΔH2>ΔH3 | B.ΔH1<ΔH3 |
| C.ΔH1+ΔH3=ΔH2 | D.ΔH1+ΔH2=ΔH3 |
您最近一年使用:0次
2021-07-24更新
|
262次组卷
|
2卷引用:辽宁省铁岭市六校2020-2021学年高一下学期期末联考化学试题
名校
解题方法
3 . 工业合成氨的反应N2+3H2=2NH3的能量变化如图所示,请回答有关问题:
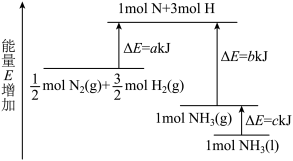
(1)合成1molNH3(l)___________ (填“吸收”或“放出”)___________ kJ的热量。(用字母表示)
(2)已知:拆开1molH—H键、1molN—H键、1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则1molN2(g)完全反应生成NH3(g)产生的能量变化为___________ kJ。
(3)推测反应2NH3(l)=N2(g)+3H2(g)比反应2NH3(g)=N2(g)+3H2(g)___________ (填“吸收”或“放出”)的热量___________ (填“多”或“少”)。

(1)合成1molNH3(l)
(2)已知:拆开1molH—H键、1molN—H键、1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则1molN2(g)完全反应生成NH3(g)产生的能量变化为
(3)推测反应2NH3(l)=N2(g)+3H2(g)比反应2NH3(g)=N2(g)+3H2(g)
您最近一年使用:0次
2021-05-03更新
|
300次组卷
|
8卷引用:江西省南昌市八一中学、洪都中学等七校2020-2021学年高一下学期期中联考化学试题
江西省南昌市八一中学、洪都中学等七校2020-2021学年高一下学期期中联考化学试题安徽省滁州市定远县育才学校2020-2021学年高一下学期期中考试化学试题江西省赣州市南康区第三中学2020-2021学年高一下学期期中考试化学试题黑龙江省齐齐哈尔市第八中学校2020-2021学年高一下学期期中考试化学试题山西省朔州市应县第一中学校2019-2020学年高一下学期期中考试化学试题云南省昌宁县第一中学2021-2022学年高一 3月月考化学试题陕西省渭南市华州区咸林中学2022-2023学年高一下学期期中考试化学试题(已下线)练习3 化学反应热的计算-2020-2021学年【补习教材·寒假作业】高二化学(人教版)
4 . (1)在恒容的密闭容器中,气体X与气体Y反应可生成气体Z,反应过程中,X、Y、Z三种气体的浓度(c)随时间(t)的变化关系如图_______ ,若t0=10s,用X表示的该反应速率为_______ ;若向容器中充入He,该反应速率_______ (填“加快”或“减慢”或“不变”)
(2)一种新型催化剂用于NO和CO的反应:2NO+2CO⇌2CO2+N2。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在表中。
①a=_______ 。
②能验证温度对化学反应速率规律的是实验_______ (填实验序号)。
③实验Ⅰ和实验Ⅱ中,NO的物质的量浓度c(NO)随时间t的变化曲线如图所示,其中表示实验Ⅱ的是曲线_______ (填“甲”或“乙”)。_______ (任写一条)。
(3)已知:P(s,白磷)=P(s,黑磷),每1molP(s,白磷)发生反应,放出39.3kJ的热量,P(s,白磷)=P(s,红磷),每1molP(s,白磷)发生反应,放出17.6kJ的热量,由此推知,其中最稳定的磷单质是_______ (填“黑磷”或“红磷”)。
(4)丙烷氧气燃料电池在碱性电解质环境中放电时丙烷在_______ (填“正”或“负”)极发生的电极反应式为_______ ,电路中每转移0.4mol电子,标准状况下消耗O2的体积是_______ L。

(2)一种新型催化剂用于NO和CO的反应:2NO+2CO⇌2CO2+N2。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在表中。
| 实验编号 | t(℃) | NO初始浓度(mol/L) | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
| Ⅰ | 280 | 1.2×10−3 | 5.80×10−3 | 82 |
| Ⅱ | 280 | 1.2×10−3 | b | 124 |
| Ⅲ | 350 | a | 5.80×10−3 | 82 |
②能验证温度对化学反应速率规律的是实验
③实验Ⅰ和实验Ⅱ中,NO的物质的量浓度c(NO)随时间t的变化曲线如图所示,其中表示实验Ⅱ的是曲线

(3)已知:P(s,白磷)=P(s,黑磷),每1molP(s,白磷)发生反应,放出39.3kJ的热量,P(s,白磷)=P(s,红磷),每1molP(s,白磷)发生反应,放出17.6kJ的热量,由此推知,其中最稳定的磷单质是
(4)丙烷氧气燃料电池在碱性电解质环境中放电时丙烷在
您最近一年使用:0次
2021-06-15更新
|
377次组卷
|
4卷引用:四川省广安友谊中学高2020-2021学年高一下学期6月月考化学试题
四川省广安友谊中学高2020-2021学年高一下学期6月月考化学试题天津市第四十三中学2020-2021学年高一下学期期末考试化学试题(已下线)重难点04 化学反应速率及平衡图表问题的分析 平衡状态的判断-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(天津专用)(已下线)专题03 化学反应的速率与限度-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(天津专用)
5 . 碘与氢气反应的热化学方程式是
①
②
下列说法正确的是
①

②

下列说法正确的是
| A.①的产物比②的产物稳定 |
| B.I2(s)→I2(g) -17.00kJ |
| C.②的反应物总能量比①的反应物总能量高 |
| D.1molI2(g)和1molH2(g)完全反应生成2molHI(g)时,放热9.48kJ |
您最近一年使用:0次
20-21高一下·全国·课时练习
名校
解题方法
6 . 氢能是最具前景的清洁能源之一,目前水分解制氢技术及贮氢材料的开发应用都取得了很大进展。已知:2H2(g)+ O2(g)=2H2O(1)∆H=-571.6kJ·mol-1。下列说法错误的是
| A.1mol H2O(l)分解制得1molH2需要吸收571.6kJ的能量 |
| B.氢气作为新能源具有热值高、无污染、资源丰富、可再生等优点 |
| C.贮氢材料具有能大量、快速和高效率地吸收和释放氢气的特点 |
| D.利用太阳能光催化分解水制氢是一种理想的制氢手段 |
您最近一年使用:0次
2021-03-09更新
|
272次组卷
|
3卷引用:6.2.2 燃料燃烧释放的能量 氢燃料的应用前景(练习)-2020-2021学年下学期高一化学同步精品课堂(苏教版2019必修第二册)
(已下线)6.2.2 燃料燃烧释放的能量 氢燃料的应用前景(练习)-2020-2021学年下学期高一化学同步精品课堂(苏教版2019必修第二册)江苏省沭阳县修远中学2020-2021学年高一下学期第一次月考化学试题江苏省淮安市涟水县第一中学2021-2022学年高一下学期第一次阶段检测化学试题
解题方法
7 . 发射卫星时可用肼(N2H4)作燃料,用二氧化氮作氧化剂,这两种物质反应生成氮气和水蒸气。
已知:N2(g)+2O2(g)=2NO2(g) ΔH=+67.7kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-534kJ·mol-1
 H2(g)+
H2(g)+ F2(g)=HF(g) ΔH=-269kJ·mol-1
F2(g)=HF(g) ΔH=-269kJ·mol-1
H2(g)+ O2(g)=H2O(g) ΔH=-242kJ·mol-1
O2(g)=H2O(g) ΔH=-242kJ·mol-1
(1)肼和二氧化氮反应的热化学方程式为_______ 。
(2)有人认为若用氟气代替二氧化氮作氧化剂,则反应释放的能量更大。肼和氟反应的热化学方程式为_______ 。
已知:N2(g)+2O2(g)=2NO2(g) ΔH=+67.7kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-534kJ·mol-1
 H2(g)+
H2(g)+ F2(g)=HF(g) ΔH=-269kJ·mol-1
F2(g)=HF(g) ΔH=-269kJ·mol-1H2(g)+
 O2(g)=H2O(g) ΔH=-242kJ·mol-1
O2(g)=H2O(g) ΔH=-242kJ·mol-1(1)肼和二氧化氮反应的热化学方程式为
(2)有人认为若用氟气代替二氧化氮作氧化剂,则反应释放的能量更大。肼和氟反应的热化学方程式为
您最近一年使用:0次
解题方法
8 . 回答下列问题:
I.已知:①N2(g)+O2(g)=2NO(g) ΔH=+l80.5 kJ·mol-1
②C(S)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
③2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
(1)上述反应中属于放热反应的是_______ (填序号,下同),属于吸热反应的是_______ 。
(2)24 g固体碳粉完全燃烧生成CO2放出热量_______ kJ。
(3)已知NO和CO完全反应产生CO2和N2,请写出该反应的热化学方程式_______
Ⅱ.某温度时,在一个2 L的恒容密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化的曲线如图所示。回答下列问题:
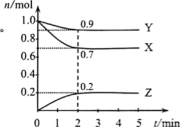
(4)化学方程式为_______ ,从反应开始到2 min,v(X)=_______ 。
(5)t为2 min时的压强是开始时压强的_______ 倍。
(6)下列说法中正确的是_______ (填选项)。
A.2v(X)=v(Z)
B.反应过程中,容器内压强先减小后不变
C.t=2 min时,X,Y的转化率相等
D.反应过程中,容器内混合气体的密度一直保持不变
I.已知:①N2(g)+O2(g)=2NO(g) ΔH=+l80.5 kJ·mol-1
②C(S)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
③2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
(1)上述反应中属于放热反应的是
(2)24 g固体碳粉完全燃烧生成CO2放出热量
(3)已知NO和CO完全反应产生CO2和N2,请写出该反应的热化学方程式
Ⅱ.某温度时,在一个2 L的恒容密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化的曲线如图所示。回答下列问题:

(4)化学方程式为
(5)t为2 min时的压强是开始时压强的
(6)下列说法中正确的是
A.2v(X)=v(Z)
B.反应过程中,容器内压强先减小后不变
C.t=2 min时,X,Y的转化率相等
D.反应过程中,容器内混合气体的密度一直保持不变
您最近一年使用:0次
解题方法
9 . 联氨( )是一种应用广泛的化工原料,常用作火箭和燃料电池的燃料。回答下列问题:
)是一种应用广泛的化工原料,常用作火箭和燃料电池的燃料。回答下列问题:
(1)工业上利用 和
和 合成
合成 ,用
,用 进一步制备联氨
进一步制备联氨 。
。
①已知断开(或形成)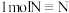 键、
键、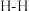 键分别需要吸收(或放出)
键分别需要吸收(或放出)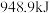 ,
, 的热量,合成
的热量,合成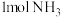 可放出
可放出 的热量,则形成
的热量,则形成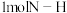 放出的热量为
放出的热量为___________  (保留一位小数)。
(保留一位小数)。
②工业上一种制备联氨的方法为 。该反应涉及物质中属于离子化合物的是
。该反应涉及物质中属于离子化合物的是___________ (填写化学式)。制备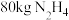 ,反应中转移电子的物质的量为
,反应中转移电子的物质的量为___________  。
。
(2)发射航天器时常以 为燃料,
为燃料, 为推进剂。
为推进剂。
已知
ⅰ.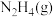 的摩尔燃烧焓为
的摩尔燃烧焓为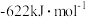 。
。
ⅱ.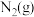 与
与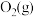 反应的物质和能量变化示意图如下:
反应的物质和能量变化示意图如下:
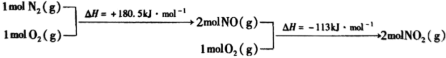
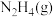 与
与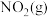 反应生成
反应生成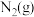 和
和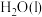 的热化学方程式为
的热化学方程式为___________ 。
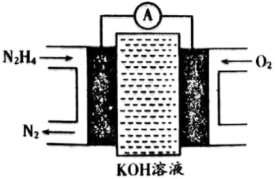
(3)一种联氨燃料电池的工作原理如图所示。放电一段时间,电解质溶液中 的物质的量浓度
的物质的量浓度___________ (填“增大”“减小”或“不变”),负极反应式为___________ 。
 )是一种应用广泛的化工原料,常用作火箭和燃料电池的燃料。回答下列问题:
)是一种应用广泛的化工原料,常用作火箭和燃料电池的燃料。回答下列问题:(1)工业上利用
 和
和 合成
合成 ,用
,用 进一步制备联氨
进一步制备联氨 。
。①已知断开(或形成)
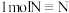 键、
键、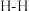 键分别需要吸收(或放出)
键分别需要吸收(或放出)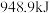 ,
, 的热量,合成
的热量,合成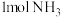 可放出
可放出 的热量,则形成
的热量,则形成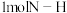 放出的热量为
放出的热量为 (保留一位小数)。
(保留一位小数)。②工业上一种制备联氨的方法为
 。该反应涉及物质中属于离子化合物的是
。该反应涉及物质中属于离子化合物的是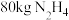 ,反应中转移电子的物质的量为
,反应中转移电子的物质的量为 。
。(2)发射航天器时常以
 为燃料,
为燃料, 为推进剂。
为推进剂。已知
ⅰ.
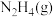 的摩尔燃烧焓为
的摩尔燃烧焓为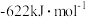 。
。ⅱ.
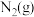 与
与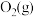 反应的物质和能量变化示意图如下:
反应的物质和能量变化示意图如下: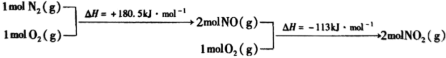
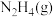 与
与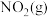 反应生成
反应生成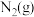 和
和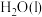 的热化学方程式为
的热化学方程式为(3)一种联氨燃料电池的工作原理如图所示。放电一段时间,电解质溶液中
 的物质的量浓度
的物质的量浓度
您最近一年使用:0次
解题方法
10 . (1)研究 、
、 等大气污染气体的处理方法具有重要的意义。
等大气污染气体的处理方法具有重要的意义。
已知:①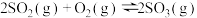
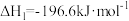
②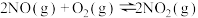
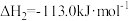
则反应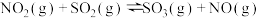 的
的
_______  。
。
(2)t℃时,将2mol 和1mol
和1mol 通入体积为2L的恒温、恒容密闭容器中,发生如下反应:
通入体积为2L的恒温、恒容密闭容器中,发生如下反应: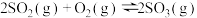 ,2min时反应达到化学平衡,此时测得容器内的压强为起始压强的0.8倍,请回答:
,2min时反应达到化学平衡,此时测得容器内的压强为起始压强的0.8倍,请回答:
①下列叙述能证明该反应已达到化学平衡状态的是_______ (选填字母)。
A.容器内压强不再发生变化
B. 的体积分数不再发生变化
的体积分数不再发生变化
C.容器内气体原子总数不再发生变化
D.相同时间内消耗2nmol 的同时消耗nmol
的同时消耗nmol
E.相同时间内消耗2nmol 的同时生成nmol
的同时生成nmol
F.混合气体密度不再变化
②从反应开始到达化学平衡,生成 的平均反应速率为
的平均反应速率为___ ;平衡时, 的转化率为
的转化率为___ 。
(3)已知 电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是
电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是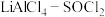 。电池的总反应可表示为
。电池的总反应可表示为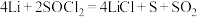 。请回答下列问题:
。请回答下列问题:
①电池的负极材料为_______ ,发生的电极反应为_______ 。
②电池正极发生的电极反应为_______ 。
 、
、 等大气污染气体的处理方法具有重要的意义。
等大气污染气体的处理方法具有重要的意义。已知:①
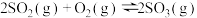
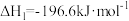
②
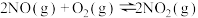
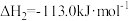
则反应
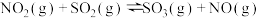 的
的
 。
。(2)t℃时,将2mol
 和1mol
和1mol 通入体积为2L的恒温、恒容密闭容器中,发生如下反应:
通入体积为2L的恒温、恒容密闭容器中,发生如下反应: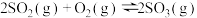 ,2min时反应达到化学平衡,此时测得容器内的压强为起始压强的0.8倍,请回答:
,2min时反应达到化学平衡,此时测得容器内的压强为起始压强的0.8倍,请回答:①下列叙述能证明该反应已达到化学平衡状态的是
A.容器内压强不再发生变化
B.
 的体积分数不再发生变化
的体积分数不再发生变化C.容器内气体原子总数不再发生变化
D.相同时间内消耗2nmol
 的同时消耗nmol
的同时消耗nmol
E.相同时间内消耗2nmol
 的同时生成nmol
的同时生成nmol
F.混合气体密度不再变化
②从反应开始到达化学平衡,生成
 的平均反应速率为
的平均反应速率为 的转化率为
的转化率为(3)已知
 电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是
电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是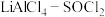 。电池的总反应可表示为
。电池的总反应可表示为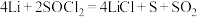 。请回答下列问题:
。请回答下列问题:①电池的负极材料为
②电池正极发生的电极反应为
您最近一年使用:0次



