1 . 甲烷液化可获得工业原料甲醇,反应原理是:
①CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH1=+206.4kJ·mol-1
②CO(g)+H2O(g)===CO2(g)+H2(g) ΔH2=-41.0kJ·mol-1
③CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH3=-49.0kJ·mol-1
下列说法正确的是
①CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH1=+206.4kJ·mol-1
②CO(g)+H2O(g)===CO2(g)+H2(g) ΔH2=-41.0kJ·mol-1
③CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH3=-49.0kJ·mol-1
下列说法正确的是
A.反应①中的能量变化如图所示 |
| B.反应②使用催化剂,能降低该反应的活化能和ΔH2 |
| C.合成过程中应向原料气中添加H2 |
| D.CO(g)+2H2(g)===CH3OH(g) ΔH=-90.0kJ·mol-1 |
您最近一年使用:0次
2020-08-31更新
|
101次组卷
|
2卷引用:河南省商水县第二高中2020-2021学年高一下学期月考化学试题
2 . 依据图示关系,下列说法不正确的是
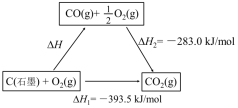

| A.石墨燃烧是放热反应 |
| B.1molC(石墨)和1molCO分别在足量O2中燃烧,全部转化为CO2,前者放热多 |
| C.C(石墨)+CO2(g)=2CO(g) ΔH=ΔH1-ΔH2 |
| D.化学反应的ΔH,只与反应体系的始态和终态有关,与反应途径无关 |
您最近一年使用:0次
2020-08-19更新
|
7649次组卷
|
53卷引用:北京市中国农业大学附属中学2020-2021学年高一下学期期中学业水平调研化学试题
北京市中国农业大学附属中学2020-2021学年高一下学期期中学业水平调研化学试题(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)热点7 化学能与热能-2021年高考化学【热点·重点·难点】专练(新高考)新疆维吾尔自治区巴州二中2021届高三第六次月考化学试题(已下线)课时29 盖斯定律及反应热计算-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)1.2 反应热的计算-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)(已下线)高中化学《新教材变化解读与考法剖析》第一章 化学反应的热效应(人教版2019选择性必修1)山东省济宁曲阜市第一中学2021-2022学年高二10月月考化学试题甘肃省张掖市第二中学2021-2022学年高二上学期10月月考(B班)化学试题甘肃省张掖市第二中学2021-2022学年高二上学期10月月考(A班)化学试题云南省玉溪市第二中学2021-2022学年高二上学期期中考试化学试题云南省玉溪市江川区第二中学2021-2022学年高二上学期期中考试化学试题北京师范大学附属中学2021-2022学年高二上学期期中考试化学试题福建省厦门市湖滨中学2021-2022学年高二上学期期中考试化学试题广东省大联考2021-2022学年高一下学期期中检测化学试题天津市静海区四校2021-2022学年高三上学期12月阶段性检测化学试题天津市南开区2021-2022学年高一下学期期末阶段性质量检测化学试题吉林省吉化第一高级中学校2021-2022学年高一下学期复课检测化学试题北京市第四中学顺义分校2021-2022学年高二上学期期中考试化学试题广东省广州真光中学2021-2022学年高二上学期期中考试化学试题2020年北京市高考化学试卷辽宁省辽阳市辽阳县集美中学2020-2021学年高二上学期第一次月考化学试题北京首都师范大学附属中学2020-2021学年高二上学期期中考试化学试题北京市一零一中学2020-2021学年高二上学期期中考试化学试题浙江省金丽衢十二校2021届高三上学期第一次联考化学试题(已下线)小题必刷24 盖斯定律及反应热计算——2021年高考化学一轮复习小题必刷(通用版)2020年北京高考化学真题变式题11-19(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)回归教材重难点05 化学反应中的能量变化-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)考点17 化学反应的热效应-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第24练 反应热-2023年高考化学一轮复习小题多维练(全国通用)北京市第七中学2022-2023学年高二上学期期中化学试题广东省广州大学附属中学2022-2023学年高二上学期期中考试化学试题(已下线)【2022】【高二上】【期中考】【高中化学】59(已下线)专题15 反应热计算的几种类型-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第六章 化学反应与能量 第34讲 反应热的计算(已下线)【2022】【高二化学】【期中考】-178(已下线)题型13 突破反应热图象(已下线)专题08 化学反应中的能量变化广东省广州市协和中学等3校2022-2023学年高二上学期(12月)期末考试化学试题作业(三) 反应热的计算(已下线)第2讲 盖斯定律 反应热的计算第一章 化学反应的热效应 第二节 反应热的计算宁夏回族自治区中宁县第一中学2022-2023学年高二上学期10月月考化学试题北京市八一学校2022-2023学年高二上学期期中考试化学试题北京汇文中学2023-2024学年高二上学期期中考试化学试题北京市第十一中学2022-2023学年高二上学期期中考试化学试卷北京市第一六一中学2023-2024学年高二上学期10月月考化学试题北京师范大学附属中学2023-2024学年高二上学期期末考试化学试卷
名校
解题方法
3 . 请参考题中图表,已知 E1=134 kJ·mol-1、E2=368 kJ·mol-1,根据要求回答问题:
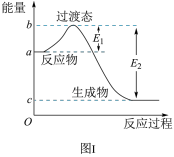
(1)图Ⅰ是 1mol NO2(g)和 1mol CO (g)反应生成 CO2(g)和 NO (g)过程中的能量变化示意图, 若在反应体系中加入催化剂,反应速率增大,E1的变化是______ (填“增大”、“减小”或“不变”, 下同),△H 的变化是 ______ 请写出 NO2和 CO 反应的热化学方程式: ______ 。
(2)将甲醇蒸汽转化为氢气的两种反应的热化学方程式如下:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H = +49.0 kJ·mol-1
②CH3OH(g)+ O2(g)=CO2(g)+2H2(g) △H = -192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g) △H = -192.9 kJ·mol-1
又知③H2O(g) ═ H2O(l) △H = -44 kJ·mol-1,写出表示甲醇蒸 汽燃烧热的热化学方程式为:______ 。

(1)图Ⅰ是 1mol NO2(g)和 1mol CO (g)反应生成 CO2(g)和 NO (g)过程中的能量变化示意图, 若在反应体系中加入催化剂,反应速率增大,E1的变化是
(2)将甲醇蒸汽转化为氢气的两种反应的热化学方程式如下:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H = +49.0 kJ·mol-1
②CH3OH(g)+
 O2(g)=CO2(g)+2H2(g) △H = -192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g) △H = -192.9 kJ·mol-1又知③H2O(g) ═ H2O(l) △H = -44 kJ·mol-1,写出表示甲醇蒸 汽燃烧热的热化学方程式为:
您最近一年使用:0次
2020-08-06更新
|
173次组卷
|
4卷引用:吉林省“BEST合作体”2020-2021学年高一下学期期中化学试题
12-13高二上·陕西·期中
名校
解题方法
4 . 已知热化学方程式:
① C2H2(g) + O2(g) = 2CO2(g)+H2O(l) ΔH1=-1301.0 kJ•mol-1
O2(g) = 2CO2(g)+H2O(l) ΔH1=-1301.0 kJ•mol-1
② C(s)+ O2(g) = CO2(g) △H2=-393.5 kJ•mol-1
③ H2(g)+ O2(g) = H2O(l) △H3 = -285.8 kJ·mol-1
O2(g) = H2O(l) △H3 = -285.8 kJ·mol-1
则反应④ 2C(s)+ H2(g) = C2H2(g)的△H为
① C2H2(g) +
 O2(g) = 2CO2(g)+H2O(l) ΔH1=-1301.0 kJ•mol-1
O2(g) = 2CO2(g)+H2O(l) ΔH1=-1301.0 kJ•mol-1② C(s)+ O2(g) = CO2(g) △H2=-393.5 kJ•mol-1
③ H2(g)+
 O2(g) = H2O(l) △H3 = -285.8 kJ·mol-1
O2(g) = H2O(l) △H3 = -285.8 kJ·mol-1则反应④ 2C(s)+ H2(g) = C2H2(g)的△H为
| A.+228.2 kJ·mol-1 | B.-228.2 kJ·mol-1 |
| C.+1301.0 kJ·mol-1 | D.+621.7 kJ·mol-1 |
您最近一年使用:0次
2020-05-31更新
|
642次组卷
|
29卷引用:广东省江门市第二中学2020-2021学年高一下学期第一次考试化学试题
广东省江门市第二中学2020-2021学年高一下学期第一次考试化学试题陕西省黄陵中学2016-2017学年高一(重点班)下学期期末考试化学试题安徽省滁州市明光中学2018-2019学年高一下学期期中考试化学试题云南省普洱市景东彝族自治县第一中学2019-2020学年高一下学期期中考试化学试题内蒙古乌兰察布市集宁一中2019-2020学年高一下学期期中考试化学试题江西省鹰潭市第一中学2019—2020学年高一下学期期末考试化学试题青海省西宁市海湖中学2020-2021学年高二下学期开学考试化学试题云南省水富县云天化中学2020-2021学年高二下学期期中考试化学试题内蒙古霍林郭勒市第一中学2021-2022学年高二上学期期中考试化学试题(已下线)2011-2012学年陕西师大附中高二年级第一学期期中考试化学试卷(已下线)2012-2013学年广东陆丰碣石中学高二第二次月考化学试卷(已下线)2015届黑龙江省牡丹江第一高中高二上学期期中考试化学(理)试卷河南省信阳市商城县高级中学2017-2018学年高二上学期第一次月考化学试题黑龙江省饶河县高级中学2017-2018学年高二上学期第一次月考化学试题宁夏吴忠中学2017-2018学年高二下学期开学考试化学试题西藏自治区日喀则市南木林高级中学2018-2019学年高二上学期期中考试化学试题高二人教版选修4 第一章 第三节 化学反应热的计算四川省北大附中成都为明学校2019-2020学年高二9月月考化学试题福建省漳平市第一中学2019-2020学年高二上学期第一次月考化学试题陕西省渭南市临渭区尚德中学2020届高三上学期第三次月考化学试题重庆市云阳县2019-2020学年高二上学期期中考试化学试题(已下线)1.1.3 反应焓变的计算 练习——【高中新教材同步备课】鲁科版高中化学选择性必修1青海省西宁市海湖中学2020-2021学年高二上学期第一阶段测试化学试题陕西省咸阳市实验中学2020-2021学年高二上学期第二次月考化学试题黑龙江省牡丹江市阳明区2022-2023学年高三上学期第四次阶段考试化学试题吉林市第二中学2022-2023学年高二上学期9月月考化学试题四川省成都市简阳市阳安中学2022-2023学年高二上学期期中考试化学试题甘肃省天水市秦安县第一中学2022-2023学年高二上学期期末考试化学试题广西南宁市西乡塘区南宁高新技术产业开发区桂鼎学校2022-2023学年高二上学期11月期中化学试题
名校
解题方法
5 . (1)在25 ℃、101 kPa的条件下,
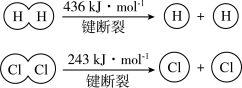
请回答下列有关问题:
①由H+H→H2,当生成1 mol H2时,要________ (填“吸收”或“放出”,下同)436 kJ的能量;由Cl2→Cl+Cl,当断裂1 mol Cl2中的共价键时,要________ 243 kJ的能量。
②对于反应H2(g)+Cl2(g)=2HCl(g),测得生成2 molHCl(g)时,反应过程中放出183 kJ的热量,则断开 1 mol H—Cl 键所需的能量是________ kJ。
③有两个反应:a.H2(g)+Cl2(g)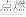 2HCl(g),b.H2(g)+Cl2(g)
2HCl(g),b.H2(g)+Cl2(g) 2HCl(g)。这两个反应中,相同物质的量的H2(g)、Cl2(g)反应生成相同质量的HCl(g)时,放出的能量
2HCl(g)。这两个反应中,相同物质的量的H2(g)、Cl2(g)反应生成相同质量的HCl(g)时,放出的能量________ (填“相等”或“不相等”)。
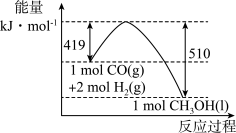
(2)根据图示的能量转化关系判断,生成16 g CH3OH(l)________ (填“吸收”或“放出”)________ kJ能量。

请回答下列有关问题:
①由H+H→H2,当生成1 mol H2时,要
②对于反应H2(g)+Cl2(g)=2HCl(g),测得生成2 molHCl(g)时,反应过程中放出183 kJ的热量,则断开 1 mol H—Cl 键所需的能量是
③有两个反应:a.H2(g)+Cl2(g)
 2HCl(g),b.H2(g)+Cl2(g)
2HCl(g),b.H2(g)+Cl2(g) 2HCl(g)。这两个反应中,相同物质的量的H2(g)、Cl2(g)反应生成相同质量的HCl(g)时,放出的能量
2HCl(g)。这两个反应中,相同物质的量的H2(g)、Cl2(g)反应生成相同质量的HCl(g)时,放出的能量
(2)根据图示的能量转化关系判断,生成16 g CH3OH(l)
您最近一年使用:0次
2020-04-15更新
|
761次组卷
|
5卷引用:河北省张家口宣化一中2020-2021学年高一下学期4月月考化学试题
11-12高二上·广东汕头·期中
6 . 根据碘与氢气反应的热化学方程式:
①I2(g)+H2(g) 2HI(g) △H=-9.48 k.J·mol-1
2HI(g) △H=-9.48 k.J·mol-1
②I2(s)+H2((g) 2HI(g)△H=+26.48k.J·mol-1
2HI(g)△H=+26.48k.J·mol-1
下列判断正确的是
①I2(g)+H2(g)
 2HI(g) △H=-9.48 k.J·mol-1
2HI(g) △H=-9.48 k.J·mol-1②I2(s)+H2((g)
 2HI(g)△H=+26.48k.J·mol-1
2HI(g)△H=+26.48k.J·mol-1下列判断正确的是
| A.254gI(g)中通入2gH2(g),反应放热9.48kJ |
| B.1mol固态碘与1mol气态碘所含的能量相差17.00kJ |
| C.反应②的反应物总能量比反应①的反应物总能量低 |
| D.反应①的生成物比反应②的生成物稳定 |
您最近一年使用:0次
2020-03-23更新
|
1612次组卷
|
61卷引用:黑龙江省鹤岗市第一中学2020-2021学年高一6月月考化学试题
黑龙江省鹤岗市第一中学2020-2021学年高一6月月考化学试题黑龙江省哈尔滨市第九中学校2020-2021学年高一下学期6月月考化学试题(已下线)2011-2012学年吉林省长春市十一高中高一下学期期末考试化学试卷2014-2015学年吉林省长春市十一中高一下期中化学试卷黑龙江省安达市第七中学2019-2020学年高一3月月考化学试题湖北省应城市第一高级中学2019-2020学年高一下学期复学摸底测试化学试题吉林省长春外国语学校2019-2020学年高一下学期期末考试化学(理)试题山西省忻州市第一中学2019-2020学年高一下学期开学考试化学试题吉林油田高级中学2019-2020学年高一下学期期末考试化学试题(已下线)1.1.2 热化学方程式 燃烧热-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)(已下线)2011-2012年广东省汕头市金山中学高二上学期期中考试化学试卷(理科)(已下线)2012届山东省济宁市重点中学高三上学期期中考试化学试卷(已下线)2011-2012学年天津一中高二上学期期中考试化学试卷(已下线)2012届陕西省兴平市秦岭中学高三上学期期末练习化学试卷(已下线)2011-2012学年浙江瑞安中学高二下学期期中考试化学试卷(已下线)2011-2012学年天津市天津一中高二上学期期中考试化学试卷(已下线)2012-2013学年福建省三明一中、二中高二上学期期末联考化学试卷(已下线)2013-2014学年河南省洛阳市高二上学期期末检测化学试卷(A)(已下线)2014年高二化学人教版选修四 4化学反应热的计算练习卷(已下线)2013-2014学年江苏省淮安市高中协作体高二下学期期中考试化学试卷(已下线)2015届安徽望江中学同步课时练(人教选修4)1.3化学反应热的计算(已下线)2015界山东省实验中学高三第一次9月诊断性考试化学试卷(已下线)2014-2015学年河北省唐山市开滦二中高二上学期第一次月考化学试卷2014-2015学年湖北省襄阳五中高二12月月考化学试卷2015届吉林省东北师大附中高三上学期第三次摸底化学试卷2014-2015江苏省扬州中学高二12月月考化学试题2015届上海市崇明县高三二模化学试卷2014-2015江苏省徐州市五县一区高二下学期期中考试化学试卷2015-2016学年河南洛阳高级中学高二上9月月考化学试卷2015-2016学年江西省樟树中学、高安二中高二上期中联考化学试卷2016届海南省万宁中学高三上学期第四次月考化学试卷2016届河南省豫南九校联盟高三下学期第一次联考化学试卷2015-2016学年福建省三明一中高二下第一次月考化学试卷2015-2016学年云南省开远四中高二下学期期中化学试卷(已下线)【百强校】2016-2017学年浙江省温州中学高二上期中化学卷(带解析)江西省抚州市临川区第一中学2017-2018学年高二上学期第一次月考化学试题云南省峨山彝族自治县第一中学2017-2018学年高二上学期11月考试化学试题北京市昌平区2017--2018学年度高三(上)期末化学试题2018-2019学年人教版高中化学选修四 章末综合测评1 化学反应与能量黑龙江省黑河市逊克县第一中学2018-2019学年高二上学期学期初考试化学试题湖南省醴陵市第二中学2018-2019学年高二上学期第一次月考化学试题【全国百强校】广西壮族自治区南宁市第三中学2018-2019学年高二上学期期末考试化学试题上海交通大学附属中学2019届高三第一学期期中考试化学试题浙江省台州市五校2020届高三10月联考化学试题安徽省青阳县第一中学2019-2020学年高二10月月考化学试题上海市南汇中学2019届高三下学期3月等级月考卷化学试题人教版选修四2019-2020学年高二上学期期末复习化学综合训练四川省蓬溪县蓬南中学2019-2020学年高二上学期第四次月考化学试题安徽省滁州市民办高中2019-2020学年高二上学期期末考试化学试题2020年春季人教版高中化学选修4第一章《化学反应与能量》测试卷2011年上海市高考化学试题河南省林州市林虑中学2019-2020学年高二3月线上考试化学试题云南省昆明市寻甸县民族中学2019-2020学年高二下学期第一次月考化学试题(已下线)1.1.2 化学反应的焓变 练习——【高中新教材同步备课】鲁科版高中化学选择性必修1湖南省娄底市第一中学2020-2021学年高二上学期开学考试化学试题河南省驻马店市正阳县高级中学2020-2021学年高二上学期第一次月考化学试题福建省永安市第一中学2020-2021学年高二上学期第一次月考化学试题(已下线)第1章能力提升测评卷-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)新疆塔城市第三中学2022-2023学年高二上学期第一次月考化学试题天津市耀华中学2023-2024学年高三上学期第二次月考化学试题上海南汇中学2023-2024学年高二上学期期中考试化学试题
13-14高一上·海南三亚·期中
名校
解题方法
7 . 已知下列反应的热化学方程式为
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1=-870.3kJ·mol-1
②C(s)+O2(g)=CO2(g) ΔH2=-393.5kJ·mol-1
③H2(g)+ O2(g)=H2O(l) ΔH3=-285.8kJ·mol-1
O2(g)=H2O(l) ΔH3=-285.8kJ·mol-1
则反应2C(s)+2H2(g)+O2(g)=CH3COOH(l)的ΔH为( )
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1=-870.3kJ·mol-1
②C(s)+O2(g)=CO2(g) ΔH2=-393.5kJ·mol-1
③H2(g)+
 O2(g)=H2O(l) ΔH3=-285.8kJ·mol-1
O2(g)=H2O(l) ΔH3=-285.8kJ·mol-1则反应2C(s)+2H2(g)+O2(g)=CH3COOH(l)的ΔH为( )
| A.-488.3kJ·mol-1 |
| B.-191kJ·mol-1 |
| C.-476.8kJ·mol-1 |
| D.-1549.6kJ·mol-1 |
您最近一年使用:0次
2020-03-14更新
|
363次组卷
|
20卷引用:四川省简阳市阳安中学2020-2021学年高一下学期半期考试化学试题
四川省简阳市阳安中学2020-2021学年高一下学期半期考试化学试题(已下线)2013-2014学年海南省三亚市一中高二上学期期中考试理科化学试卷陕西省咸阳市实验中学2020-2021学年高二下学期第三次月考化学试题内蒙古巴彦淖尔市乌拉特前旗第一中学2020-2021学年高二下学期期中考试化学试题福建省福州市闽侯县2016-2017学年高二下学期期末考试化学试题内蒙古巴彦淖尔市第一中学2017-2018学年高二9月月考化学试题B(已下线)2018年10月19日 《每日一题》人教选修4-盖斯定律及其应用云南省玉溪市元江县第一中学2018-2019学年高二下学期开学考试化学试题江苏省大丰市新丰中学2018-2019学年高二下学期期中考试化学试题黑龙江省鹤岗市第一中学2020届高三10月月考化学试题山东省济宁市微山县第二中学2019-2020学年高二10月月考化学试题云南省西双版纳傣族自治州勐腊县第一中学2019-2020学年高二上学期期末考试化学试题安徽省淮北市濉溪县2018-2019学年高二上学期期末考试化学试题天津市西青区2019-2020学年高二上学期期末考试化学试题甘肃省平凉市泾川市2019届高三模拟测试化学试题广东省阳春市第一中学2019-2020学年高二上学期第二次月考化学试题四川省泸州市泸县第五中学2021-2022学年高二下学期开学考试化学试题河南省中原名校2021-2022学年高二下学期第一次联考化学试题江西省宜春市上高二中2023-2024学年高二上学期第三次月考化学试题 江西省宜春市宜丰中学2023-2024学年高二下学期开学考试化学试题
8 . 通过以下反应均可获取H2。
① C(s) + H2O (g) =CO(g)+H2(g) ΔH1 = + 131.3 kJ·mol-1
② CH4 (g)+H2O(g) = CO(g)+3H2 (g) ΔH2 = + 206.1 kJ·mol-1
③ CO(g)+H2O(g) = CO2(g)+H2(g) ΔH3
下列说法正确的是
① C(s) + H2O (g) =CO(g)+H2(g) ΔH1 = + 131.3 kJ·mol-1
② CH4 (g)+H2O(g) = CO(g)+3H2 (g) ΔH2 = + 206.1 kJ·mol-1
③ CO(g)+H2O(g) = CO2(g)+H2(g) ΔH3
下列说法正确的是
| A.①中反应物的总能量大于生成物的总能量 |
| B.②中使用适当催化剂,可以使ΔH2减小 |
| C.由①、②计算反应CH4 (g) = C (s) + 2H2 (g) 的ΔH =-74.8 kJ·mol-1 |
| D.若知反应C (s) + CO2 (g) = 2CO (g) 的ΔH,结合ΔH1可计算出ΔH3 |
您最近一年使用:0次
2020-01-13更新
|
365次组卷
|
3卷引用:北京师范大学附属实验中学2020-2021学年高一下学期期中考试化学测试A卷
名校
解题方法
9 . 已知:①Zn(s)+ O2(g)=ZnO(s) ΔH=-348.3kJ·mol-1;②2Ag(s)+
O2(g)=ZnO(s) ΔH=-348.3kJ·mol-1;②2Ag(s)+ O2(g)=Ag2O(s) ΔH=-31.0kJ·mol-1则Zn与Ag2O反应生成ZnO和Ag的热化学方程式为( )
O2(g)=Ag2O(s) ΔH=-31.0kJ·mol-1则Zn与Ag2O反应生成ZnO和Ag的热化学方程式为( )
 O2(g)=ZnO(s) ΔH=-348.3kJ·mol-1;②2Ag(s)+
O2(g)=ZnO(s) ΔH=-348.3kJ·mol-1;②2Ag(s)+ O2(g)=Ag2O(s) ΔH=-31.0kJ·mol-1则Zn与Ag2O反应生成ZnO和Ag的热化学方程式为( )
O2(g)=Ag2O(s) ΔH=-31.0kJ·mol-1则Zn与Ag2O反应生成ZnO和Ag的热化学方程式为( )| A.Zn(s)+Ag2O(s)=ZnO(s)+2Ag(s) ΔH=+317.3kJ·mol-1 |
| B.Zn+Ag2O=ZnO+2Ag ΔH=+317.3kJ·mol-1 |
| C.Zn(s)+Ag2O(s)=ZnO(s)+2Ag(s) ΔH=-379.3kJ·mol-1 |
| D.2Zn(s)+2Ag2O(s)=2ZnO(s)+4Ag(s) ΔH=-634.6 kJ·mol-1 |
您最近一年使用:0次
2019-12-18更新
|
135次组卷
|
3卷引用:河北省衡水市第十四中学2020-2021学年高一下学期期末考试化学试题
名校
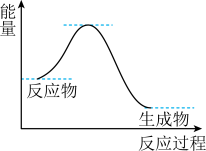
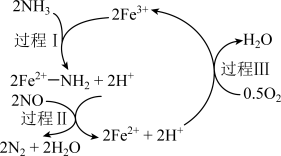
10 . NH3催化还原NO是重要的烟气脱硝技术,其反应过程与能量关系如左图;研究发现在以Fe2O3为主的催化剂上可能发生的反应过程如右图 下列说法正确的是
下列说法正确的是
 下列说法正确的是
下列说法正确的是

| A.NH3催化还原NO为吸热反应 |
| B.过程Ⅰ中NH3断裂离子键 |
| C.过程Ⅱ中NO为氧化剂,Fe2+为还原剂 |
D.脱硝的总反应为:4NH3(g)+4NO(g)+O2(g)  4N2(g)+6H2O(g) 4N2(g)+6H2O(g) |
您最近一年使用:0次
2019-11-04更新
|
313次组卷
|
2卷引用:广东省深圳市宝安中学高中部2020-2021学年高一下学期期中考试化学试卷



