名校
1 . 证据推理与模型认知是化学学科的核心素养之一。下列事实与相应定律或原理相符的
| A.常温常压下,1体积乙醇完全燃烧消耗3体积O2——阿伏加德罗定律 |
| B.向漂白液中加入少量稀硫酸能增强漂白液的漂白效果——元素周期律 |
| C.通过测量C、CO的燃烧热来间接计算2C(s)+O2(g)=2CO(g)的反应热——盖斯定律 |
| D.体积可变的密闭容器中加入等体积的H2和I2(g)发生反应,加压体系颜色加深——勒夏特列原理 |
您最近一年使用:0次
2021-04-29更新
|
360次组卷
|
3卷引用:衔接点20 物质的量在化学实验中的应用-2021年初升高化学无忧衔接
(已下线)衔接点20 物质的量在化学实验中的应用-2021年初升高化学无忧衔接广东省汕头市第一中学2020-2021学年高二上学期期末考试化学试题广东省信宜市第二中学2022-2023学年高二上学期11月月考化学试题
名校
2 . 在298 K、1.01×105 Pa下,将22 g CO2通入750 mL 1 mol·L-1 NaOH 溶液中充分反应,测得反应放出x kJ的热量。已知在该条件下,1 mol CO2通入1 L 2 mol·L-1 NaOH溶液中充分反应放出y kJ的热量,则CO2与NaOH溶液反应生成NaHCO3的热化学方程式正确的是
| A.CO2(g)+NaOH(aq)=NaHCO3(aq) ΔH=-(2y-x) kJ·mol-1 |
| B.CO2(g)+NaOH(aq)=NaHCO3(aq) ΔH=-(2x-y) kJ·mol-1 |
| C.CO2(g)+NaOH(aq)=NaHCO3(aq) ΔH=-(4x-y) kJ·mol-1 |
| D.CO2(g)+2NaOH(l)=2NaHCO3(l) ΔH=-(8x-2y) kJ·mol-1 |
您最近一年使用:0次
2021-04-24更新
|
158次组卷
|
2卷引用:浙江省舟山市2020-2021学年高一上学期期末考试化学试题
名校
3 . 已知25℃、101kPa时,以下反应的热化学方程式为:
Fe2O3(s)+3C(s)=2Fe(s)+3CO(g)ΔH1=+489kJ·mol-1
2CO(g)+O2(g)=2CO2(g)ΔH2=-564kJ·mol-1
C(s)+O2(g)=CO2(g)ΔH3=-393kJ·mol-1
则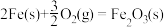 的ΔH为
的ΔH为
Fe2O3(s)+3C(s)=2Fe(s)+3CO(g)ΔH1=+489kJ·mol-1
2CO(g)+O2(g)=2CO2(g)ΔH2=-564kJ·mol-1
C(s)+O2(g)=CO2(g)ΔH3=-393kJ·mol-1
则
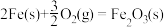 的ΔH为
的ΔH为| A.-822kJ·mol-1 | B.-468kJ·mol-1 | C.-186kJ·mol-1 | D.+468kJ·mol-1 |
您最近一年使用:0次
2021-04-23更新
|
1021次组卷
|
11卷引用:黑龙江省大庆市铁人中学2020-2021学年高一下学期期中考试化学试题
黑龙江省大庆市铁人中学2020-2021学年高一下学期期中考试化学试题河北省2021届高三普通高中学业水平选择性模拟考试化学试题第34届(2021年)高中化学奥林匹克竞赛浙江省预赛试题(已下线)课时29 盖斯定律及反应热计算-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(全国通用)黑龙江省佳木斯市建三江第一中学2021-2022学年高一下学期期末测试化学试题(已下线)专题09 化学反应的热效应-2023年高考化学一轮复习小题多维练(全国通用)(已下线)专题09 化学反应的热效应-2023年高考化学一轮复习小题多维练(全国通用)黑龙江省双鸭山市第一中学2023-2024学年高二上学期开学考试化学试题湖北省武汉市第四十九中学2023-2024学年高二上学期10月月考化学试题(已下线)寒假作业01 化学反应的热效应-【寒假分层作业】2024年高二化学寒假培优练(人教版2019)
名校
解题方法
4 . 工业上在一定条件下可由水煤气合成甲醇,同时有副反应,反应如下:
主反应: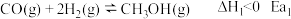
副反应: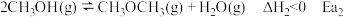
已知: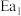 和
和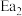 为正反应活化能,且
为正反应活化能,且 。
。
请回答:
(1)有利于主反应平衡正向移动的适宜条件___________ 。
A.高温高压 B.低温高压 C.高温低压 D.低温低压
(2)反应: 的
的
___________ (用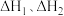 表示)
表示)
(3)若主反应在恒温恒容下进行,下列说法正确的是___________
A.当容器压强不变,反应处于平衡状态
B.K值越大,反应速率一定越快
C. 越小,放热越多,反应速率就越快
越小,放热越多,反应速率就越快
D.使用合适催化剂,可快速提高反应平衡前的转化率
E.正反应活化能越大, 就越大
就越大
(4)在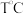 时,
时, 和
和 在体积为
在体积为 的恒温密闭容器中反应,测得2小时和5小时
的恒温密闭容器中反应,测得2小时和5小时 的选择性为80%和60%(
的选择性为80%和60%( 的选择性是指转化的
的选择性是指转化的 中生成
中生成 的百分比)。
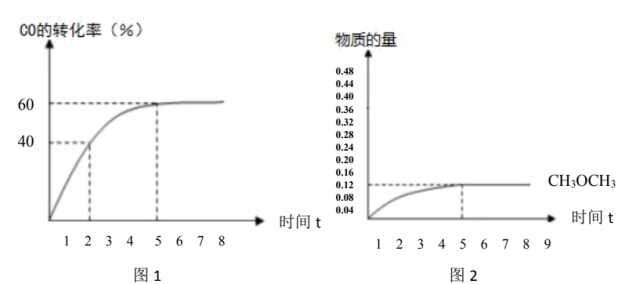
的百分比)。 的转化率与时间的关系如图1所示:(不考虑其它副反应)
的转化率与时间的关系如图1所示:(不考虑其它副反应)
则:①2小时 的产率
的产率___________ 。
②副反应的平衡常数___________ 。
(5) 的物质的量随时间变化如图2所示,请在图2上画出
的物质的量随时间变化如图2所示,请在图2上画出 的物质的量随时间变化曲线
的物质的量随时间变化曲线___________ 。
主反应:
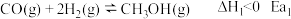
副反应:
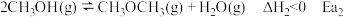
已知:
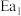 和
和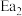 为正反应活化能,且
为正反应活化能,且 。
。请回答:
(1)有利于主反应平衡正向移动的适宜条件
A.高温高压 B.低温高压 C.高温低压 D.低温低压
(2)反应:
 的
的
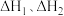 表示)
表示)(3)若主反应在恒温恒容下进行,下列说法正确的是
A.当容器压强不变,反应处于平衡状态
B.K值越大,反应速率一定越快
C.
 越小,放热越多,反应速率就越快
越小,放热越多,反应速率就越快D.使用合适催化剂,可快速提高反应平衡前的转化率
E.正反应活化能越大,
 就越大
就越大(4)在
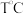 时,
时, 和
和 在体积为
在体积为 的恒温密闭容器中反应,测得2小时和5小时
的恒温密闭容器中反应,测得2小时和5小时 的选择性为80%和60%(
的选择性为80%和60%( 的选择性是指转化的
的选择性是指转化的 中生成
中生成 的百分比)。
的百分比)。 的转化率与时间的关系如图1所示:(不考虑其它副反应)
的转化率与时间的关系如图1所示:(不考虑其它副反应)则:①2小时
 的产率
的产率②副反应的平衡常数

(5)
 的物质的量随时间变化如图2所示,请在图2上画出
的物质的量随时间变化如图2所示,请在图2上画出 的物质的量随时间变化曲线
的物质的量随时间变化曲线
您最近一年使用:0次
2021-04-14更新
|
209次组卷
|
2卷引用:浙江省绍兴市诸暨中学2020-2021学年高一下学期4月期中考试(实验班)化学试题
5 . 雾霾已经成为部分城市发展的障碍。雾霾形成的最主要原因是人为排放,其中汽车尾气污染对雾霾的“贡献”逐年增加。回答下列问题:
(1)汽车尾气中含有NO,N2与O2生成NO的过程如下:

①1molO2与1molN2的总能量比2molNO的总能量___________ (填“高”或“低”)。
②N2(g)+O2(g)=2NO(g)的∆H=___________ kJ∙mol-1。
③NO与CO反应的热化学方程式可以表示为2NO(g)+2CO(g)⇌2CO2(g)+N2(g)∆H=akJ∙mol-1,但该反应速率很慢,若使用机动车尾气催化转化器,可以使尾气中的NO与CO转化成无害物质排出。上述反应在使用“催化转化器”后,a值___________ (选填“增大”“减小”或“不变”)。
(2)氢能源是绿色燃料,可以减少汽车尾气的排放,利用甲醇与水蒸气反应可以制备氢气:CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ∆H1,如图是该反应的能量变化图:
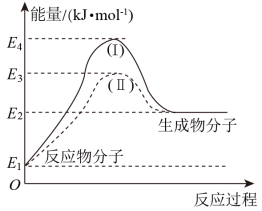
①通过图中信息可判断反应CH3OH(g)+H2O(g)=CO2(g)+3H2(g)的∆H1___________ (选填“>”“=”或“<”)0
②图中途径(Ⅱ)使用了催化剂。则途径(Ⅱ)的活化能___________ (选填“>”“=”或“<”)途径(Ⅰ)的活化能。
③已知下列两个热化学方程式:2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g) ∆H2
H2(g)+ O2(g)=H2O(g) ∆H3
O2(g)=H2O(g) ∆H3
则∆H2=___________ (用∆H1和∆H3的代数式表达)
(1)汽车尾气中含有NO,N2与O2生成NO的过程如下:

①1molO2与1molN2的总能量比2molNO的总能量
②N2(g)+O2(g)=2NO(g)的∆H=
③NO与CO反应的热化学方程式可以表示为2NO(g)+2CO(g)⇌2CO2(g)+N2(g)∆H=akJ∙mol-1,但该反应速率很慢,若使用机动车尾气催化转化器,可以使尾气中的NO与CO转化成无害物质排出。上述反应在使用“催化转化器”后,a值
(2)氢能源是绿色燃料,可以减少汽车尾气的排放,利用甲醇与水蒸气反应可以制备氢气:CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ∆H1,如图是该反应的能量变化图:

①通过图中信息可判断反应CH3OH(g)+H2O(g)=CO2(g)+3H2(g)的∆H1
②图中途径(Ⅱ)使用了催化剂。则途径(Ⅱ)的活化能
③已知下列两个热化学方程式:2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g) ∆H2
H2(g)+
 O2(g)=H2O(g) ∆H3
O2(g)=H2O(g) ∆H3则∆H2=
您最近一年使用:0次
2021-04-02更新
|
228次组卷
|
3卷引用:四川省阆中中学校2020-2021学年高一(仁智班)下学期第一次月考化学试题
四川省阆中中学校2020-2021学年高一(仁智班)下学期第一次月考化学试题湖南省娄底市新化县2021-2022学年高二上学期期末考试化学试题(已下线)专题03 化学反应速率及影响因素、活化能【考点清单】(讲+练)-2023-2024学年高二化学期中考点大串讲(人教版2019选择性必修1)
名校
解题方法
6 . 已知以下的热化学反应方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)ΔH=-24.8kJ·mol-1
②Fe2O3(s)+ CO(g)=
CO(g)= Fe3O4(s)+
Fe3O4(s)+ CO2(g)ΔH=-15.73kJ·mol-1
CO2(g)ΔH=-15.73kJ·mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)ΔH=+640.4kJ·mol-1
则28gCO气体还原足量FeO固体得到Fe固体和CO2气体时对应的ΔH约为
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)ΔH=-24.8kJ·mol-1
②Fe2O3(s)+
 CO(g)=
CO(g)= Fe3O4(s)+
Fe3O4(s)+ CO2(g)ΔH=-15.73kJ·mol-1
CO2(g)ΔH=-15.73kJ·mol-1③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)ΔH=+640.4kJ·mol-1
则28gCO气体还原足量FeO固体得到Fe固体和CO2气体时对应的ΔH约为
| A.+218kJ·mol-1 | B.-109kJ·mol-1 | C.-218kJ·mol-1 | D.+109kJ·mol-1 |
您最近一年使用:0次
2021-04-02更新
|
187次组卷
|
2卷引用:四川省阆中中学校2020-2021学年高一(仁智班)下学期第一次月考化学试题
名校
解题方法
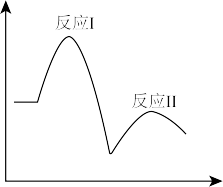
7 . 已知完全分解1molH2O2放出热量为98kJ,在含有少量I-的溶液中H2O2分解的机理为
反应Ⅰ:H2O2(aq)+I-(aq) IO-(aq)+H2O(l) △H1
IO-(aq)+H2O(l) △H1
反应Ⅱ:H2O2(aq)+IO-(aq) O2(g)+I-(aq)+H2O(l) △H2
O2(g)+I-(aq)+H2O(l) △H2
在一定温度下,其反应过程能量变化如图所示,下列有关该反应的说法不正确的是
反应Ⅰ:H2O2(aq)+I-(aq)
 IO-(aq)+H2O(l) △H1
IO-(aq)+H2O(l) △H1反应Ⅱ:H2O2(aq)+IO-(aq)
 O2(g)+I-(aq)+H2O(l) △H2
O2(g)+I-(aq)+H2O(l) △H2在一定温度下,其反应过程能量变化如图所示,下列有关该反应的说法不正确的是

| A.反应Ⅱ高温下能自发进行 |
| B.H2O2分解产生氧气的速率是由反应I决定的 |
| C.I-、IO-都是催化剂 |
| D.△H1+△H2=-196kJ•mol-1 |
您最近一年使用:0次
2021-03-16更新
|
940次组卷
|
12卷引用:辽宁省沈阳市郊联体2020-2021学期高一下学期期中考试化学试题
辽宁省沈阳市郊联体2020-2021学期高一下学期期中考试化学试题浙江省2021届高三下学期3月联考化学试题(已下线)浙江省“超级全能生”2021年3月高考选考科目联考化学试题(已下线)押山东卷第14题 化学反应速率和平衡-备战2021年高考化学临考题号押题(山东卷)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(浙江专用)广东省广州中学2021-2022学年高二上学期期中考试化学试题广东省揭阳市榕城区仙桥中学2021-2022学年高二下学期期中考试化学试题云南省昆明市第一中学2021-2022学年高二下学期期中考试化学试题浙江省温州新力量联盟2022-2023学年高二 上学期期中联考化学试题广东省广州市东涌中学2022-2023学年高二上学期期中考试化学试题广东省深圳市富源学校2023-2024学年高二上学期11月期中化学试题
8 . 反应2H2(g)+O2(g)=2H2O(1) ΔH=-571.6 kJ·mol-1 过程中的能量变化关系如图。下列说法错误的是

| A.ΔH1>△H2 |
| B.ΔH1+ΔH2+ΔH3=ΔH4=-571.6kJ·mol-1 |
C.2mol水蒸气转化为液态水能够释放出的能量为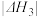 kJ kJ |
| D.若将上述反应设计成原电池,则当氢失4mol电子时能够产生571.6kJ的电能 |
您最近一年使用:0次
2021-03-14更新
|
496次组卷
|
6卷引用:辽宁省大连市一0三中学2020-2021学年高一4月月考化学试题
辽宁省大连市一0三中学2020-2021学年高一4月月考化学试题福建省福州市2021届高考3月毕业班质量检测(一模)化学试题(已下线)押山东卷第07题 化学反应与能量-备战2021年高考化学临考题号押题(山东卷)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(浙江专用)云南省大理州实验中学2021-2022学年高二上学期化学期末考试题
名校
解题方法
9 . 硫酰氯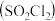 是一种重要的磺化试剂,其可利用
是一种重要的磺化试剂,其可利用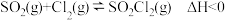 制备。
制备。 时,该反应的压强平衡常数
时,该反应的压强平衡常数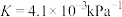 ,在恒温恒容的容器中发生反应,下列说法正确的是
,在恒温恒容的容器中发生反应,下列说法正确的是
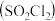 是一种重要的磺化试剂,其可利用
是一种重要的磺化试剂,其可利用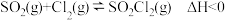 制备。
制备。 时,该反应的压强平衡常数
时,该反应的压强平衡常数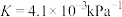 ,在恒温恒容的容器中发生反应,下列说法正确的是
,在恒温恒容的容器中发生反应,下列说法正确的是A.已知硫酰氯结构式为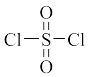 ,硫酰氯每个原子均达到8电子稳定结构 ,硫酰氯每个原子均达到8电子稳定结构 |
| B.容器内气体的平均摩尔质量不变时,反应达到平衡 |
| C.温度升高,平衡逆向移动,反应的压强平衡常数增大 |
| D.上述制备硫酰氯的反应,在高温下自发 |
您最近一年使用:0次
2021-03-10更新
|
531次组卷
|
7卷引用:甘肃省礼县第一中学2020-2021学年高一上学期期中测试化学试题
甘肃省礼县第一中学2020-2021学年高一上学期期中测试化学试题河北省“五个一名校联盟”(张家口一中、唐山一中、保定一中、邯郸一中、邢台一中)2021届高三第二次模拟考试化学试题河南省鹤壁市高中2020-2021学年高二下学期第三次段考化学试题(已下线)考点18 化学平衡状态 化学平衡移动-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点18 化学平衡状态 化学平衡移动-备战2022年高考化学一轮复习考点帮(浙江专用)河北省石家庄市第二中学2021-2022学年高三上学期10月第二次考试化学试题(已下线)专题10 化学反应速率与平衡-2023年高考化学一轮复习小题多维练(全国通用)
10 . H2与ICl的反应分①、②两步进行,其能量曲线如图所示,下列有关说法错误的是
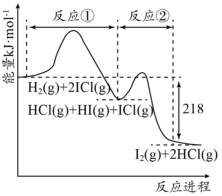

| A.反应①、反应②均为放热反应 |
| B.反应①、反应②均为氧化还原反应 |
| C.H2与ICl的总反应速率快慢取决于反应② |
| D.反应H2(g)+2ICl(g)=I2(g)+2HCl(g)的ΔH=-218kJ·mol-1 |
您最近一年使用:0次
2021-01-29更新
|
787次组卷
|
3卷引用:山东省日照市莒县2020-2021学年高一下学期期中考试化学试题



