名校
1 . 下列说法正确的是
| A.1 mol H2的质量只有在标准状况下才为2 g |
| B.标准状况下,1 mol水蒸气的体积大约为22.4 L |
| C.273 ℃、1.01×105 Pa状态下,1 mol气体体积大于22.4 L |
| D.0.5 mol O2和0.5 mol N2组成的混合气体体积约为22.4 L |
您最近一年使用:0次
2018-10-19更新
|
202次组卷
|
6卷引用:河南省正阳县高级中学2020-2021学年高一上学期第一次月考化学试题
名校
2 . 已知:①2H2O(g)===2H2(g)+O2(g) ΔH=+483.6 kJ·mol-1 ②H2S(g)===H2(g)+S(g) ΔH=+20.1 kJ·mol-1下列判断正确的是( )
| A.氢气的燃烧热:ΔH=-241.8 kJ·mol-1 |
| B.相同条件下,充分燃烧1 mol H2(g)与1 mol S(g)的混合物比充分燃烧1 mol H2S(g)放热多20.1 kJ |
| C.由①②知,水的热稳定性小于硫化氢 |
| D.②中若生成固态硫,ΔH将增大 |
您最近一年使用:0次
2018-10-19更新
|
390次组卷
|
12卷引用:湖南省长沙市第一中学2020-2021学年高一下学期期末考试化学试题
湖南省长沙市第一中学2020-2021学年高一下学期期末考试化学试题2016届内蒙古赤峰市高三上学期期末考试化学试卷福建省泉州市泉港区第一中学2017-2018学年高二上学期期中考试化学试题【全国百强校】甘肃省会宁县第一中学2018-2019学年高二上学期第一次月考化学试题山东省济宁市第二中学2019-2020学年高二上学期第一次月考化学试题吉林省长春市第一五〇中学2019-2020学年高二上学期期中考试化学试卷安徽省滁州市定远县民族中学2019-2020学年高二上学期期中考试化学试题安徽省滁州市定远县炉桥中学2019-2020学年高二上学期第一次检测化学试题吉林公主岭范家屯一中2020-2021学年高二上学期期中考试化学试题(已下线)1.3 燃料的合理利用-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)(已下线)1.3 燃料的合理利用-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)辽宁省六校2022-2023学年高二上学期期初考试化学试题
名校
3 . 在同温同压下,下列各组热化学方程式中, △H1<△H2的是
A.C(s)+O2(g)===CO2(g) ΔH1 C(s)+ O2(g)===CO(g) ΔH2 O2(g)===CO(g) ΔH2 |
| B.S(s)+O2(g)===SO2(g) ΔH1 S(g)+O2(g)===SO2(g) ΔH2 |
C.H2(g)+ O2(g)===H2O(l) ΔH1 2H2(g)+O2(g)===2H2O(l) ΔH2 O2(g)===H2O(l) ΔH1 2H2(g)+O2(g)===2H2O(l) ΔH2 |
| D.CaCO3(s)===CaO(s)+CO2(g) ΔH1 CaO(s)+H2O(l)===Ca(OH)2 ΔH2 |
您最近一年使用:0次
2018-07-14更新
|
226次组卷
|
4卷引用:吉林省“BEST合作体”2020-2021学年高一下学期期中化学试题
名校
4 . 甲醇水蒸气重整制氢(SRM)系统简单,产物中H2 含量高、CO含量低(CO会损坏燃料电池的交换膜),是电动汽车氢氧燃料电池理想的氢源。反应如下:
反应Ⅰ(主) :CH3OH(g)+ H2O(g) CO2(g)+ 3H2(g) ΔH1=+49kJ/mol
CO2(g)+ 3H2(g) ΔH1=+49kJ/mol
反应Ⅱ(副) :H2(g)+ CO2(g) CO(g)+ H2O(g) ΔH2=+41kJ/mol
CO(g)+ H2O(g) ΔH2=+41kJ/mol
温度高于300℃则会同时发生反应Ⅲ: CH3OH(g) CO(g)+2H2(g) ΔH3
CO(g)+2H2(g) ΔH3
(1)计算反应Ⅲ的ΔH3=_________ 。
(2)反应1能够自发进行的原因是_______________ ,升温有利于提高CH3OH转化率,但也存在一个明显的缺点是__________ 。
(3)右图为某催化剂条件下,CH3OH转化率、CO生成率与温度的变化关系。

①随着温度的升高,CO的实际反应生成率没有不断接近平衡状态生成率的原因是____________ (填标号)。
A.反应Ⅱ逆向移动
B.部分CO 转化为CH3OH
C.催化剂对反应Ⅱ的选择性低
D.催化剂对反应Ⅲ的选择性低
②随着温度的升高,CH3OH 实际反应转化率不断接近平衡状态转化率的原因是______ 。
③写出一条能提高CH3OH转化率而降低CO生成率的措施_________ 。
(4)250℃,一定压强和催化剂条件下,1.00molCH3OH 和1.32molH2O 充分反应(已知此条件下可忽略反应Ⅲ ),平衡时测得H2为2.70mol,CO有0.030mol,试求反应Ⅰ中CH3OH 的转化率_________ ,反应Ⅱ的平衡常数_________ (结果保留两位有效数字)
反应Ⅰ(主) :CH3OH(g)+ H2O(g)
 CO2(g)+ 3H2(g) ΔH1=+49kJ/mol
CO2(g)+ 3H2(g) ΔH1=+49kJ/mol反应Ⅱ(副) :H2(g)+ CO2(g)
 CO(g)+ H2O(g) ΔH2=+41kJ/mol
CO(g)+ H2O(g) ΔH2=+41kJ/mol温度高于300℃则会同时发生反应Ⅲ: CH3OH(g)
 CO(g)+2H2(g) ΔH3
CO(g)+2H2(g) ΔH3(1)计算反应Ⅲ的ΔH3=
(2)反应1能够自发进行的原因是
(3)右图为某催化剂条件下,CH3OH转化率、CO生成率与温度的变化关系。

①随着温度的升高,CO的实际反应生成率没有不断接近平衡状态生成率的原因是
A.反应Ⅱ逆向移动
B.部分CO 转化为CH3OH
C.催化剂对反应Ⅱ的选择性低
D.催化剂对反应Ⅲ的选择性低
②随着温度的升高,CH3OH 实际反应转化率不断接近平衡状态转化率的原因是
③写出一条能提高CH3OH转化率而降低CO生成率的措施
(4)250℃,一定压强和催化剂条件下,1.00molCH3OH 和1.32molH2O 充分反应(已知此条件下可忽略反应Ⅲ ),平衡时测得H2为2.70mol,CO有0.030mol,试求反应Ⅰ中CH3OH 的转化率
您最近一年使用:0次
2018-01-19更新
|
2036次组卷
|
10卷引用:辽宁省沈阳市实验中学2021-2022学年高一上学期10月月考化学试题
辽宁省沈阳市实验中学2021-2022学年高一上学期10月月考化学试题(已下线)【浙江新东方】高中化学20210513-044【2021】【高二下】2021年天津高考化学试题变式题13-16广东省佛山市普通高中2018届高三教学质量检测(一)化学试题河北省衡水中学2018届高三第十五次模拟理科综合化学试题【全国百强校】河南省林州市第一中学2017-2018学年高二5月月考化学试题【全国百强校】河南省信阳高级中学2018届高三第四次模拟考试化学试题山西省大同市第二中学2020届高三3月月考理综化学试题甘肃省兰州市第一中学2020-2021学年高二上学期期中考试化学(理)试题2020届高三化学二轮冲刺新题专练——化学反应原理综合题
5 . 常温下,已知:铝热反应放热,①4Al(s)+3O2(g)=2Al2O3(s) ∆H1②4Fe(s)+3O2(g)=2Fe2O3(s) ∆H2 下面关于 ∆H1、∆H2 的比较正确的是
| A.∆H1<∆H2 | B.∆H1=∆H2 | C.∆H1>∆H2 | D.无法判断 |
您最近一年使用:0次
2017-12-30更新
|
327次组卷
|
9卷引用:河北省安平中学2020-2021学年高一下学期第四次月考(期末)化学试题
河北省安平中学2020-2021学年高一下学期第四次月考(期末)化学试题(已下线)2014届辽宁省实验中学分校高一下学期阶段性测试化学试卷 (已下线)2012-2013学年福建龙岩一中高二上第一学段模块考试化学试卷(已下线)2014年高中化学人教版选修四第一章 化学反应与能量练习卷2015-2016学年重庆市杨家坪中学高二上学期第一次月考化学试卷2016-2017学年云南省曲靖一中高二上期中化学试卷江西省抚州市临川实验学校2017-2018学年高二上学期第一次月考化学试题河南省南阳市省示范性高中联谊学校2017-2018学年高二上学期第二次月考化学试题内蒙古翁牛特旗乌丹第二中学2019-2020学年高二上学期期中考试化学试题
名校
6 . 已知白磷和P4O6的分子结构如图所示,又知化学键的键能是形成(或断开)1 mol化学键时释放(或吸收)的能量,现查知P—P键能为198 kJ·mol-1、P—O键能为360 kJ·mol-1、O=O键能为498 kJ·mol-1。若生成1 mol P4O6,则反应P4(白磷)+3O2=P4O6中的能量变化为


| A.吸收1 638 kJ能量 | B.放出1 638 kJ能量 |
| C.吸收126 kJ能量 | D.放出126 kJ能量 |
您最近一年使用:0次
2017-12-22更新
|
1309次组卷
|
10卷引用:广西玉林市直六所普通高中2020-2021学年高一下学期期中联合考试化学试题
广西玉林市直六所普通高中2020-2021学年高一下学期期中联合考试化学试题河北省枣强中学2017-2018学年高一下学期第一次月考化学试题河北省邢台市第二中学2017-2018学年高一下学期第一次月考化学试题吉林省扶余市第一中学2017-2018学年高一下学期期末考试化学试题甘肃省岷县第一中学2018-2019学年高一下学期第一次月考化学试题人教版高中化学必修2第二章《化学反应与能量》测试卷2黑龙江省安达市第七中学2019-2020学年高一3月月考化学试题山西省忻州市第一中学2019-2020学年高一下学期开学考试化学试题云南省峨山彝族自治县第一中学2017-2018学年高二上学期期末市统测模拟考化学试题云南省屏边县民族高级中学2019-2020学年高二上学期开学考试化学试题
名校
7 . 1 L 0.5 mol·L-1 H2SO4溶液与足量Ba(OH)2稀溶液反应放出a kJ热量;1 L 0.5 mol·L-1 HCl溶液与足量NaOH稀溶液充分反应放出b kJ热量;则500 mL 0.4 mol·L-1 BaCl2溶液与足量稀硫酸反应放出的热量为( )
| A.0.4(a+2b) kJ | B.0.4(a-2b) kJ |
| C.0.2(a-2b) kJ | D.0.2(a+2b) kJ |
您最近一年使用:0次
2017-06-24更新
|
196次组卷
|
5卷引用:黑龙江省哈尔滨市哈师大附中2020-2021学年高一下学期期中考试化学试题
8 . 煤的气化可以减少环境污染,而且生成的CO和H2被称作合成气,能合成很多基础有机化工原料。
(1)工业上可利用CO生产乙醇:2CO(g)+4H2(g) CH3CH2OH(g)+H2O(g) ΔH1
CH3CH2OH(g)+H2O(g) ΔH1
又知:H2O(l)=H2O(g) ΔH2
CO(g)+H2O(g) CO2(g)+H2(g) ΔH3
CO2(g)+H2(g) ΔH3
工业上也可利用CO2(g)与H2(g)为原料合成乙醇:
2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(l)ΔH
CH3CH2OH(g)+3H2O(l)ΔH
则ΔH与ΔH1、ΔH2、ΔH3之间的关系是ΔH=____________ 。
(2)一定条件下,H2、CO在体积固定的绝热密闭容器中发生如下反应:4H2(g)+2CO(g) CH3OCH3(g)+H2O(g),下列选项不能判断该反应达到平衡状态的是
CH3OCH3(g)+H2O(g),下列选项不能判断该反应达到平衡状态的是__________ 。
A.v(H2)正=2v(CO)逆 B.平衡常数K不再随时间而变化
C.混合气体的密度保持不变 D.CH3OCH3和H2O的体积之比不随时间而变化
(3)工业可采用CO与H2反应合成再生能源甲醇,反应:CO(g)+2H2(g) CH3OH(g),在一容积可变的密闭容器中充有10 mol CO和20 mol H2,在催化剂作用下发生反应生成甲醇,CO的平衡转化率(α)与温度(T)、压强(p)的关系如图1所示。
CH3OH(g),在一容积可变的密闭容器中充有10 mol CO和20 mol H2,在催化剂作用下发生反应生成甲醇,CO的平衡转化率(α)与温度(T)、压强(p)的关系如图1所示。
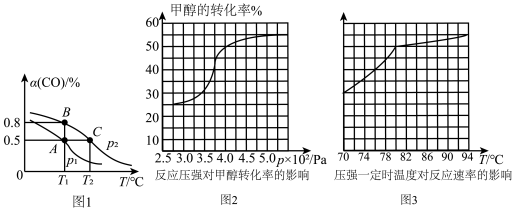
①合成甲醇的反应为______________ (填“放热”或“吸热”)反应。
②A、B、C三点的平衡常数KA、KB、KC的大小关系为____________________ 。p1和p2的大小关系为___________ 。
③若达到平衡状态A时,容器的体积为10 L,则在平衡状态B时容器的体积为________ L。
(4)工业上可通过甲醇羰基化法制取甲酸甲酯,其反应的热化学方程式为CH3OH(g)+CO(g) HCOOCH3(g) ΔH2="-29.1" kJ·mol-1。科研人员对该反应进行了研究,部分研究结果如图2、3:
HCOOCH3(g) ΔH2="-29.1" kJ·mol-1。科研人员对该反应进行了研究,部分研究结果如图2、3:
①从反应压强对甲醇转化率的影响“效率”看,工业制取甲酸甲酯应选择的压强是________ (填“3.5×106Pa”“4.0×106Pa”或“5.0×106Pa”)。
②实际工业生产中采用的温度是80℃,其理由是___________________ 。
(1)工业上可利用CO生产乙醇:2CO(g)+4H2(g)
 CH3CH2OH(g)+H2O(g) ΔH1
CH3CH2OH(g)+H2O(g) ΔH1又知:H2O(l)=H2O(g) ΔH2
CO(g)+H2O(g)
 CO2(g)+H2(g) ΔH3
CO2(g)+H2(g) ΔH3工业上也可利用CO2(g)与H2(g)为原料合成乙醇:
2CO2(g)+6H2(g)
 CH3CH2OH(g)+3H2O(l)ΔH
CH3CH2OH(g)+3H2O(l)ΔH则ΔH与ΔH1、ΔH2、ΔH3之间的关系是ΔH=
(2)一定条件下,H2、CO在体积固定的绝热密闭容器中发生如下反应:4H2(g)+2CO(g)
 CH3OCH3(g)+H2O(g),下列选项不能判断该反应达到平衡状态的是
CH3OCH3(g)+H2O(g),下列选项不能判断该反应达到平衡状态的是A.v(H2)正=2v(CO)逆 B.平衡常数K不再随时间而变化
C.混合气体的密度保持不变 D.CH3OCH3和H2O的体积之比不随时间而变化
(3)工业可采用CO与H2反应合成再生能源甲醇,反应:CO(g)+2H2(g)
 CH3OH(g),在一容积可变的密闭容器中充有10 mol CO和20 mol H2,在催化剂作用下发生反应生成甲醇,CO的平衡转化率(α)与温度(T)、压强(p)的关系如图1所示。
CH3OH(g),在一容积可变的密闭容器中充有10 mol CO和20 mol H2,在催化剂作用下发生反应生成甲醇,CO的平衡转化率(α)与温度(T)、压强(p)的关系如图1所示。
①合成甲醇的反应为
②A、B、C三点的平衡常数KA、KB、KC的大小关系为
③若达到平衡状态A时,容器的体积为10 L,则在平衡状态B时容器的体积为
(4)工业上可通过甲醇羰基化法制取甲酸甲酯,其反应的热化学方程式为CH3OH(g)+CO(g)
 HCOOCH3(g) ΔH2="-29.1" kJ·mol-1。科研人员对该反应进行了研究,部分研究结果如图2、3:
HCOOCH3(g) ΔH2="-29.1" kJ·mol-1。科研人员对该反应进行了研究,部分研究结果如图2、3:①从反应压强对甲醇转化率的影响“效率”看,工业制取甲酸甲酯应选择的压强是
②实际工业生产中采用的温度是80℃,其理由是
您最近一年使用:0次
2017-02-17更新
|
656次组卷
|
2卷引用:江西省高安中学2020-2021学年高一上学期第一次月考(A)化学试题
10-11高三上·湖北·期中
名校
9 . 一定条件下用甲烷可以消除氮氧化物(NOx)的污染。已知:
①CH4(g)+4NO2(g)==4NO(g)+CO2(g)+2H2O(g);ΔH=-574 kJ·mol-1
②CH4(g)+4NO(g)==2N2(g)+CO2(g)+2H2O(g);ΔH=-1160 kJ·mol-1
下列正确的选项是
①CH4(g)+4NO2(g)==4NO(g)+CO2(g)+2H2O(g);ΔH=-574 kJ·mol-1
②CH4(g)+4NO(g)==2N2(g)+CO2(g)+2H2O(g);ΔH=-1160 kJ·mol-1
下列正确的选项是
| A.CH4(g)+2NO2(g)==N2(g)+CO2(g)+2H2O(l);ΔH=-867 kJ·mol-1 |
| B.CH4催化还原NOx为N2的过程中,若x=1.6,则转移的电子总数为3.2 mol |
| C.若0.2 mol CH4还原NO2至N2,在上述条件下放出的热量为173.4 kJ |
| D.若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移的电子总数为3.2 mol. |
您最近一年使用:0次
2016-12-09更新
|
851次组卷
|
8卷引用:安徽省怀宁中学2020-2021学年高一下学期第一次月考化学试题
安徽省怀宁中学2020-2021学年高一下学期第一次月考化学试题江西省景德镇一中2020-2021学年高一下学期期中考试化学(1班)试题新疆克孜勒苏柯尔克孜自治州第一中学2022-2023学年高一上学期11月期中考试化学试题(已下线)2010年湖北襄樊四校高三上学期期中联考化学卷2015-2016学年山东省武城县第二中学高二上学期第一次月考化学试卷2016-2017学年湖北省咸宁市高二上学期第一次月考化学试卷山东省滕州市第一中学2020-2021学年高二一部9月小测试化学试题(已下线)期中考试模拟试题(二)-2023-2024学年高二化学期中考点大串讲(人教版2019选择性必修1)
10 . 下列与化学反应能量变化相关的叙述正确的是( )
| A.生成物总能量一定低于反应物总能量 |
| B.等量H2在O2中完全燃烧生成H2O(g)与生成H2O(l),放出的能量相同 |
| C.应用盖斯定律,可计算某些难以直接测量的反应焓变 |
| D.同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH不同 |
您最近一年使用:0次
2016-12-09更新
|
1089次组卷
|
7卷引用:陕西省西安市高新一中2020-2021学年高一下学期5月月考化学试题
陕西省西安市高新一中2020-2021学年高一下学期5月月考化学试题(已下线)2014届辽宁省实验中学分校高一下学期阶段性测试化学试卷 (已下线)2012-2013学年吉林省长春二中高二上学期期末考试化学试卷(已下线)2014年高中化学人教版选修四第一章 化学反应与能量练习卷【全国百强校】内蒙古自治区杭锦后旗奋斗中学2018-2019学年高二上学期期末考试化学试题广东省深圳市福景外国语学校2020-2021学年高二年级上学期期中化学试题重庆市复旦中学2020-2021学度高二上学期第一次段考化学试题



