1 . 我国致力于2060年前实现碳中和,CO2的综合利用是重要的课题之一、
(1)CO2可通过捕获技术从空气或工业尾气中获取,下列物质能作为捕获剂的是_______ (填序号)。
A.Ca(OH)2 B.FeCl3 C.Na2CO3 D.CH3OH
(2)利用电化学可以将CO2有效转化为HCOO-,装置如图所示。
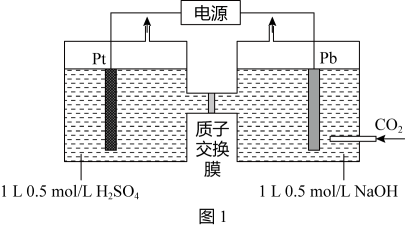
①在该装置中,左侧Pt电极为_______ 极;
②装置工作时,阴极除有HCOO-生成外,还可能生成副产物降低电解效率。阴极生成的副产物可能是_______ ,标准状况下,当阳极生成O2的体积为448mL时,测得阴极区内的c(HCOO-)=0.03mol/L,则电解损失效率=_______ 。(忽略电解前后溶液体积的变化)已知: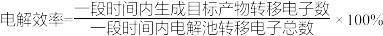 。
。
(3)科学家提出利用CO2与CH4制备“合成气”(CO、H2),反应历程如图所示:

注:c(ads)为吸附性活性炭,方框内包含微粒种类及数目、微粒的相对总能量,其中TS表示过渡态。
若E4+E1>E2+E3,则决定制备“合成气”反应速率的化学方程式为_______ 。
(4)水煤气的变换反应:CO2(g)+H2(g)⇌CO(g)+H2O(g)ΔH,将0.1molH2和0.2molCO2充入恒容容器中在某温度T℃下进行反应。
①平衡时水蒸气的物质的量分数为10%,则H2的转化率为_______ 。
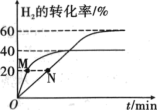
②反应速率v=v正-v逆=k正c(CO2)c(H2)-k逆c(CO)c(H2O),其中k正、k逆分别为正、逆反应的速率常数且只与温度有关。测得在700℃和800℃时,H2的转化率随时间变化的曲线如图所示。则ΔH_______ (填“>”“<”或“=”)0,计算N点对应的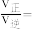
_______ 。(计算结果保留2位有效数字)
③同样在T℃时,向容器中加入过量的CoO(s),又增加了如下两个平衡:
a.CoO(s)+H2(g)⇌Co(s)+H2O(g) Ka
b.CoO(s)+CO(g)⇌Co(s)+CO2(g) Kb
Ka、Kb为两反应的平衡常数。则Kb_______ Ka(填“大于”“小于”或“等于”)。
(1)CO2可通过捕获技术从空气或工业尾气中获取,下列物质能作为捕获剂的是
A.Ca(OH)2 B.FeCl3 C.Na2CO3 D.CH3OH
(2)利用电化学可以将CO2有效转化为HCOO-,装置如图所示。

①在该装置中,左侧Pt电极为
②装置工作时,阴极除有HCOO-生成外,还可能生成副产物降低电解效率。阴极生成的副产物可能是
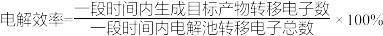 。
。(3)科学家提出利用CO2与CH4制备“合成气”(CO、H2),反应历程如图所示:

注:c(ads)为吸附性活性炭,方框内包含微粒种类及数目、微粒的相对总能量,其中TS表示过渡态。
若E4+E1>E2+E3,则决定制备“合成气”反应速率的化学方程式为
(4)水煤气的变换反应:CO2(g)+H2(g)⇌CO(g)+H2O(g)ΔH,将0.1molH2和0.2molCO2充入恒容容器中在某温度T℃下进行反应。
①平衡时水蒸气的物质的量分数为10%,则H2的转化率为
②反应速率v=v正-v逆=k正c(CO2)c(H2)-k逆c(CO)c(H2O),其中k正、k逆分别为正、逆反应的速率常数且只与温度有关。测得在700℃和800℃时,H2的转化率随时间变化的曲线如图所示。则ΔH
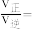

③同样在T℃时,向容器中加入过量的CoO(s),又增加了如下两个平衡:
a.CoO(s)+H2(g)⇌Co(s)+H2O(g) Ka
b.CoO(s)+CO(g)⇌Co(s)+CO2(g) Kb
Ka、Kb为两反应的平衡常数。则Kb
您最近一年使用:0次
2021-08-02更新
|
476次组卷
|
2卷引用:重庆市巴蜀中学2021届高考适应性月考卷(九)化学试题
名校
2 . 将 作为原料转化为其他化学品,是促进化工产业可持续发展,解决温室效应的有效方法。
作为原料转化为其他化学品,是促进化工产业可持续发展,解决温室效应的有效方法。
(1) 与
与 在催化剂作用下制合成气(CO和
在催化剂作用下制合成气(CO和 )的反应为
)的反应为
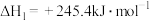 。
。
①催化剂表面积碳会使催化剂失去活性。反应时可能发生积碳反应:
Ⅰ. 、Ⅱ.
、Ⅱ. 、Ⅲ.
、Ⅲ.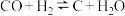 ,
,
各积碳反应在不同温度下的平衡常数 、
、 、
、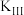 如表所示:
如表所示:
由表中数据可知,积碳主要由反应___________ (填“Ⅰ”“Ⅱ”或“Ⅲ”)导致,该反应为___________ (填“吸热”或“放热”)反应。
②在恒容密闭容器中通入 与
与 各3.0 mol,一定条件下发生反应,测得
各3.0 mol,一定条件下发生反应,测得 的平衡转化率与温度及压强的关系如图1所示。
的平衡转化率与温度及压强的关系如图1所示。

则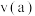
___________ (填“<”“=”或“>”,下同)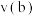 ,
,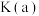
___________ 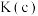 。
。
(2) 与
与 在催化剂作用下制甲烷的过程如下。
在催化剂作用下制甲烷的过程如下。
主反应:
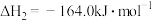 ,
,
副反应:
 ,
,
①结合
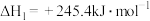 ,可计算
,可计算
___________ 。
②在恒容密闭容器中, 与
与 的起始浓度分别为
的起始浓度分别为 和
和 ,测得
,测得 、
、 的平衡浓度与温度的关系如图2所示。则650℃时,
的平衡浓度与温度的关系如图2所示。则650℃时, 的选择性
的选择性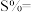
___________ [选择性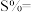 (
( 的产率/
的产率/ 的总转化率)×100%,
的总转化率)×100%,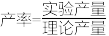 ]。
]。

③为提高 的选择性,可调节
的选择性,可调节 和
和 的投料比。
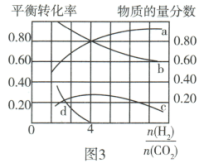
的投料比。 时,测得相应数据如图3所示,a、b表示反应物的平衡转化率,c、d分别表示平衡时
时,测得相应数据如图3所示,a、b表示反应物的平衡转化率,c、d分别表示平衡时 和
和 的物质的量分数。则表示
的物质的量分数。则表示 平衡转化率的是曲线
平衡转化率的是曲线___________ (填“a”或“b”),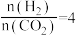 时,总压强为3.4 MPa,主反应的平衡常数
时,总压强为3.4 MPa,主反应的平衡常数
___________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
 作为原料转化为其他化学品,是促进化工产业可持续发展,解决温室效应的有效方法。
作为原料转化为其他化学品,是促进化工产业可持续发展,解决温室效应的有效方法。(1)
 与
与 在催化剂作用下制合成气(CO和
在催化剂作用下制合成气(CO和 )的反应为
)的反应为
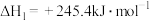 。
。①催化剂表面积碳会使催化剂失去活性。反应时可能发生积碳反应:
Ⅰ.
 、Ⅱ.
、Ⅱ. 、Ⅲ.
、Ⅲ.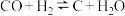 ,
,各积碳反应在不同温度下的平衡常数
 、
、 、
、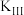 如表所示:
如表所示:| 温度/℃ |  |  | 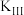 |
| 800 | 21.60 | 0.136 | 0.133 |
| 850 | 33.94 | 0.058 | 0.067 |
| 900 | 51.38 | 0.027 | 0.036 |
由表中数据可知,积碳主要由反应
②在恒容密闭容器中通入
 与
与 各3.0 mol,一定条件下发生反应,测得
各3.0 mol,一定条件下发生反应,测得 的平衡转化率与温度及压强的关系如图1所示。
的平衡转化率与温度及压强的关系如图1所示。
则
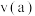
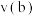 ,
,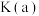
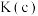 。
。(2)
 与
与 在催化剂作用下制甲烷的过程如下。
在催化剂作用下制甲烷的过程如下。主反应:

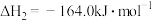 ,
,副反应:

 ,
,①结合

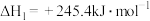 ,可计算
,可计算
②在恒容密闭容器中,
 与
与 的起始浓度分别为
的起始浓度分别为 和
和 ,测得
,测得 、
、 的平衡浓度与温度的关系如图2所示。则650℃时,
的平衡浓度与温度的关系如图2所示。则650℃时, 的选择性
的选择性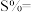
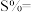 (
( 的产率/
的产率/ 的总转化率)×100%,
的总转化率)×100%,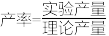 ]。
]。
③为提高
 的选择性,可调节
的选择性,可调节 和
和 的投料比。
的投料比。 时,测得相应数据如图3所示,a、b表示反应物的平衡转化率,c、d分别表示平衡时
时,测得相应数据如图3所示,a、b表示反应物的平衡转化率,c、d分别表示平衡时 和
和 的物质的量分数。则表示
的物质的量分数。则表示 平衡转化率的是曲线
平衡转化率的是曲线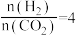 时,总压强为3.4 MPa,主反应的平衡常数
时,总压强为3.4 MPa,主反应的平衡常数

您最近一年使用:0次
2021-08-01更新
|
187次组卷
|
2卷引用:吉林省延边朝鲜族自治州汪清县汪清第四中学2021-2022学年高二上学期第二次阶段考试化学试题
3 . 已知:
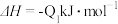

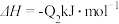

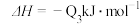
CO与镍反应会造成镍催化剂中毒,为防止镍催化剂中毒,工业上常用SO2将CO氧化,二氧化硫转化为单质硫,则对应反应的热化学方程式为

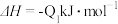

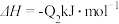

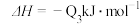
CO与镍反应会造成镍催化剂中毒,为防止镍催化剂中毒,工业上常用SO2将CO氧化,二氧化硫转化为单质硫,则对应反应的热化学方程式为
A. 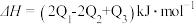 |
B. 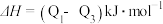 |
C.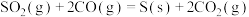 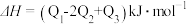 |
D.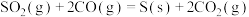 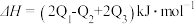 |
您最近一年使用:0次
2021-07-31更新
|
186次组卷
|
2卷引用:黑龙江省绥化市望奎县第一中学2021-2022学年高二上学期第一次月考化学试题
名校
4 . 以太阳能为热源,热化学硫碘循环分解水是一种高效、环保的制氢方法,其流程如图所示。
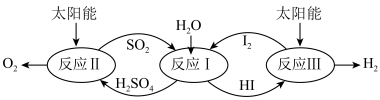
相关反应的热化学方程式为:
反应Ⅰ: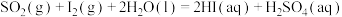
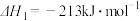
反应Ⅱ:

反应Ⅲ:

下列说法错误的是

相关反应的热化学方程式为:
反应Ⅰ:
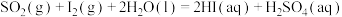
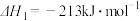
反应Ⅱ:


反应Ⅲ:


下列说法错误的是
| A.该过程实现了太阳能到化学能的转化 |
B. 和 和 对总反应起到了催化作用 对总反应起到了催化作用 |
C.总反应的热化学方程式为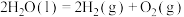  |
D.该制氢方法生成 的反应热与直接电解水生成 的反应热与直接电解水生成 的反应热相等 的反应热相等 |
您最近一年使用:0次
2021-07-31更新
|
323次组卷
|
6卷引用:四川省成都外国语学校2021-2022学年高二上学期10月月考化学试题
四川省成都外国语学校2021-2022学年高二上学期10月月考化学试题四川省眉山市彭山区第一中学2021-2022学年高二上学期10月月考化学试题选择性必修1(SJ)专题1第一单元课时4 反应热的计算(已下线)1.1.3 能源的充分利用-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)湖南省邵阳邵东市第一中学2021-2022学年高一下学期第一次月考化学试题新疆维吾尔自治区乌鲁木齐市第七十中学2022-2023学年高三上学期11月期中考试化学试题
5 . (1)已知2molH2完全燃烧生成液态水时放出572kJ热量,则2molH2完全燃烧生成水蒸气时放出热量_______ (填大于、等于或小于)572kJ。
(2)现已知N2(g)和H2(g)反应生成1molNH3(g)过程中能量变化如图所示(E1=1127kJ,E2=1173kJ):
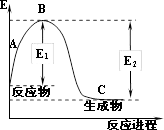
根据以上键能数据计算N—H键的键能为_______ kJ/mol。
(3)N4分子结构为正四面体,与白磷分子相似,如图所示。
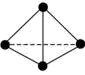
已知N-N键、N≡N键的键能分别为193kJ/mol、940kJ/mol,则1mol N4气体转化为N2时需___ (填“吸收”或“放出”)___ kJ能量。
(2)现已知N2(g)和H2(g)反应生成1molNH3(g)过程中能量变化如图所示(E1=1127kJ,E2=1173kJ):

| 化学键 | H-H | N≡N |
| 键能(kJ/mol) | 436 | 946 |
根据以上键能数据计算N—H键的键能为
(3)N4分子结构为正四面体,与白磷分子相似,如图所示。

已知N-N键、N≡N键的键能分别为193kJ/mol、940kJ/mol,则1mol N4气体转化为N2时需
您最近一年使用:0次
6 . 下列说法不正确的是
| A.一个反应经过的步骤越多,放出的热量越多 |
| B.在特定条件下,反应热等于焓变 |
| C.一个化学反应的焓变与反应途径无关 |
| D.应用盖斯定律,可计算某些难以测定的反应焓变 |
您最近一年使用:0次
2021-07-28更新
|
162次组卷
|
3卷引用:广东省梅州市大埔县田家炳实验中学2021-2022学年高二上学期第一次段考(月考)化学试题
7 . 2-甲氧基-2-甲基丁烷(TAME)常用作汽油原添加剂。在催化剂作用下,可通过甲醇与烯烃的液相反应制得,已知K1、K2、K3为平衡常数,体系中同时存在如图反应:
反应Ⅰ: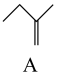 +CH3OH⇌
+CH3OH⇌ △H1
△H1
反应Ⅱ: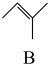 +CH3OH⇌
+CH3OH⇌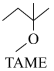 △H2
△H2
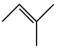
反应Ⅲ: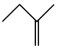 ⇌
⇌ △H3
△H3
回答下列问题:
(1)反应I、II、III以物质的量分数表示的平衡常数Kx与温度T变化关系如图所示。
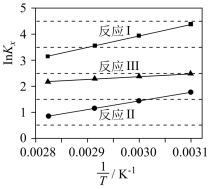
据图判断,A和B中相对稳定较差的是_______ (用系统命名法命名);△H2:△H1的数值范围是_______ (填标号)。
A.<-1 B.-1~0 C.0~1 D.>1
(2)为研究上述反应体系的平衡关系,向某反应容器中加入1.0molTAME,控制温度为353K,测得TAME的平衡转化率为a。已知反应III的平衡常数Kx3=9.0,则平衡体系中A的物质的量为_______ mol,反应I的平衡常数Kx1=_______ 。同温同压下,再向该容器中注入惰性溶剂四氢呋喃稀释,反应I的化学平衡将_______ (填“正向移动”“逆向移动”或“不移动”)平衡时,B与CH3OH物质的量浓度之比c(B):c(CH3OH)=_______ 。
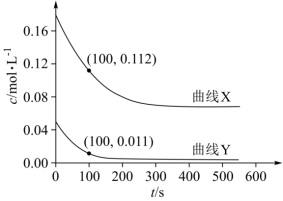
(3)为研究反应体系的动力学行为,向盛有四氢呋喃的另一容器中加入一定量A、B和CH3OH.控制温度为353K,A、B物质的量浓度c随反应时间t的变化如图所示。代表B的变化曲线为_______ (填“X”或“Y”);t=100s时,反应Ⅲ的正反应速率v正_______ 逆反应速率v逆(填“>”“<”或“=)。
反应Ⅰ:
 +CH3OH⇌
+CH3OH⇌ △H1
△H1反应Ⅱ:
 +CH3OH⇌
+CH3OH⇌ △H2
△H2反应Ⅲ:
 ⇌
⇌ △H3
△H3回答下列问题:
(1)反应I、II、III以物质的量分数表示的平衡常数Kx与温度T变化关系如图所示。

据图判断,A和B中相对稳定较差的是
A.<-1 B.-1~0 C.0~1 D.>1
(2)为研究上述反应体系的平衡关系,向某反应容器中加入1.0molTAME,控制温度为353K,测得TAME的平衡转化率为a。已知反应III的平衡常数Kx3=9.0,则平衡体系中A的物质的量为
(3)为研究反应体系的动力学行为,向盛有四氢呋喃的另一容器中加入一定量A、B和CH3OH.控制温度为353K,A、B物质的量浓度c随反应时间t的变化如图所示。代表B的变化曲线为

您最近一年使用:0次
名校
解题方法
8 . H2与N2在催化剂表面生成NH3,反应历程及能量变化示意如下:
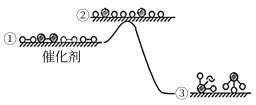
下列说法错误的是

下列说法错误的是
| A.①→②吸收能量 | B.②→③形成了N-H键 |
| C.选择不同的催化剂会改变反应热 | D.该反应为放热反应 |
您最近一年使用:0次
2021-07-28更新
|
314次组卷
|
4卷引用:广东省广州市番禺区洛溪新城中学2020-2021学年高一下学4月月考化学试题
名校
9 . 随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。
(1)把煤作为燃料可通过下列两种途径:
途径I:C(s)+O2(g)=CO2(g) △H1<0①
途径II:先制成水煤气:C(s)+H2O(g)=CO(g)+H2(g) △H2>0②
再燃烧水煤气:2CO(g)+O2(g)=2CO2(g) △H3<0③
2H2(g)+O2(g)=2H2O(g) △H4<0④
则途径I放出的热量___________ (填“大于”“等于”或“小于”)途径II放出的热量;△H1、△H2、△H3、△H4的数学关系式是___________ 。
(2)在25℃、101kPa下,1克甲醇完全燃料放热22.68kJ,写出甲醇燃烧热的热化学方程式___________ 。
(3)已知①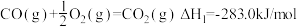
②H2(g)+ O2(g)=H2O(l) ΔH2=-285.8kJ/mol
O2(g)=H2O(l) ΔH2=-285.8kJ/mol
③C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) ΔH3=-1370kJ/mol
试计算④2CO(g)+4H2(g)=H2O(l)+C2H5OH(l)的ΔH=___________ 。
(4)臭氧可用于净化空气、饮用水消毒,处理工业废物和作为漂白剂。臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如:6Ag(s)+O3(g)=3Ag2O(s) △H=-235.8kJ•mol-1
已知:2Ag2O(s)=4Ag(s)+O2(g) △H=+62.2kJ•mol-1;则O3转化为O2的热化学方程式为___________ 。
(1)把煤作为燃料可通过下列两种途径:
途径I:C(s)+O2(g)=CO2(g) △H1<0①
途径II:先制成水煤气:C(s)+H2O(g)=CO(g)+H2(g) △H2>0②
再燃烧水煤气:2CO(g)+O2(g)=2CO2(g) △H3<0③
2H2(g)+O2(g)=2H2O(g) △H4<0④
则途径I放出的热量
(2)在25℃、101kPa下,1克甲醇完全燃料放热22.68kJ,写出甲醇燃烧热的热化学方程式
(3)已知①
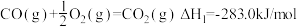
②H2(g)+
 O2(g)=H2O(l) ΔH2=-285.8kJ/mol
O2(g)=H2O(l) ΔH2=-285.8kJ/mol③C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) ΔH3=-1370kJ/mol
试计算④2CO(g)+4H2(g)=H2O(l)+C2H5OH(l)的ΔH=
(4)臭氧可用于净化空气、饮用水消毒,处理工业废物和作为漂白剂。臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如:6Ag(s)+O3(g)=3Ag2O(s) △H=-235.8kJ•mol-1
已知:2Ag2O(s)=4Ag(s)+O2(g) △H=+62.2kJ•mol-1;则O3转化为O2的热化学方程式为
您最近一年使用:0次
2021-07-27更新
|
302次组卷
|
3卷引用:江苏省海安市南莫中学2021-2022学年高二上学期第一次月考备考金卷B卷化学试题
10 . 多晶硅是制作光伏电池的关键材料。以下是粗硅制备多晶硅的简易过程。回答下列问题:
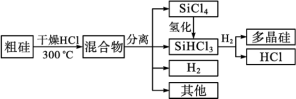
(1)硅粉与HCl在300 ℃时反应生成1 mol SiHCl3气体和H2,放出225 kJ热量,该反应的热化学方程式为_______ 。
(2)将SiCl4氢化为SiHCl3有三种方法,对应的反应依次为:
① SiCl4(g)+H2(g)⇌SiHCl3(g)+HCl(g) ΔH1>0
② 3SiCl4(g)+2H2(g)+Si(s)⇌4SiHCl3(g) ΔH2<0
③ 2SiCl4(g)+H2(g)+Si(s)+HCl(g)⇌3SiHCl3(g) ΔH3
反应③的ΔH3=_______ (用ΔH1、ΔH2表示)。
(3) 写出由二氧化硅制粗硅的化学方程式_______ 。

(1)硅粉与HCl在300 ℃时反应生成1 mol SiHCl3气体和H2,放出225 kJ热量,该反应的热化学方程式为
(2)将SiCl4氢化为SiHCl3有三种方法,对应的反应依次为:
① SiCl4(g)+H2(g)⇌SiHCl3(g)+HCl(g) ΔH1>0
② 3SiCl4(g)+2H2(g)+Si(s)⇌4SiHCl3(g) ΔH2<0
③ 2SiCl4(g)+H2(g)+Si(s)+HCl(g)⇌3SiHCl3(g) ΔH3
反应③的ΔH3=
(3) 写出由二氧化硅制粗硅的化学方程式
您最近一年使用:0次



