1 . 水是清洁、可持续的氢能来源。利用太阳能从水中获取氢气符合可持续发展的理念。
“太阳能直接热分解水制氢”通过集中阳光产生2000K以上高温,促使H2O分解为H2和O2;若温度进一步升高至5000K,H2与O2会分解为气态原子。
(1)H2O分解过程中断裂的化学键属于
A.离子键 B.极性共价键 C.非极性共价键
(2)在相同条件下,同时存在如下两个过程:
ⅰ.2H(g)+O(g)=H2O(g)
ⅱ.H2(g)+ O2(g)=H2O(g)
O2(g)=H2O(g)
比较下列量的相对大小(均从选项中选择):①放出热量
A.ⅰ>ⅱ B.ⅰ=ⅱ C.ⅰ<ⅱ
2 . 人类利用化学反应不仅可以创造新物质,还可以实现不同形式能量之间的转化,化学反应所提供的能量大大促进了社会的发展。与研究化学反应中的物质变化一样,研究化学反应中的能量变化同样具有重要意义。热化学方程式是一种化学用语,它表示的是一个化学反应中的反应焓变和物质变化。
(1)下列反应中,生成物总能量低于反应物总能量的是___________。
| A.碳酸钙受热分解 | B.八水合氢氧化钡与氯化铵的反应 |
| C.金属与酸与水的反应 | D.煤与高温下的水蒸气反应 |
(2)下列说法错误的是___________。
| A.在同一反应中,焓变和反应热的数值不相等 |
| B.有化学键破坏的一定是化学反应,且一定伴随着能量的变化 |
C.一个化学反应中,反应物的焓小于生成物的焓时, |
| D.反应体系向环境中释放能量,反应体系的焓会减小 |
(3)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的一种反应原理如下:
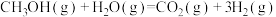
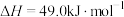 ,下列说法正确的是___________。
,下列说法正确的是___________。A.1L 蒸汽与1L水蒸气反应生成1L 蒸汽与1L水蒸气反应生成1L 气体与3L氢气吸收热量49.0kJ 气体与3L氢气吸收热量49.0kJ |
B.1个 分子与1个水分子反应生成1个 分子与1个水分子反应生成1个 分子与3个 分子与3个 分子吸收热量49.0kJ 分子吸收热量49.0kJ |
C.1mol 气体与1mol液态水反应生成1mol 气体与1mol液态水反应生成1mol 气体与3mol氢气吸收的热量小于49.0kJ 气体与3mol氢气吸收的热量小于49.0kJ |
D.相同条件下1mol 与1mol 与1mol 的能量总和小于1mol 的能量总和小于1mol 与3mol 与3mol 的能量总和 的能量总和 |
(4)氢气是一种清洁能源,如图是
 和
和 反应生成
反应生成 的能量变化示意图,由图可知___________。
的能量变化示意图,由图可知___________。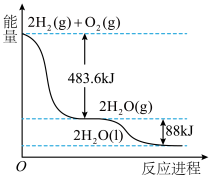
A. ,断键吸收的能量小于成键释放的能量 ,断键吸收的能量小于成键释放的能量 |
B.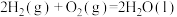 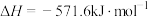 |
C. 和 和 具有的总能量比 具有的总能量比 所具有的总能量高 所具有的总能量高 |
D.生成2mol 需要吸收483.6kJ的能量 需要吸收483.6kJ的能量 |
(5)根据碘与氢气反应的热化学方程式
(ⅰ)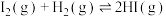
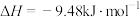
(ⅱ)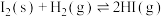
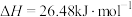
下列判断正确的是___________。
A.254g 中通入2g 中通入2g ,反应放热9.48kJ ,反应放热9.48kJ |
| B.1mol固态碘与1mol气态碘所含的能量相差17.00kJ |
| C.反应(ⅰ)的产物比反应(ⅱ)的产物稳定 |
| D.反应(ⅱ)的反应物总能量比反应(ⅰ)的反应物总能量低 |
(6)能表示反应
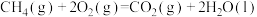 的示意图是
的示意图是A.  B.
B.  C.
C. 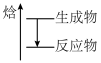 D.
D.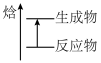
已知:常温常压下,8g甲烷气体在足量氧气中充分燃烧生成液态水和二氧化碳气体时放出445kJ热量,写出甲烷气体的燃烧热的热化学方程式:
(7)下表中的数据表示破坏1mol化学键需消耗的能量(即键能,单位为
 )。回答问题:
)。回答问题:| 化学键 | H―H | H―Cl |
| 键能 | 436 | 431 |
①下列关于键能的叙述正确的是
A.每生成1mol H―Cl吸收431kJ能量 B.每生成1mol H―Cl放出431kJ能量
C.每拆开1mol H―H放出436kJ能量 D.每拆开1mol H―H吸收436kJ能量
②已知热化学方程式: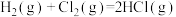
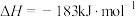 。则
。则 的键能为
的键能为 。
。
| 选项 | A | B | C | D |
| 操作或装置 | 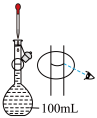 | 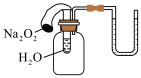 | 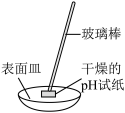 | 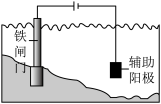 |
| 目的 | 配制100mLFeCl3溶液 | 验证Na2O2和H2O反应为放热反应 | 测定84消毒液的pH | 保护铁闸门不被腐蚀 |
| A.A | B.B | C.C | D.D |
(1)2022年2月22日,陕西人民政府发布政府工作报告,将打造全国重要的清洁能源基地作为重点工作之一,下列不属于新能源的是____。
| A.太阳能 | B.风能 | C.地热能 | D.天然气 |
(2)“即热饭盒”给人们生活带来方便,它可利用下面反应释放的热量加热食物____。
| A.生石灰和水 | B.浓硫酸和水 | C.纯碱和水 | D.食盐和白醋 |
(3)下列反应中,在原理上可以设计成原电池的是____。
| A.NaOH与H2SO4的反应 | B.氧化铝与盐酸的反应 |
| C.石灰石的分解 | D.氢气与氧气的反应 |
(4)已知:2molH2与足量O2充分燃烧生成液态水时放出572kJ热量。该反应的能量变化可用图中的
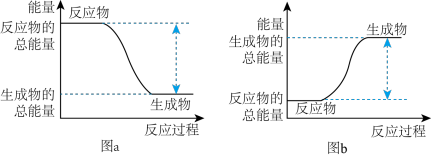
反应①
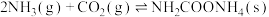
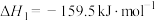
反应②
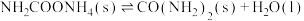

(1)下列反应与反应②的热效应相同的是___________。
| A.木炭与高温水蒸气反应 | B.镁条与稀盐酸反应 |
| C.小苏打与柠檬酸钠反应 | D.氢气与氯气反应 |
(2)下图能表示上述两步反应能量变化的是___________。
A.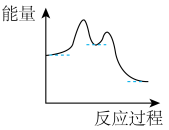 | B.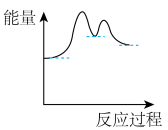 | C. | D.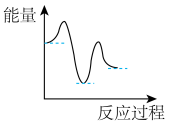 |
(3)恒温恒容时,将2mol
 和1mol
和1mol  充入2L反应器中合成尿素,经10min测得反应器内气体压强变为起始的80%(已知此时尿素为固态。水为液态),则从反应开始至10min时,
充入2L反应器中合成尿素,经10min测得反应器内气体压强变为起始的80%(已知此时尿素为固态。水为液态),则从反应开始至10min时, 的平均反应速率
的平均反应速率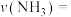
(4)若将2mol
 和1mol
和1mol  充入一容积可变的容器中进行,初始体积固定为V,10min后达到平衡时,
充入一容积可变的容器中进行,初始体积固定为V,10min后达到平衡时, 随时间变化如图所示:
随时间变化如图所示: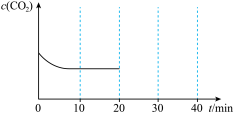
20min时压缩容器,使体积变为0.5V并保持不变,30min时达到新平衡,请在图中大致画出20min~40min内
 随时间t变化的曲线
随时间t变化的曲线(5)实际生产中,为节约成本并提高反应②的生产效率,尿素合成工厂通常将反应②的发生场所设置在反应①的发生场所附近,请说明理由:
(1)CO2由液态转化为气态的过程中
A.放出热量 B.吸收热量 C.发生化学变化
(2)上述转化过程中,微粒间的距离
A.变大 B.变小 C.不变
(3)CO2分子的电子式为
(4)碳元素有三种核素:12C、13C、14C。13C 中的“13”是指
A.13C 的中子数 B.13C 的质量数 C.碳元素的相对原子质量
(5)C和Si是同主族元素,下列事实能说明两者非金属性相对强弱的是
A.沸点:CH4<SiH4 B.相对原子质量:C<Si C.酸性:H2CO3>H2SiO3
(6)CO2甲烷化反应可将CO2直接转化为能源气体,具有较高的学术研究价值和工业化前景。反应原理:CO2+4H2
 CH4+2H2O(正反应为放热反应)。
CH4+2H2O(正反应为放热反应)。①甲烷的结构式为
②上述反应中,反应物总能量

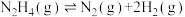
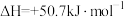
(1)根据上述信息,推测Ni-Pt/La2O3___________。
| A.能够有效降低制氢反应的反应热 |
| B.同时提高制氢正反应和逆反应的速率 |
| C.改变了制氢反应的反应历程 |
| D.不参与化学反应,使用一段时间后无需补加 |
Ⅱ.肼类燃烧剂曾是火箭的“粮食”,但会造成污染,正逐渐被淘汰。新一代运载火箭采用全新配方——低温液氢液氧推进剂,让火箭飞得更稳健。已知一定条件下:
①
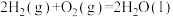
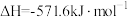 '
'②
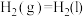

③
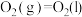
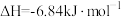
④


(2)请写出相同条件下液氢和液氧生成气态水的热化学方程式:
(3)根据上述信息,以下说法正确的是___________。
| A.变化④为低温自发的过程 |
| B.液氢液氧不点燃观察不到水生成,故该反应无法自发进行 |
| C.0.5mol液态氢气的能量高于0.5mol气态氢气的能量 |
| D.液氢和液氧作为火箭推进剂符合绿色化学理念 |
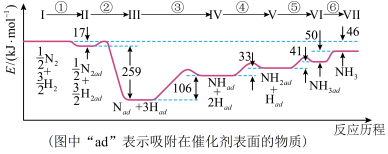
(2)根据上图计算合成氨反应的焓变:


(3)上述反应的
 ___________0(填“>”、“<”或“=”)。
___________0(填“>”、“<”或“=”)。| A.> | B.< | C.= | D.无法判断 |
(4)已知:
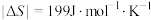 。合成氨反应能自发进行的温度是___________。
。合成氨反应能自发进行的温度是___________。| A.25℃ | B.125℃ | C.225℃ | D.325℃ |
Ⅱ.为模拟上述工业合成氨的过程,向体积恒为2L的密闭容器(温度恒为T℃)中充入1mol N2和3mol H2发生上述反应,测得N2的体积分数
 (N2)随时间(t)的变化如下表所示:
(N2)随时间(t)的变化如下表所示:| t/min | 0 | 10 | 20 | 30 | 40 | 50 |
 (N2) (N2) | 0.250 | 0.225 | 0.210 | 0.203 | 0.200 | 0.200 |
(5)40min时,N2的物质的量浓度是
 (保留三位有效数字)。
(保留三位有效数字)。(6)0~40min内,用H2表示该反应的平均速率为
 。
。(7)用
 %表示N2的平衡转化率,则关于上述平衡体系的下列判断正确的是___________。
%表示N2的平衡转化率,则关于上述平衡体系的下列判断正确的是___________。A.若向恒温恒容的平衡体系中充入N2,则 %一定增大 %一定增大 |
| B.若向恒温恒压的平衡体系中充入He,则K一定减小 |
| C.若K减小,则温度一定升高 |
D.若 %减小,则K一定减小 %减小,则K一定减小 |
(8)T℃时,按下表数据向另一2L恒容容器中投料。则该时刻
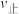 (N2)
(N2) (N2)(选填“>”、“<”或“=”)。
(N2)(选填“>”、“<”或“=”)。| 物质 | 物质的量/mol |
| N2 | 4 |
| H2 | 10 |
| NH3 | 6 |
| A.铝片与稀盐酸反应 | B.NH4Cl与Ba(OH)2∙8H2O的反应 |
| C.灼热的碳在足量O2中燃烧 | D.酸碱中和反应 |
(1)中和反应是放热反应,下列反应也属于放热反应的是_____
| A.铝热反应 | B. 与 与 混合 混合 |
| C.碳酸氢钠分解 | D.冰融化为水 |
(2)中和热的理论数值为
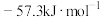 。
。①请写出氢氧化钠和盐酸反应的热化学方程式:
②若用
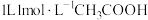 与等体积、等浓度的氢氧化钠溶液混合,放出的热量
与等体积、等浓度的氢氧化钠溶液混合,放出的热量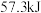 。若用
。若用 稀
稀 与等体积、等浓度的
与等体积、等浓度的 溶液混合,放出的热量
溶液混合,放出的热量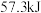 。
。(3)将
 盐酸和
盐酸和 未知浓度的
未知浓度的 溶液混合均匀后测量并记录溶液的温度,实验结果如图所示,实验中始终保持
溶液混合均匀后测量并记录溶液的温度,实验结果如图所示,实验中始终保持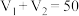 。下列叙述正确的是_____
。下列叙述正确的是_____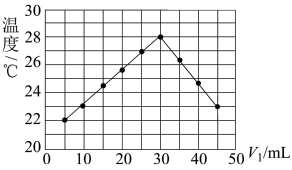
A.做该实验时环境温度低于 |
B.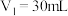 时,盐酸和氢氧化钠溶液恰好完全反应 时,盐酸和氢氧化钠溶液恰好完全反应 |
C. 溶液的浓度约为 溶液的浓度约为 |
| D.该实验表明有水生成的反应都是放热反应。 |
(4)现使用
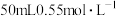 盐酸与
盐酸与 溶液在如图所示的装置中进行中和反应。
溶液在如图所示的装置中进行中和反应。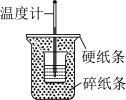
回答下列问题:
①若大烧杯上不盖硬纸板,求得的焓变

②实验中若改用
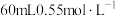 盐酸跟原
盐酸跟原 溶液进行反应,与上述实验相比,所放出的热量
溶液进行反应,与上述实验相比,所放出的热量③关于中和热的测定实验,下列说法正确的是
A.向内筒加入稀碱液时,应当缓慢分批加入。
B.实验中,应记录初始温度与反应过程中达到的最高温度
C.实验中,测量酸液的初始温度后,可以使用同一支温度计直接测量碱液的初始温度。
D.实验过程中,若使用铁质搅拌棒,会导致测得的中和热偏小。



