1 . 化学反应中的能量变化常表现为热量变化,如有的反应为放热反应,有的为吸热反应,请从下列选项中选出对此解释合理的为
| A.旧化学键断裂时吸收的能量高于新化学键形成时所释放的总能量为吸热反应 |
| B.旧化学键断裂时吸收的能量低于新化学键形成时所释放的总能量为吸热反应 |
| C.在化学反应中需要加热的反应就是吸热反应 |
| D.在化学反应中需要使用催化剂的反应为放热反应 |
您最近一年使用:0次
2023-05-25更新
|
271次组卷
|
5卷引用:5.3.1 化学变化中的能量变化(第1课时)-【帮课堂】高一化学同步精品讲义(沪科版2020必修第二册)
5.3.1 化学变化中的能量变化(第1课时)-【帮课堂】高一化学同步精品讲义(沪科版2020必修第二册)上海市吴淞中学2023-2024学年高二上学期第一学段考试化学试题山西省运城市景胜中学2022-2023学年高一5月月考化学(B卷)试题(已下线)6.1.1化学反应与热能-随堂练习(已下线)专题05 化学反应与能量变化(考题猜想)(8大题型)-2023-2024学年高一化学下学期期中考点大串讲(人教版2019必修第二册)
2 . 钠及其化合物具有独特的性质和广泛的用途。
I.
(1)下图为钠与水反应的实验示意图。
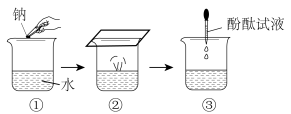
i.②中现象说明钠的密度比水___________ (“大”或“小”)。
ii.实验中观察到钠融成小球,下列能量变化示意图中能解释该现象的是___________ 。
a.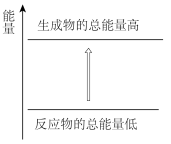 B.
B.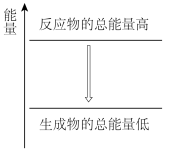
iii.③中加入酚酞试液后的现象是___________ 。
(2)用化学方程式表示由氯化钠制取金属钠的原理。___________
(3)将一定量的 通入
通入 溶液中。所得溶液转移至Y形管的一侧,并放入小磁子;向Y形管另一侧支管中加入
溶液中。所得溶液转移至Y形管的一侧,并放入小磁子;向Y形管另一侧支管中加入 盐酸,Y形管上端连接压强传感器。将Y形管倾斜,使两支管中的溶液混合,启动磁力搅拌器,采集压强数据。当数据变化平缓时,停止采集数据,得到如图所示的实验结果:
盐酸,Y形管上端连接压强传感器。将Y形管倾斜,使两支管中的溶液混合,启动磁力搅拌器,采集压强数据。当数据变化平缓时,停止采集数据,得到如图所示的实验结果:
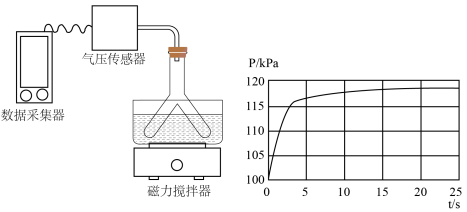
其中0~5s发生反应的离子方程式为___________ 。20s时溶液中的溶质是___________ (不考虑气体在水中的溶解)。
II.过碳酸钠( ),俗名固态双氧水,具有去污杀菌等功效。其制备原理为:
),俗名固态双氧水,具有去污杀菌等功效。其制备原理为: (反应放热)
(反应放热)
(4)结合 和
和 的性质,推测制备过碳酸钠的原料中,
的性质,推测制备过碳酸钠的原料中, 与
与 的物质的量之比应
的物质的量之比应___________  。
。
A.大于 B.等于 C.小于
向 中加入
中加入 溶液的速度不能过快,原因是
溶液的速度不能过快,原因是___________ 。
(5)在过碳酸钠的生产过程中需要加入稳定剂,以得到稳定性好的过碳酸钠产品,保证其在一定贮存期内仍具有高活性的氧含量。以不同种类的稳定剂制备过碳酸钠产品,测得其活性氧质量分数随时间的变化如图所示:
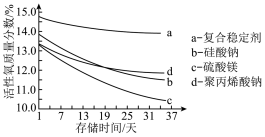
由图可知,制备过碳酸钠时应选择的稳定剂是___________ ,理由是___________ 。
A.a B.b C.c D.d
I.
(1)下图为钠与水反应的实验示意图。

i.②中现象说明钠的密度比水
ii.实验中观察到钠融成小球,下列能量变化示意图中能解释该现象的是
a.
 B.
B.
iii.③中加入酚酞试液后的现象是
(2)用化学方程式表示由氯化钠制取金属钠的原理。
(3)将一定量的
 通入
通入 溶液中。所得溶液转移至Y形管的一侧,并放入小磁子;向Y形管另一侧支管中加入
溶液中。所得溶液转移至Y形管的一侧,并放入小磁子;向Y形管另一侧支管中加入 盐酸,Y形管上端连接压强传感器。将Y形管倾斜,使两支管中的溶液混合,启动磁力搅拌器,采集压强数据。当数据变化平缓时,停止采集数据,得到如图所示的实验结果:
盐酸,Y形管上端连接压强传感器。将Y形管倾斜,使两支管中的溶液混合,启动磁力搅拌器,采集压强数据。当数据变化平缓时,停止采集数据,得到如图所示的实验结果:
其中0~5s发生反应的离子方程式为
II.过碳酸钠(
 ),俗名固态双氧水,具有去污杀菌等功效。其制备原理为:
),俗名固态双氧水,具有去污杀菌等功效。其制备原理为: (反应放热)
(反应放热)(4)结合
 和
和 的性质,推测制备过碳酸钠的原料中,
的性质,推测制备过碳酸钠的原料中, 与
与 的物质的量之比应
的物质的量之比应 。
。A.大于 B.等于 C.小于
向
 中加入
中加入 溶液的速度不能过快,原因是
溶液的速度不能过快,原因是(5)在过碳酸钠的生产过程中需要加入稳定剂,以得到稳定性好的过碳酸钠产品,保证其在一定贮存期内仍具有高活性的氧含量。以不同种类的稳定剂制备过碳酸钠产品,测得其活性氧质量分数随时间的变化如图所示:

由图可知,制备过碳酸钠时应选择的稳定剂是
A.a B.b C.c D.d
您最近一年使用:0次
名校
3 . Ⅰ.认识反应条件对化学反应方向,限度及快慢的影响,有利于运用这些规律解决实际问题。
(1)下列有关说法正确的是__________
(2) 与
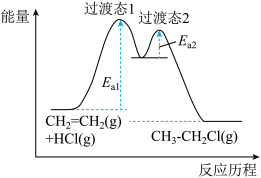
与 的加成反应分为两步,能量与反应历程如图所示。下列说法中正确的是__________
的加成反应分为两步,能量与反应历程如图所示。下列说法中正确的是__________
(3)一定条件下 在催化剂表面与水发生反应
在催化剂表面与水发生反应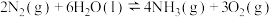 ,
, ,如果反应的平衡常数K值变大,该反应__________
,如果反应的平衡常数K值变大,该反应__________
(4)下列有关可逆反应: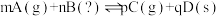 的分析中,一定正确的是__________
的分析中,一定正确的是__________
Ⅱ.金属钛(Ti)在工业领域有着重要用途。目前生产钛的方法之一是先将 转化为
转化为 ,再进一步还原得到钛。工业上将
,再进一步还原得到钛。工业上将 转化为
转化为 的方法为:
的方法为:
碳氯化法:
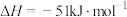
(5)平衡常数表达式
___________ ;恒温恒容时,下列叙述一定能说明该反应达到平衡状态的是___________ 。
A.混合气体的压强保持不变 B.
C.混合气体的密度保持不变 D. 和
和 物质的量相等
物质的量相等
(6)若反应容器的容积为 ,
, 后,测得固体的质量减少
后,测得固体的质量减少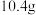 ,则
,则 的平均反应速率为
的平均反应速率为___________ 。从碰撞理论解释升高温度反应速率加快的原因:___________ 。
Ⅲ.工业上将 转化为
转化为 的方法为还有直接氯化法:
的方法为还有直接氯化法:
直接氯化法:
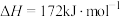
(7)从 和
和 的角度说明碳氯化法的反应趋势远大于直接氯化法的原因:
的角度说明碳氯化法的反应趋势远大于直接氯化法的原因:___________ 。
(8)由 冶炼钛方法有:900℃,
冶炼钛方法有:900℃,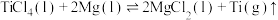 ;从平衡移动角度解释上述冶炼金属钛的反应原理
;从平衡移动角度解释上述冶炼金属钛的反应原理___________ 。
(1)下列有关说法正确的是__________
A.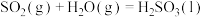 ,该过程熵值增大 ,该过程熵值增大 |
B.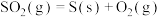 , , ,该反应一定能自发进行 ,该反应一定能自发进行 |
C.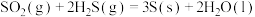 ,该过程熵值增大 ,该过程熵值增大 |
D. , , , , ,此反应低温自发 ,此反应低温自发 |
 与
与 的加成反应分为两步,能量与反应历程如图所示。下列说法中正确的是__________
的加成反应分为两步,能量与反应历程如图所示。下列说法中正确的是__________
| A.决速步骤是第一步 | B.总反应为吸热反应 |
| C.总能量:反应物低于生成物 | D.过渡态1比过渡态2更稳定 |
 在催化剂表面与水发生反应
在催化剂表面与水发生反应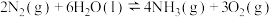 ,
, ,如果反应的平衡常数K值变大,该反应__________
,如果反应的平衡常数K值变大,该反应__________| A.在平衡移动时正反应速率先减小后增大 | B.一定向正反应方向移动 |
| C.在平衡移动时逆反应速率先增大后减小 | D.一定向逆反应方向移动 |
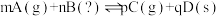 的分析中,一定正确的是__________
的分析中,一定正确的是__________A.增大压强,平衡不移动,则 |
| B.升高温度,A的转化率诚小,则正反应是吸热反应 |
| C.保持容器体积不变,移走C,平衡正向移动,正反应速率增大 |
| D.保持容器体积不变,加入B,容器中D的质量增加,则B是气体 |
Ⅱ.金属钛(Ti)在工业领域有着重要用途。目前生产钛的方法之一是先将
 转化为
转化为 ,再进一步还原得到钛。工业上将
,再进一步还原得到钛。工业上将 转化为
转化为 的方法为:
的方法为:碳氯化法:

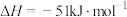
(5)平衡常数表达式

A.混合气体的压强保持不变 B.

C.混合气体的密度保持不变 D.
 和
和 物质的量相等
物质的量相等(6)若反应容器的容积为
 ,
, 后,测得固体的质量减少
后,测得固体的质量减少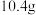 ,则
,则 的平均反应速率为
的平均反应速率为Ⅲ.工业上将
 转化为
转化为 的方法为还有直接氯化法:
的方法为还有直接氯化法:直接氯化法:

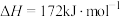
(7)从
 和
和 的角度说明碳氯化法的反应趋势远大于直接氯化法的原因:
的角度说明碳氯化法的反应趋势远大于直接氯化法的原因:(8)由
 冶炼钛方法有:900℃,
冶炼钛方法有:900℃,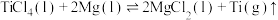 ;从平衡移动角度解释上述冶炼金属钛的反应原理
;从平衡移动角度解释上述冶炼金属钛的反应原理
您最近一年使用:0次
2023-04-30更新
|
354次组卷
|
2卷引用:上海市第二中学2022-2023学年高二下学期期中考试等级考化学试题
名校
4 . 化学反应都会伴随能量变化,还可以进行化学能与热能、电能、光能等各种形式能量之间的转化。
(1)化学家借助太阳能产生的电能和热能,用空气和水作原料成功地合成了氨气。下列说法错误的是_______
(2)下列反应中,生成物总能量高于反应物总能量的是_______
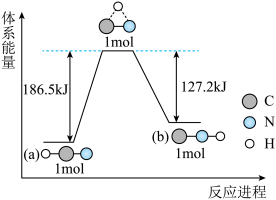
(3)研究表明,在一定条件下,气态HCN(a)与HNC(b)两种分子的互变反应过程能量变化如图所示。下列说法正确的是_______
(4)已知乙炔与苯蒸气完全燃烧的热化学方程式如下所示:
①
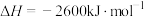
②
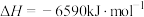
①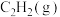 的燃烧热为
的燃烧热为___________ 。
②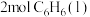 完全燃烧生成液态水时
完全燃烧生成液态水时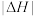
___________ 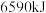 (填“>、<或=”,下同),相同条件下,等质量
(填“>、<或=”,下同),相同条件下,等质量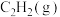 与
与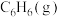 完全燃烧,热值:
完全燃烧,热值: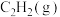
___________ 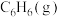 。
。
③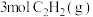 转化为
转化为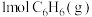 反应的
反应的
___________  。
。
(5) 是大气污染物之一,通过化学方法消除污染是当今环境化学研究的热点:
是大气污染物之一,通过化学方法消除污染是当今环境化学研究的热点: 产生的原因之一是汽车发动机工作时引发
产生的原因之一是汽车发动机工作时引发 和
和 反应,根据表中数据,书写反应的热化学方程式:
反应,根据表中数据,书写反应的热化学方程式:___________ 。
(6)科学家探索利用燃料气体中的甲烷等将氮的氧化物还原为氮气和水,反应机理为:

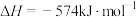
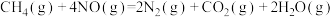
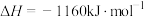
则甲烷直接将 还原为
还原为 的热化学方程式为
的热化学方程式为___________ 。
(1)化学家借助太阳能产生的电能和热能,用空气和水作原料成功地合成了氨气。下列说法错误的是_______
| A.该过程中电能转化为了化学能 | B.该过程属于氮的固定 |
| C.太阳能为可再生资源 | D.断裂 键会释放出能量 键会释放出能量 |
| A.强酸强碱的中和反应 | B.酒精燃烧 |
C.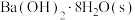 与氯化铵(s)混合 与氯化铵(s)混合 | D. 催化氧化制取 催化氧化制取 |

A.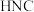 比 比 更稳定 更稳定 |
B. 转化为 转化为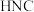 ,反应条件一定要加热 ,反应条件一定要加热 |
C. 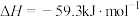 |
| D.加入催化剂,可以减小反应的热效应 |
①

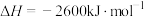
②

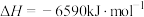
①
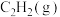 的燃烧热为
的燃烧热为②
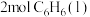 完全燃烧生成液态水时
完全燃烧生成液态水时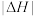
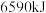 (填“>、<或=”,下同),相同条件下,等质量
(填“>、<或=”,下同),相同条件下,等质量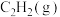 与
与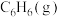 完全燃烧,热值:
完全燃烧,热值: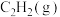
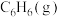 。
。③
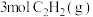 转化为
转化为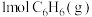 反应的
反应的
 。
。(5)
 是大气污染物之一,通过化学方法消除污染是当今环境化学研究的热点:
是大气污染物之一,通过化学方法消除污染是当今环境化学研究的热点: 产生的原因之一是汽车发动机工作时引发
产生的原因之一是汽车发动机工作时引发 和
和 反应,根据表中数据,书写反应的热化学方程式:
反应,根据表中数据,书写反应的热化学方程式:| 物质 |  |  |  |
键能 | 954 | 498 | 630 |

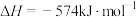
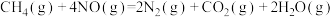
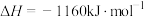
则甲烷直接将
 还原为
还原为 的热化学方程式为
的热化学方程式为
您最近一年使用:0次
5 . “即热饭盒”为生活带来便利,它可利用下面___________反应放热加热食物。
| A.浓硫酸和水 | B.生石灰和水 | C.纯碱和水 | D.食盐和白醋 |
您最近一年使用:0次
2023-04-27更新
|
67次组卷
|
2卷引用:上海市徐汇中学2022-2023学年高二下学期期中考试化学试题(等级)
名校
6 . 硫元素与铁可以形成多种硫化物,其中FeS和 最为常见,而FeS又是你最不陌生的,其样品如下图所示。
最为常见,而FeS又是你最不陌生的,其样品如下图所示。

将铁粉与硫粉混合均匀加热,即可生成FeS。但你所不知的是:细粉级的FeS在50℃以上便可自燃,纵然是极其小心地储存,也会被氧气缓慢完全氧化,其中 的Fe被氧化为+3价,同时有淡黄色晶体生成。
的Fe被氧化为+3价,同时有淡黄色晶体生成。
(1)由此信息推断的结论错误的是___________
A.上述铁粉与硫粉的反应是放热反应
B.细粉级的FeS被氧气缓慢时,可生成 和S
和S
C.等量的铁在Cl2中燃烧时,转移的电子数多
D.在50℃以上FeS自燃,有硫生成
E.FeS与硝酸反应,生成
(2)在低温冷冻下,向 溶液中滴加少量
溶液中滴加少量 溶液,得到黑色固体
溶液,得到黑色固体 ,则此反应的离子方程式为
,则此反应的离子方程式为___________ 。将 投入稀盐酸中溶解,有臭鸡蛋气味气体产生。此反应的产物除
投入稀盐酸中溶解,有臭鸡蛋气味气体产生。此反应的产物除 外,还有
外,还有___________ 和___________ (填写化学式)。
 最为常见,而FeS又是你最不陌生的,其样品如下图所示。
最为常见,而FeS又是你最不陌生的,其样品如下图所示。
将铁粉与硫粉混合均匀加热,即可生成FeS。但你所不知的是:细粉级的FeS在50℃以上便可自燃,纵然是极其小心地储存,也会被氧气缓慢完全氧化,其中
 的Fe被氧化为+3价,同时有淡黄色晶体生成。
的Fe被氧化为+3价,同时有淡黄色晶体生成。(1)由此信息推断的结论错误的是
A.上述铁粉与硫粉的反应是放热反应
B.细粉级的FeS被氧气缓慢时,可生成
 和S
和SC.等量的铁在Cl2中燃烧时,转移的电子数多
D.在50℃以上FeS自燃,有硫生成
E.FeS与硝酸反应,生成

(2)在低温冷冻下,向
 溶液中滴加少量
溶液中滴加少量 溶液,得到黑色固体
溶液,得到黑色固体 ,则此反应的离子方程式为
,则此反应的离子方程式为 投入稀盐酸中溶解,有臭鸡蛋气味气体产生。此反应的产物除
投入稀盐酸中溶解,有臭鸡蛋气味气体产生。此反应的产物除 外,还有
外,还有
您最近一年使用:0次
名校
解题方法
7 . 生产生活中的化学反应都伴随着能量的变化,请根据有关知识回答下列问题:
(1)冷敷袋在日常生活中有降温、保鲜和镇痛等用途。制作冷敷袋可以利用_______ (填“放热”或“吸热”)的化学变化或物理变化。“即热饭盒”可以利用下面_______ 放的热量加热食物;
A. 生石灰和水 B. 浓硫酸和水 C. 纯碱和水 D. 食盐和白醋
(2)已知:2mol 与足量
与足量 充分燃烧生成液态水时放出572kJ热量。
充分燃烧生成液态水时放出572kJ热量。
①该反应的能变化可用图中的_______ (填字母)表示。
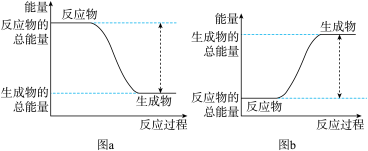
②写出 燃烧生成液态水的热化学反应方程式
燃烧生成液态水的热化学反应方程式_______ 。
(3)下列关于反应热的叙述正确的是_______。
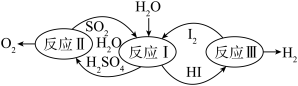
(4)科学家提出的碘硫热化学循环是由Ⅰ、Ⅱ、Ⅲ三步反应组成的(如图所示),下列有关说法正确的是_______。
(5)可用焓变和熵变来判断化学反应进行的方向,下列都是能自发进行的化学反应,其中是吸热反应且反应后熵增的是_______。
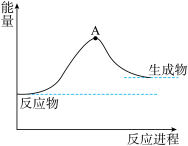
(6)一种分解海水制氢气的方法为 。如图为该反应的能量变化示意图,使用催化剂
。如图为该反应的能量变化示意图,使用催化剂 后,图中A点将
后,图中A点将_______ (填“升高”、“降低”或“不变”)。
(7)已知H-H键能: ,
, 键能:
键能: ,N-H键能:
,N-H键能: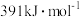 。根据以上数据写出工业合成氨的热化学反应方程
。根据以上数据写出工业合成氨的热化学反应方程_______ 。
(1)冷敷袋在日常生活中有降温、保鲜和镇痛等用途。制作冷敷袋可以利用
A. 生石灰和水 B. 浓硫酸和水 C. 纯碱和水 D. 食盐和白醋
(2)已知:2mol
 与足量
与足量 充分燃烧生成液态水时放出572kJ热量。
充分燃烧生成液态水时放出572kJ热量。①该反应的能变化可用图中的

②写出
 燃烧生成液态水的热化学反应方程式
燃烧生成液态水的热化学反应方程式(3)下列关于反应热的叙述正确的是_______。
A.当 时,表示该反应为吸热反应 时,表示该反应为吸热反应 |
B.lmol 与0. 5mol 与0. 5mol 反应生成1mol水时放出的热量即是 反应生成1mol水时放出的热量即是 的燃烧热 的燃烧热 |
| C.热化学方程式中的化学计量数只能是整数,不能是分数 |
D.1molNaOH分别和1 mol ,lmol ,lmol 反应放出的热量: 反应放出的热量: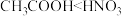 |

| A.该循环总的结果是放热反应 |
B.整个循环过程中产生1mol 的同时产生44.8L 的同时产生44.8L |
C.若反应Ⅰ、Ⅱ、Ⅲ的反应热分别为 、 、 、 、 , ,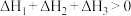 |
| D.图中反应Ⅰ、Ⅱ、Ⅲ均可在常温常压下进行 |
A.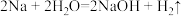 | B. |
C. | D.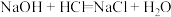 |
 。如图为该反应的能量变化示意图,使用催化剂
。如图为该反应的能量变化示意图,使用催化剂 后,图中A点将
后,图中A点将
(7)已知H-H键能:
 ,
, 键能:
键能: ,N-H键能:
,N-H键能: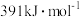 。根据以上数据写出工业合成氨的热化学反应方程
。根据以上数据写出工业合成氨的热化学反应方程
您最近一年使用:0次
名校
8 . 化学在能源开发和利用方面扮演着重要角色。以太阳能为热源,硫-碘热循环分解水是一种高效、无污染的制氢方法。其反应过程如下图所示:
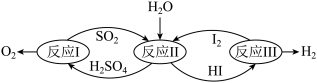
分析反应I:
反应I:
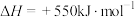
它由两步反应组成:i.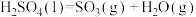

ii. 分解
分解
(1)写出 分解热化学方程式
分解热化学方程式___________ 。
分析反应Ⅱ:
(2)反应Ⅱ的化学方程式是___________ 。
(3)写出硫-碘热循环法制氢气的总化学方程式___________ ,并对该法制氢的优劣和前景进行分析。___________ 。
(4)表中的数据是破坏 气态物质中的化学键所消耗的能量,请在下图中画出反应Ⅲ:
气态物质中的化学键所消耗的能量,请在下图中画出反应Ⅲ: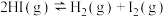 的能量变化示意图
的能量变化示意图___________ 。(注明焓变数值)

分析反应I:
反应I:
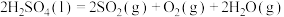
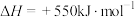
它由两步反应组成:i.
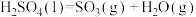

ii.
 分解
分解(1)写出
 分解热化学方程式
分解热化学方程式分析反应Ⅱ:
(2)反应Ⅱ的化学方程式是
(3)写出硫-碘热循环法制氢气的总化学方程式
(4)表中的数据是破坏
 气态物质中的化学键所消耗的能量,请在下图中画出反应Ⅲ:
气态物质中的化学键所消耗的能量,请在下图中画出反应Ⅲ: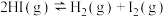 的能量变化示意图
的能量变化示意图| 共价键 | I—I | H—I | HH |
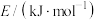 | 151 | 298 | 436 |

您最近一年使用:0次
2023-04-15更新
|
168次组卷
|
3卷引用:上海市卢湾高级中学2022-2023学年高二下学期期中考试(等级考)化学试题
上海市卢湾高级中学2022-2023学年高二下学期期中考试(等级考)化学试题(已下线)专题02 反应热的测量和计算-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(上海专用)江苏省苏州市吴江中学2023-2024学年高二上学期10月月考化学试题
9 . 下列反应中生成物总能量高于反应物总能量的是
| A.碳酸钙受热分解 | B.甲烷燃烧 |
| C.铝粉与氧化铁粉末反应 | D.铁粉与硫粉反应 |
您最近一年使用:0次
2023-04-14更新
|
210次组卷
|
2卷引用:上海市宝山区2023届高三二模测试化学试题
解题方法
10 . 乙烯与水通过加成反应可得乙醇。反应机理、能量变化与反应进程的关系如图所示。
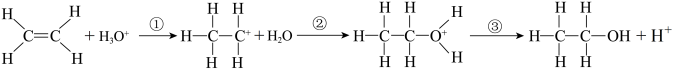

下列叙述正确的是


下列叙述正确的是
| A.①、②、③三步均属于加成反应 |
| B.H+为反应的催化剂 |
| C.①、②、③三步反应均为放热反应 |
| D.总反应是放热反应,不需要加热就能发生 |
您最近一年使用:0次



