9-10高一下·湖北省直辖县级单位·期末
名校
解题方法
1 . 下列说法中正确的是
| A.在化学反应过程中,发生物质变化的同时不一定发生能量变化 |
| B.生成物全部化学键形成时所释放的能量大于破坏反应物全部化学键所吸收的能量时,反应为吸热反应 |
| C.生成物的总能量大于反应物的总能量时,反应吸热,ΔH>0 |
| D.ΔH的大小与热化学方程式的计量系数无关 |
您最近一年使用:0次
2021-09-17更新
|
526次组卷
|
53卷引用:福建2020届高三化学总复习专题训练——选修四化学反应原理测试
福建2020届高三化学总复习专题训练——选修四化学反应原理测试云南省保山第九中学2021届高三上学期开学考试化学试题福建省泉州市永春第一中学2021-2022学年高二上学期9月线上考试化学试题(已下线)09-10年湖北潜江文昌高中高一下学期期末总复习化学试题(已下线)2010年温州市省一级重点中学高一下学期期末统一测试化学试题(已下线)2010年山西省汾阳中学高二上学期第二次月考(化学)(已下线)2010-2011学年云南省昆明一中高二下学期期中考试化学试卷(已下线)2011-2012学年陕西师大附中高二年级第一学期期中考试化学试卷(已下线)2012-2013学年黑龙江省庆安三中高二上学期期中考试化学试卷(已下线)2013-2014学年陕西省岐山县高二上学期期中质量检测理科化学试卷(已下线)2014-2015学年北京市第六十六中学高二上第一次质量检测化学试卷2015-2016学年宁夏银川第九中学高二上学期期中测试化学试卷2015-2016学年江西省南昌八一中学高二上学期10月月考化学试卷2015-2016北京大学附中宇华教育集团高二12月化学卷2015-2016北京大学附中宇华教育集团高一12月化学卷2015-2016学年江西省新余一中高一上第三次段考化学试卷湖南省湘潭、岳阳两校2015-2016学年高二上第三次联考化学卷2015-2016学年湖南省衡阳八中高二上学期期末化学试卷2015-2016学年安徽省安庆市怀宁县高河中学高二上期末化学试卷2015-2016学年湖南省常德一中高二下第一次月考化学试卷2016-2017学年山东省枣庄八中高二上10月月考化学卷2016-2017学年河北省邢台一中高二上月考二化学卷2016-2017学年天津市河东区高二上学期期中质检化学试卷黑龙江省鹤岗第一中学2016-2017学年高一下学期期中考试化学试卷辽宁省庄河市高级中学2016-2017学年高一下学期期中考试化学试题湖北省沙市中学2017-2018学年高二上学期第一次双周考化学试题陕西省咸阳市武功县普集高中2017-2018学年高二上学期第二次月考(9月)化学试题山东省济南市外国语学校2017-2018学年高二10月月考(理)化学试题江西省宜春市上高二中2017-2018学年高二第一次月考化学试题西藏日喀则市第一高级中学2017-2018学年高二上学期期中考试化学试题湖南省醴陵市第一中学2018-2019学年高二上学期入学考试化学试题【全国百强校】宁夏回族自治区育才中学2018-2019学年高二上学期第一次(9月)月考化学试题广东省茂名市第十七中学2018-2019高二第一学期期中考试理科综合化学试题内蒙古乌兰察布市北京八中乌兰察布分校2018-2019学年高二上学期第二次月考调研化学试题【全国百强校】新疆维吾尔自治区生产建设兵团第一师高级中学2018-2019学年高二上学期第一次月考化学试题吉林省油田第十一中学2019-2020学年高二上学期第一次月考化学试题湖南省常德市石门县第二中学2019-2020学年高二上学期第二次月考化学试题湖南省娄底市第一中学2020-2021学年高二上学期9月月考化学试题湖南省临澧县第一中学2020-2021学年高二上学期期中考试化学试题(选考)山西省运城市稷山中学2019-2020学年高二上学期第一次月考化学试题重庆市万州纯阳中学2020-2021学年高二上学期期中考试化学试题贵州省毕节市七星关区毕节市实验高级中学2020-2021学年高二上学期期中考试化学试题甘肃省张掖市2020-2021学年高二上学期期末学业水平质量检测化学试题湖南省临澧县第一中学2020-2021学年高二下学期阶段性考试(二)化学试题江西省靖安中学2020-2021学年高二上学期第一次月考化学试题安徽省毫州市涡阳第—中学2021-2022学年高二上学期第一次教学质量检测化学试题河北深州市长江中学2021-2022学年高二上学期10月月考化学(理)试题湖北省武汉市钢城第四中学2021-2022学年高二上学期10月月考化学试题(已下线)必考点01 化学反应与能量-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版)宁夏永宁县永宁中学2021-2022学年高二上学期期末考试化学试题吉林省乾安县第七中学2021-2022学年高二上学期第一次质量检测化学试题山东烟台2022-2023学年高一下学期3月月考化学试题辽宁省大连市第八中学2021-2022学年高二上学期10月月考化学试题
名校
解题方法
2 . 室温下,通过下列实验探究 、
、 溶液的性质。
溶液的性质。
实验1:用 试纸测量
试纸测量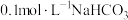 溶液的
溶液的 ,测得
,测得 约为8
约为8
实验2:将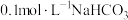 溶液与
溶液与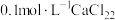 溶液等体积混合,产生白色沉淀
溶液等体积混合,产生白色沉淀
实验3: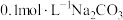 溶液中通入一定量的
溶液中通入一定量的 ,溶液
,溶液 从12下降到10
从12下降到10
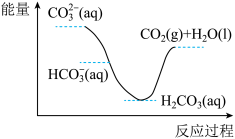
实验4: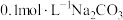 溶液中逐滴滴加稀盐酸,反应过程中的能量变化示意图如下图所示
溶液中逐滴滴加稀盐酸,反应过程中的能量变化示意图如下图所示
下列说法正确的是
 、
、 溶液的性质。
溶液的性质。实验1:用
 试纸测量
试纸测量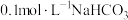 溶液的
溶液的 ,测得
,测得 约为8
约为8实验2:将
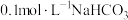 溶液与
溶液与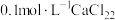 溶液等体积混合,产生白色沉淀
溶液等体积混合,产生白色沉淀实验3:
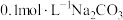 溶液中通入一定量的
溶液中通入一定量的 ,溶液
,溶液 从12下降到10
从12下降到10实验4:
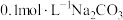 溶液中逐滴滴加稀盐酸,反应过程中的能量变化示意图如下图所示
溶液中逐滴滴加稀盐酸,反应过程中的能量变化示意图如下图所示
下列说法正确的是
A.由实验1可得出: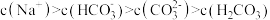 |
B.实验2中两溶液混合时有: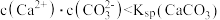 |
C.实验3中发生反应的离子方程式为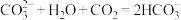 |
D.实验4表明 、 、 和盐酸反应都是放热反应 和盐酸反应都是放热反应 |
您最近一年使用:0次
2021-09-15更新
|
299次组卷
|
4卷引用:福建省龙岩第一中学2021-2022学年高三上学期第二次月考化学试题
11-12高三·福建福州·阶段练习
名校
解题方法
3 . 在蒸发皿中放入一小块钠,加热至熔化时,用玻璃棒蘸取少量无水CuSO4与熔化的钠接触,瞬间产生耀眼的火花,同时有红色物质生成。下列说法中不正确的是
| A.上述反应是置换反应 |
| B.上述反应是放热反应 |
| C.上述反应中无水CuSO4表现了还原性 |
| D.加热且无水条件下,Na可以与CuSO4反应并生成Cu |
您最近一年使用:0次
2021-08-09更新
|
619次组卷
|
29卷引用:2013届福建省罗源县第一中学高三第一次月考化学试卷
(已下线)2013届福建省罗源县第一中学高三第一次月考化学试卷2015届福建省莆田八中高三第一次月考化学试卷新疆维吾尔自治区呼图壁县第一中学2021届高三上学期11月月考化学试题(已下线)考点13 钠及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点13 钠及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)2012-2013学年陕西省西安市高陵县第三中学高一第三次月考化学试卷(已下线)2015河北保定某重点中学同步作业(必修1苏教版)2.2.1金属的性质与应用(已下线)2014-2015浙江省宁波市效实中学高一上学期期中化学试卷2014-2015重庆市一中高一上学期第三次月考化学试卷2014-2015浙江省杭州市西湖中学高一12月月考化学试卷2016-2017学年湖北省武钢三中高一12月月考化学试卷陕西省西安市长安区第一中学2017-2018学年高一上学期第二次月考化学(实验班)试题河南省周口市2017-2018学年高一上学期期末考试 化学(已下线)2018年10月13日 《每日一题》人教必修1- 周末培优【全国百强校】黑龙江省实验中学2018-2019学年高一上学期期中考试化学试题河北省承德市第一中学2018-2019学年高一上学期第三次月考化学试题(已下线)2.1.2 钠的几种化合物-2020-2021学年高一化学同步课堂帮帮帮(人教版2019必修第一册)(已下线)【浙江新东方】hzomo化学001四川省宜宾市翠屏区棠湖学校2019-2020学年高一上学期期中考试化学试题吉林省汪清县汪清第四中学2020-2021学年高一上学期期中考试化学试题河南省新乡市原阳县第三高级中学2020-2021学年高一上学期第4次月考化学试题专题3 第二单元 第1课时 钠的性质与制备-高中化学苏教2019版必修第一册(已下线)1.2.1 研究物质的基本方法-2021-2022学年高一化学课后培优练(鲁科版2019必修第一册)(已下线)2.1.1 钠及其氧化物-2021-2022学年高一化学课后培优练(人教版2019必修第一册)浙江省杭州市富阳区实验中学2021-2022学年高一上学期10月月考化学试题天津市南开中学2021-2022学年高一上学期期中考试化学试题(已下线)易错专题09 钠与氧气、水和水溶液反应的规律-【突破易错·冲刺满分】2021-2022学年高一上学期化学期中期末易错专题(人教版2019)(已下线)第08练 钠及其化合物-2022年【寒假分层作业】高一化学(苏教版2019必修第一册)(已下线)衔接点14 钠的单质-2022年初升高化学无忧衔接?
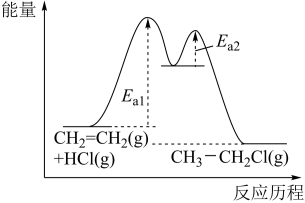
4 .  与HCl的加成反应由第一步
与HCl的加成反应由第一步 和第二步
和第二步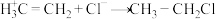 组成,能量与反应历程如图所示。下列说法正确的是
组成,能量与反应历程如图所示。下列说法正确的是
 与HCl的加成反应由第一步
与HCl的加成反应由第一步 和第二步
和第二步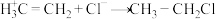 组成,能量与反应历程如图所示。下列说法正确的是
组成,能量与反应历程如图所示。下列说法正确的是
| A.两步反应均释放能量 |
| B.第一步的反应速率比第二步的慢 |
C.第二步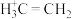 与 与 的碰撞100%有效 的碰撞100%有效 |
D.总反应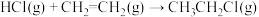 的 的 |
您最近一年使用:0次
5 . 运动会上发令枪所用的“火药”成分是氯酸钾和红磷,经撞击发出响声,同时产生白色烟雾。撞击时发生反应:5KClO3+6P=3P2O5+5KCl,则下列有关叙述错误的是( )
| A.该反应是放热反应 |
| B.产生白色烟雾的原因是生成的P2O5白色固体小颗粒(烟)吸水性很强,吸收空气中的水分,生成磷酸小液滴(雾) |
| C.因红磷和白磷互为同分异构体,所以上述火药中的红磷可以用白磷代替 |
| D.该上述反应中消耗3molP时,转移电子的物质的量为15mol |
您最近一年使用:0次
名校
6 . 将盛有NH4HCO3粉末的小烧杯放入盛有少量冰醋酸的大烧杯中。然后向小烧杯中加入盐酸,反应剧烈,大烧杯中的冰醋酸逐渐凝固。下列有关小烧杯中发生的反应的说法正确的是
| A.该反应是放热反应 |
| B.该反应过程中,热能转化为产物内部的能量 |
| C.该反应的反应物的总能量高于生成物的总能量 |
| D.该反应中化学键断裂吸收的能量比化学键形成放出的能量少 |
您最近一年使用:0次
2020-11-02更新
|
213次组卷
|
5卷引用:福建省建瓯市芝华中学2021届高三上学期第二次阶段考(期中)化学试题
名校
解题方法
7 . 分类是学习和研究化学的一种常用的科学方法。下列分类合理的是
①根据一个酸分子中电离出的H原子个数将酸分为一元酸、二元酸等
②金属氧化物一定是碱性氧化物
③根据丁达尔现象可将分散系分为胶体、溶液和浊液
④SiO2是酸性氧化物,能与NaOH溶液反应
⑤根据反应的热效应将化学反应分为放热反应和吸热反应.
①根据一个酸分子中电离出的H原子个数将酸分为一元酸、二元酸等
②金属氧化物一定是碱性氧化物
③根据丁达尔现象可将分散系分为胶体、溶液和浊液
④SiO2是酸性氧化物,能与NaOH溶液反应
⑤根据反应的热效应将化学反应分为放热反应和吸热反应.
| A.②③ | B.②④⑤ | C.①④⑤ | D.②③④⑤ |
您最近一年使用:0次
8 . 下列反应中能量变化与其它不同的是( )
| A.铝热反应 | B.燃料燃烧 | C.酸碱中和反应 | D.Ba(OH)2•8H2O与NH4Cl固体混合 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-10-11更新
|
259次组卷
|
15卷引用:福建省宁德市高中同心顺联盟校2020届高三上学期期中考试化学试题
福建省宁德市高中同心顺联盟校2020届高三上学期期中考试化学试题2016届北京市石景山区高三下学期统一测试理综化学试卷(已下线)专题九 化学能与热能(提分特训)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训山东省烟台市第二中学2016-2017学年高一6月月考化学试题1山东省烟台市第二中学2016-2017学年高一6月月考化学试题2北京市2020年普通高中学业水平合格性模拟考试化学试题吉林省辽源市田家炳高级中学校2020-2021学年高二上学期第一次月考化学试题安徽省蚌埠田家炳中学、蚌埠五中2020-2021学年高二上学期期中考试化学试题河南省新乡市长垣县第十中学2020-2021学年高二上学期期中考试化学试题贵州省铜仁市思南中学2020-2021学年高二上学期期末考试化学试题内蒙古自治区乌拉特前旗第一中学2020-2021学年高一下学期4月月考化学试题湖南省怀化市第五中学2020-2021学年高二上学期入学考试化学试题北京市第十四中学2021-2022学年高二上学期期中考试化学试题四川省成都实验中学2020-2021学年度高2022届高二上学期开学考试化学试题吉林省通化市2021-2022学年高一下学期期中联考化学试题
名校
解题方法
9 . 我国学者结合实验与计算机模拟结果,研究了均相NO-CO的反应历程,反应路径中每一阶段内各驻点的能量均为相对于此阶段内反应物能量的能量之差,下列说法错误的是( )
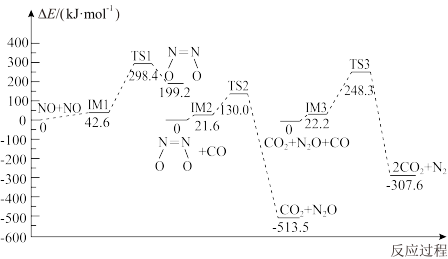

A.2NO(g) + 2CO( g) N2(g) +2CO2(g) ΔH>0 N2(g) +2CO2(g) ΔH>0 |
| B.均相NO—CO反应经历了三个过渡态和五个中间体 |
| C.整个反应分为三个基元反应阶段,总反应速率由第一阶段反应决定 |
D.NO二聚体( )比N2O分子更容易与CO发生反应 )比N2O分子更容易与CO发生反应 |
您最近一年使用:0次
2020-09-03更新
|
466次组卷
|
2卷引用:福建省龙岩第一中学2020-2021学年高三上学期第三次月考化学试题
解题方法
10 . 目前Haber-Bosch法是工业合成氨的主要方式,其生产条件需要高温高压。为了有效降低能耗,过渡金属催化还原氮气合成氨被认为是具有巨大前景的替代方法。催化过程一般有吸附—解离—反应—脱附等过程,图示为N2和H2在固体催化剂表面合成氨反应路径的势能面图(部分数据略),其中“*”表示被催化剂吸附。
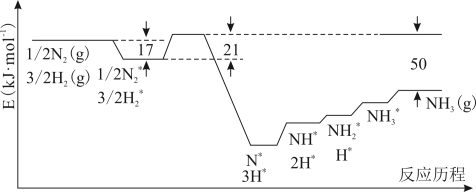
(1)氨气的脱附是____ 过程(填“吸热”或“放热”),合成氨的热化学方程式为_____
(2)合成氨的捷姆金和佩热夫速率方程式为 w= k1 p(N2) -k2
-k2 ,w为反应的瞬时总速率,为正反应和逆反应速率之差,k1、k2是正、逆反应速率常数。合成氨反应N2+3H2⇌2NH3的平衡常数Kp=
,w为反应的瞬时总速率,为正反应和逆反应速率之差,k1、k2是正、逆反应速率常数。合成氨反应N2+3H2⇌2NH3的平衡常数Kp=_________ (用k1,k2表示)(注:Kp用各物质平衡分压来表示)。
(3)若将2.0molN2和6.0molH2通入体积为1L的密闭容器中,分别在T1和T2温度下进行反应。曲线A表示T2温度下n(H2)的变化,曲线B表示T1温度下n(NH3)的变化,T2温度下反应到a点恰好达到平衡。

①温度T1___ T2 (填“>”、“<”或“=”下同),T1温度下恰好平衡时,曲线B上的点为b(m, n ),则m___ 12,n__ 2。
②T2 温度下,反应从开始到恰好平衡时平均速率v(N2) =_____ 。
③T2温度下,合成氨反应N2+3H2⇌2NH3的平衡常数的数值是____ ;若某时刻,容器内气体的压强为起始时的80%,则此时v(正)____ v(逆)(填“>”、“<”或“=”)。
(4)工业上通过降低反应后混合气体的温度而使氨气分离出来。这种分离物质的方法, 其原理类似于下列方法中的___ (填序号)。
A.过滤 B.蒸馏 C.渗析 D.萃取

(1)氨气的脱附是
(2)合成氨的捷姆金和佩热夫速率方程式为 w= k1 p(N2)
 -k2
-k2 ,w为反应的瞬时总速率,为正反应和逆反应速率之差,k1、k2是正、逆反应速率常数。合成氨反应N2+3H2⇌2NH3的平衡常数Kp=
,w为反应的瞬时总速率,为正反应和逆反应速率之差,k1、k2是正、逆反应速率常数。合成氨反应N2+3H2⇌2NH3的平衡常数Kp=(3)若将2.0molN2和6.0molH2通入体积为1L的密闭容器中,分别在T1和T2温度下进行反应。曲线A表示T2温度下n(H2)的变化,曲线B表示T1温度下n(NH3)的变化,T2温度下反应到a点恰好达到平衡。

①温度T1
②T2 温度下,反应从开始到恰好平衡时平均速率v(N2) =
③T2温度下,合成氨反应N2+3H2⇌2NH3的平衡常数的数值是
(4)工业上通过降低反应后混合气体的温度而使氨气分离出来。这种分离物质的方法, 其原理类似于下列方法中的
A.过滤 B.蒸馏 C.渗析 D.萃取
您最近一年使用:0次



