解题方法
1 . (1)顺-1,2-二甲基环丙烷和反-1,2-二甲基环丙烷可发生如下转化:
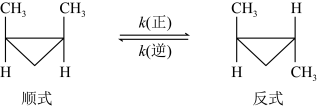
该反应的速率方程可表示为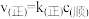 和
和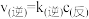 ,k(正)和k(逆)在一定温度时为常数,分别称作正、逆反应速率常数。已知:
,k(正)和k(逆)在一定温度时为常数,分别称作正、逆反应速率常数。已知: 温度下
温度下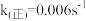 ,
,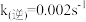 ,该温度下反应的平衡常数值
,该温度下反应的平衡常数值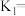
 (正)小于
(正)小于 (逆),则
(逆),则
(2)一定量的 与足量的C在恒压密闭容器中发生反应:
与足量的C在恒压密闭容器中发生反应: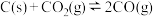
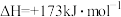 ,若压强为
,若压强为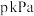 ,平衡时体系中气体体积分数与温度的关系如图所示,回答下列问题:
,平衡时体系中气体体积分数与温度的关系如图所示,回答下列问题:
① 时
时 的平衡转化率为
的平衡转化率为
② 时平衡常数
时平衡常数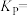
 和
和 气体,则平衡
气体,则平衡
您最近一年使用:0次
2020-11-27更新
|
130次组卷
|
2卷引用:山东省临沂市平邑县第一中学2022-2023学年高二上学期10月月考化学试题
名校
解题方法
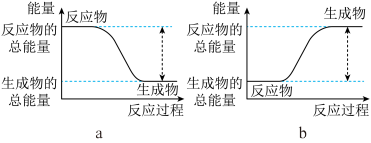
2 . Ⅰ.(1)从能量的变化和反应的快慢等角度研究反应:2H2(g)+O2(g)=2H2O(g)。已知该反应为放热反应,下图能正确表示该反应中能量变化的是__________ 。
从断键和成键的角度分析上述反应中能量的变化,化学键的键能如下表所示:
则生成1molH2O(g)可以放出热量_________________ kJ。
(2)下列反应中,属于放热反应的是_________ ,属于吸热反应的是_________ 。
a.盐酸与烧碱溶液反应 b.Ba(OH)2•8H2O+2NH4Cl=BaCl2+10H2O+2NH3↑
c.氢气在氧气中燃烧生成水 d.高温煅烧石灰石使其分解
e.铝和盐酸反应 f.葡萄糖在人体内氧化分解
Ⅱ.A、B、C、D 四种金属按下表中装置进行实验。
根据实验现象回答下列问题:
①装置甲中溶液中的阴离子移向_____________ 极(填“正”或“负”)。
②装置乙中正极的电极反应式为_________________________ 。
③装置丙中溶液的pH__________________ (填“变大”“变小”或“不变”)。
④四种金属活动性由强到弱的顺序是___________________________ 。

从断键和成键的角度分析上述反应中能量的变化,化学键的键能如下表所示:
| 化学键 | H—H | O=O | H—O |
| 键能(kJ·mol-1) | 436 | 496 | 463 |
则生成1molH2O(g)可以放出热量
(2)下列反应中,属于放热反应的是
a.盐酸与烧碱溶液反应 b.Ba(OH)2•8H2O+2NH4Cl=BaCl2+10H2O+2NH3↑
c.氢气在氧气中燃烧生成水 d.高温煅烧石灰石使其分解
e.铝和盐酸反应 f.葡萄糖在人体内氧化分解
Ⅱ.A、B、C、D 四种金属按下表中装置进行实验。
| 装置 | 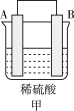 |  |  |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据实验现象回答下列问题:
①装置甲中溶液中的阴离子移向
②装置乙中正极的电极反应式为
③装置丙中溶液的pH
④四种金属活动性由强到弱的顺序是
您最近一年使用:0次
名校
3 . 下列反应既属于氧化还原反应,又属于吸热反应的是
| A.铝片与稀盐酸的反应 | B.氢氧化钡晶体与氯化铵晶体的反应 |
| C.甲烷在氧气中的燃烧反应 | D.灼热的氧化铜与H2的反应 |
您最近一年使用:0次
2020-09-06更新
|
173次组卷
|
3卷引用:山东省临沂第一中学2019-2020学年高一下学期期中考试化学试题
4 . 白磷、红磷是磷的两种同素异形体。某温度下1mol白磷转化为红磷放出29.2kJ的热量,则下列叙述正确的是
| A.白磷比红磷稳定 | B.红磷比白磷稳定 |
| C.1mol白磷比1mol红磷含有的总能量低 | D.红磷转化为白磷要放热 |
您最近一年使用:0次
2020-07-07更新
|
137次组卷
|
3卷引用:山东省郯城第二中学2020-2021学年下学期高一4月月考化学试题
5 . 为探究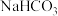 、
、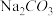 与盐酸(浓度为
与盐酸(浓度为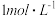 )反应过程中的热效应,实验测得的数据如表所示:
)反应过程中的热效应,实验测得的数据如表所示:
由此得出的结论正确的是
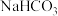 、
、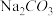 与盐酸(浓度为
与盐酸(浓度为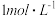 )反应过程中的热效应,实验测得的数据如表所示:
)反应过程中的热效应,实验测得的数据如表所示:| 序号 | 35mL试剂 | 固体 | 混合前温度/℃ | 混合后温度/℃ |
| ① | 水 | 2.5g  | 20.0 | 18.5 |
| ② | 水 | 3.2g  | 20.0 | 24.3 |
| ③ | 盐酸 | 2.5g  | 20.0 | 16.2 |
| ④ | 盐酸 | 3.2g  | 20.0 | 25.1 |
由此得出的结论正确的是
A. 固体与盐酸的反应是吸热反应 固体与盐酸的反应是吸热反应 |
B. 固体与盐酸的反应是放热反应 固体与盐酸的反应是放热反应 |
C.20.0℃时,含3.2g 的饱和溶液和35mL盐酸混合后的温度将低于25.1℃ 的饱和溶液和35mL盐酸混合后的温度将低于25.1℃ |
D.20.0℃时,含2.5g 的饱和溶液和35mL盐酸混合后的温度将低于16.2℃ 的饱和溶液和35mL盐酸混合后的温度将低于16.2℃ |
您最近一年使用:0次
2020-06-23更新
|
536次组卷
|
16卷引用:山东省临沂市费县地区化学2020-2021学年高二上学期9月月考化学试题
山东省临沂市费县地区化学2020-2021学年高二上学期9月月考化学试题(已下线)2013-2014安徽省安庆一中、合肥六中第二学期期末联考高一化学试卷(已下线)2014-2015学年浙江省杭州市西湖高级中学高二10月月考化学试卷2015-2016学年福建省福州格致中学高二上学期半期考试化学试卷湖南省宁远县第一中学2016-2017学年高一下学期比赛考试(6月月考)化学试题【全国百强校】安徽省六安市第一中学2017-2018学年高一下学期期末考试化学试题辽宁省实验中学2017-2018学年高一下学期期中考试理科化学试题云南省昆明市寻甸县民族中学2019-2020学年高二下学期第一次月考化学试题江西省贵溪市实验中学2020-2021学年高二上学期第一次月考化学试题鲁科版(2019)高二选择性必修第一册第1章 化学反应与能量变化 第1节 化学反应的热效应 课时1 化学反应的反应热、内能变化与焓变人教版(2019)高二化学选择性必修1第一章 化学反应的热效应 第一节 反应热 课时1 反应热 焓变山西省怀仁市2020-2021学年高二上学期期中化学试题河北省任丘一中2021-2022学年高二上学期阶段考试(一)化学试题山东省实验中学2022届高三第一次诊断考试化学试题山东省济南外国语学校2021-2022学年高三上学期11月月考化学试题广东省广州市第二中学2023-2024学年高二上学期期中考试化学试题
名校
6 . 已知石墨生成金刚石的反应是一个吸热反应,由此可以判断出( )
| A.金刚石比石墨稳定 |
| B.石墨比金刚石稳定 |
| C.只要加热到一定程度,任何化学反应都会发生 |
| D.石墨转化为金刚石是一个只有能量变化没有物质变化的反应 |
您最近一年使用:0次
2019-11-15更新
|
120次组卷
|
5卷引用:山东省临沂市费县地区化学2020-2021学年高二上学期9月月考化学试题
名校
7 . 肼(N2H4)在不同条件下分解产物不同,200℃时在Cu表面分解的机理如图。已知200℃时:反应Ⅰ:3N2H4(g)=N2(g)+4NH3(g) ΔH1=−32.9 kJ·mol−1;反应Ⅱ:N2H4(g)+H2(g)=2NH3(g) ΔH2=−41.8kJ·mol−1

下列说法不正确的是

下列说法不正确的是
| A.图所示过程①是放热反应 |
| B.反应Ⅱ的能量过程示意图如图所示 |
| C.断开3 molN2H4(g)的化学键吸收的能量大于形成1molN2(g)和4molNH3(g)的化学键释放的能量 |
| D.200℃时,肼分解生成氮气和氢气的热化学方程式为N2H4(g)=N2(g)+2H2(g) ΔH=+50.7 kJ·mol−1 |
您最近一年使用:0次
2019-04-13更新
|
2237次组卷
|
13卷引用:山东省临沂市罗庄区2019-2020学年高二上学期期末考试化学试题
山东省临沂市罗庄区2019-2020学年高二上学期期末考试化学试题【全国百强校】浙江省杭州市第二中学2019届高三第二学期选考模拟卷化学试题(已下线)专题07 化学反应中的能量变化——2019年高考真题和模拟题化学分项汇编四川省成都外国语学校2019-2020学年高二上学期期中考试化学试题(已下线)专题6.1 化学能与热能(练)——2020年高考化学一轮复习讲练测(已下线)第01章 化学反应与能量(A卷基础篇)——2020-2021学年高二化学选修四同步单元AB卷(人教版)吉林省长春汽车经济技术开发区第六中学2019-2020学年高一下学期期末考试化学试题人教版(2019)高二化学选择性必修1第一章 化学反应的热效应 过综合 章末素养综合检测福建省宁化第一中学2021-2022学年高二上学期开学考试化学试题福建省三明市第二中学2022-2023学年高二上学期开学适应性练习化学试题湖南省宁乡市四校联考2022-2023学年高二上学期10月月考化学试题湖南省南雅中学2023-2024学年高二上学期第一次月考化学试题广西南宁沛鸿民族中学2023-2024学年高二上学期10月月考化学试题
真题
名校
8 . 反应A(g)+B(g)  C(g) +D(g)过程中的能量变化如图所示,回答下列问题。
C(g) +D(g)过程中的能量变化如图所示,回答下列问题。
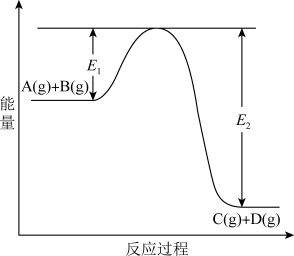
(1)该反应是____________________ 反应(填“吸热”“放热”);
(2)当反应达到平衡时,升高温度,A的转化率______ (填“增大”“减小”“不变”),原因是_______________________________ ;
(3)反应体系中加入催化剂对反应热是否有影响?________ ,原因是_________ :
(4)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1_________ ,E2________ (填“增大”“减小、”“不变”)。
 C(g) +D(g)过程中的能量变化如图所示,回答下列问题。
C(g) +D(g)过程中的能量变化如图所示,回答下列问题。
(1)该反应是
(2)当反应达到平衡时,升高温度,A的转化率
(3)反应体系中加入催化剂对反应热是否有影响?
(4)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1
您最近一年使用:0次
2019-01-30更新
|
1406次组卷
|
19卷引用:2015-2016学年山东省临沂市第十九中学高二上10月月考化学试卷
2015-2016学年山东省临沂市第十九中学高二上10月月考化学试卷2008年普通高等学校招生统一考试化学试题(海南卷)(已下线)2010年河南省长葛三高高二上学期第一次考试化学试题(已下线)2010年山西省山西大学附中高二上学期10月考化学(已下线)2011-2012学年山西省汾阳市高二10月月考化学试卷(已下线)2011-2012学年辽宁省沈阳同泽女中高二上学期期中考试化学试卷(已下线)2011-2012学年山西省汾阳中学高二第二次月考化学试卷(已下线)2011-2012学年海南省洋浦中学高二下学期期中考试化学试卷(已下线)2014-2015学年山西省太原第五中学高二10月月考化学试卷2015-2016学年四川阆中中学校高二下第一次段考化学试卷2015-2016学年海南文昌中学高一下期末考化学(理)试题2015-2016学年青海省西宁市第五中学高一下学期期末(理)化学试卷山西省怀仁县第八中学2016-2017学年高一(普通班)下学期期末考试化学试题黑龙江省双鸭山市第一中学2017-2018学年高二9月月考化学试题宁夏育才中学学益校区2017-2018学年高二下学开学考试化学试题【全国百强校】宁夏回族自治区育才中学2018-2019学年高二上学期第一次(9月)月考化学试题山西省运城市稷山中学2019-2020学年高二上学期第一次月考化学试题(已下线)【浙江新东方】【2020】【高二上】【期中】【HD-LP415(2)】【化学】四川省广安代市中学校2021-2022学年高二上学期第一次月考化学试题
9 . 下列关于热化学反应的描述中正确的是
| A.HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ/mol |
| B.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷燃烧热 |
| C.需要加热才能发生的反应一定是吸热反应 |
| D.CO(g)的燃烧热是283kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的ΔH=+2×283kJ/mol |
您最近一年使用:0次
9-10高一下·江西·期中
名校
10 . 下列反应中生成物总能量高于反应物总能量的是
| A.碳酸钙受热分解 | B.乙醇燃烧 | C.铝与稀硫酸反应 | D.氧化钙溶于水 |
您最近一年使用:0次
2019-01-30更新
|
314次组卷
|
8卷引用:2011-2012年山东省莒南县三中高二上学期期中考试化学试卷
(已下线)2011-2012年山东省莒南县三中高二上学期期中考试化学试卷(已下线)09~10年江西四校高一下学期期中联考化学卷(已下线)2011-2012年河南省长葛市第三实验高中高二上学期第一次月考化学试卷(已下线)2011-2012年广东省广雅中学高二上学期期中考试化学(理)试卷(已下线)2011-2012学年陕西省西安市第一中学高二上学期期末考试化学(理)试卷(已下线)2011-2012学年浙江省开化县华埠中学高二下学期3月月考试卷(已下线)2012-2013学年浙江省舟山二中等三校高二上学期期末联考化学试卷甘肃省酒泉市四校联考2023-2024学年高一下学期5月期中考试化学试题



