解题方法
1 . 从物质分类的角度看, 和
和 都属于氧化物,但二者的性质存在很大差异。查阅资料得知,
都属于氧化物,但二者的性质存在很大差异。查阅资料得知, 可在呼吸面具和潜水艇中做供氧剂,某实验小组欲通过实验探究
可在呼吸面具和潜水艇中做供氧剂,某实验小组欲通过实验探究 的性质与用途。
的性质与用途。
【实验I】探究 与水的反应
与水的反应
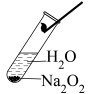
(1)如图,将1~2mL水滴入盛有1~2g过氧化钠固体的试管中,立即把带火星的小木条伸入试管中,观察到带火星的小木条复燃,说明生成了______ ,用手触摸试管外壁,感觉发烫,说明该反应是______ (填“吸热”或“放热”)反应。用pH计测得溶液呈碱性,说明该反应还生成了______ 。
【实验II】探究 与
与 的反应
的反应
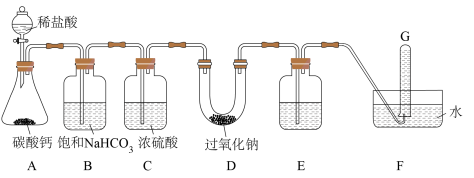
(2)装置A用于制备______ 气体,盛装稀盐酸的仪器名称是______ 。
(3)装置B的作用是______ 。
(4)写出D中发生反应的化学方程式:______ 。
(5)装置E的作用是除去过量的 ,则装置E中盛装的试剂是
,则装置E中盛装的试剂是______ 。
(6)G中得到的物质是______ ,证明 可用作呼吸面具和潜水艇的供氧剂。
可用作呼吸面具和潜水艇的供氧剂。
 和
和 都属于氧化物,但二者的性质存在很大差异。查阅资料得知,
都属于氧化物,但二者的性质存在很大差异。查阅资料得知, 可在呼吸面具和潜水艇中做供氧剂,某实验小组欲通过实验探究
可在呼吸面具和潜水艇中做供氧剂,某实验小组欲通过实验探究 的性质与用途。
的性质与用途。【实验I】探究
 与水的反应
与水的反应
(1)如图,将1~2mL水滴入盛有1~2g过氧化钠固体的试管中,立即把带火星的小木条伸入试管中,观察到带火星的小木条复燃,说明生成了
【实验II】探究
 与
与 的反应
的反应
(2)装置A用于制备
(3)装置B的作用是
(4)写出D中发生反应的化学方程式:
(5)装置E的作用是除去过量的
 ,则装置E中盛装的试剂是
,则装置E中盛装的试剂是(6)G中得到的物质是
 可用作呼吸面具和潜水艇的供氧剂。
可用作呼吸面具和潜水艇的供氧剂。
您最近一年使用:0次
2 . 下列实验操作、现象和结论均正确的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 用A、B两电极及导线,电解质溶液组成原电池装置 | B极有物质析出 | 金属活动性:A>B |
| B | 取适量 固体于试管中,滴入少量水并用温度计检测 固体于试管中,滴入少量水并用温度计检测 | 试管内温度上升 |  溶于水放热 溶于水放热 |
| C | 向 溶液中逐滴加入稀氨水至过量 溶液中逐滴加入稀氨水至过量 | 产生白色沉淀,并逐渐增多,后慢慢溶解 | 碱性:  |
| D | 向足量NaBr溶液中通入少量氯气,再加入淀粉KI溶液 | 溶液先变橙色,后变为蓝色 | 氧化性: |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
3 . Ⅰ.如图所示,在一个小烧杯里加入研细的 晶体。将此小烧杯放在事先滴有3~4滴水的玻璃片上,然后向小烧杯中加入
晶体。将此小烧杯放在事先滴有3~4滴水的玻璃片上,然后向小烧杯中加入 晶体,并用玻璃棒快速搅拌。
晶体,并用玻璃棒快速搅拌。
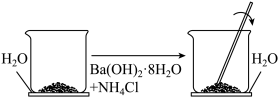
(1)该实验中观察到的现象除产生刺激性气味的气体及反应混合物呈糊状以外,还有___________ 。该反应___________ (填“是”或“不是”)氧化还原反应。
(2)该反应为___________ (填“吸”或“放”)热反应,说明反应物的总能量___________ (填“大于”或“小于”)生成物的总能量。
(3)实验中要用玻璃棒搅拌的原因是________ 。
Ⅱ.
(4)现有如下两个反应:A. ,B.
,B. 。判断上述两个反应中能设计成原电池的是
。判断上述两个反应中能设计成原电池的是___________ (填“A”或“B”)。
(5)将纯锌片和纯铜片按图中方式插入100mL相同浓度的稀硫酸中一段时间,回答下列问题:
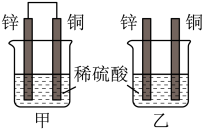
①下列说法正确的是___________ 。
A.甲、乙均为化学能转变为电能的装置 B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少 D.两烧杯中溶液的pH均增大
②在相同时间内,两烧杯中产生气泡的速度:甲___________ 乙(填“>”“<”或“=”)。
③请写出图中构成原电池的负极电极反应式:___________ 。
(6)瑞典ASES公司设计的曾用于驱动潜艇的液氨一液氧燃料电池的示意图如下,则该燃料电池工作时的总反应方程式为___________ 。
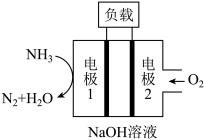
(7)燃料电池的工作原理是将燃料和氧化剂(如 )反应所放出的化学能直接转化为电能。现设计一燃料电池,以C为电极,
)反应所放出的化学能直接转化为电能。现设计一燃料电池,以C为电极, 为燃料,采用氢氧化钠溶液为电解液,电池工作时消耗
为燃料,采用氢氧化钠溶液为电解液,电池工作时消耗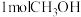 ,则电路中通过
,则电路中通过___________ mol电子。
(8)请设计一个简单原电池,证明氧化性 ,则负极材料为
,则负极材料为___________ ,正极电极反应式为___________ 。
 晶体。将此小烧杯放在事先滴有3~4滴水的玻璃片上,然后向小烧杯中加入
晶体。将此小烧杯放在事先滴有3~4滴水的玻璃片上,然后向小烧杯中加入 晶体,并用玻璃棒快速搅拌。
晶体,并用玻璃棒快速搅拌。
(1)该实验中观察到的现象除产生刺激性气味的气体及反应混合物呈糊状以外,还有
(2)该反应为
(3)实验中要用玻璃棒搅拌的原因是
Ⅱ.
(4)现有如下两个反应:A.
 ,B.
,B. 。判断上述两个反应中能设计成原电池的是
。判断上述两个反应中能设计成原电池的是(5)将纯锌片和纯铜片按图中方式插入100mL相同浓度的稀硫酸中一段时间,回答下列问题:

①下列说法正确的是
A.甲、乙均为化学能转变为电能的装置 B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少 D.两烧杯中溶液的pH均增大
②在相同时间内,两烧杯中产生气泡的速度:甲
③请写出图中构成原电池的负极电极反应式:
(6)瑞典ASES公司设计的曾用于驱动潜艇的液氨一液氧燃料电池的示意图如下,则该燃料电池工作时的总反应方程式为

(7)燃料电池的工作原理是将燃料和氧化剂(如
 )反应所放出的化学能直接转化为电能。现设计一燃料电池,以C为电极,
)反应所放出的化学能直接转化为电能。现设计一燃料电池,以C为电极, 为燃料,采用氢氧化钠溶液为电解液,电池工作时消耗
为燃料,采用氢氧化钠溶液为电解液,电池工作时消耗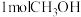 ,则电路中通过
,则电路中通过(8)请设计一个简单原电池,证明氧化性
 ,则负极材料为
,则负极材料为
您最近一年使用:0次
4 . 回答下列问题:
(1)现有下列四个化学反应:
A.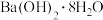 + 2NH4Cl
+ 2NH4Cl BaCl2 + 2NH3↑+ 10H2O
BaCl2 + 2NH3↑+ 10H2O
B. 4NH3 + 3O2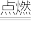 2N2+6H2O
2N2+6H2O
C.


D.
①上述四个反应中属于氧化还原反应且反应过程中能量变化符合下图所示的是_______  填字母
填字母 。
。

②上述四个反应中能设计成原电池的是_______  填字母
填字母 。
。
(2)为了验证 与
与 氧化性强弱,设计一个装置,下列装置中既能观察到电流表指针发生了偏转又能达到实验目的是
氧化性强弱,设计一个装置,下列装置中既能观察到电流表指针发生了偏转又能达到实验目的是_______  填字母
填字母 。
。

(3)燃料电池是一种高效、环境友好的供电装置,甲烷燃料电池原理示意图如下,请回答下列问题:

①该电池的负极的电极反应式是_______ 。
②已知甲烷与氧气完全反应时,每生成 液态水释放的能量约为400kJ。又知该甲烷燃料电池每发
液态水释放的能量约为400kJ。又知该甲烷燃料电池每发 电能生成
电能生成 水,则该电池的能量转化率为
水,则该电池的能量转化率为_______ % 。
。
(4)高铁电池是一种新型可充电电池,与普通电池相比,该电池能较长时间保持稳定的放电电压。高铁电池放电时的总反应式为 。则高铁电池放电时正极的电极反应式是
。则高铁电池放电时正极的电极反应式是_______ 。
(1)现有下列四个化学反应:
A.
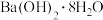 + 2NH4Cl
+ 2NH4Cl BaCl2 + 2NH3↑+ 10H2O
BaCl2 + 2NH3↑+ 10H2OB. 4NH3 + 3O2
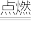 2N2+6H2O
2N2+6H2OC.



D.

①上述四个反应中属于氧化还原反应且反应过程中能量变化符合下图所示的是
 填字母
填字母 。
。
②上述四个反应中能设计成原电池的是
 填字母
填字母 。
。(2)为了验证
 与
与 氧化性强弱,设计一个装置,下列装置中既能观察到电流表指针发生了偏转又能达到实验目的是
氧化性强弱,设计一个装置,下列装置中既能观察到电流表指针发生了偏转又能达到实验目的是 填字母
填字母 。
。
(3)燃料电池是一种高效、环境友好的供电装置,甲烷燃料电池原理示意图如下,请回答下列问题:

①该电池的负极的电极反应式是
②已知甲烷与氧气完全反应时,每生成
 液态水释放的能量约为400kJ。又知该甲烷燃料电池每发
液态水释放的能量约为400kJ。又知该甲烷燃料电池每发 电能生成
电能生成 水,则该电池的能量转化率为
水,则该电池的能量转化率为 。
。(4)高铁电池是一种新型可充电电池,与普通电池相比,该电池能较长时间保持稳定的放电电压。高铁电池放电时的总反应式为
 。则高铁电池放电时正极的电极反应式是
。则高铁电池放电时正极的电极反应式是
您最近一年使用:0次
名校
5 . 化学反应常伴随热效应。某些反应(如中和反应)的热量变化,其数值Q可通过量热装置测量反应前后体系温度变化,用公式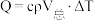 计算获得。
计算获得。
(1)热量的测定:取50 mL 0.5 mol/L盐酸、50 mL 0.55 mol/L NaOH溶液和如图所示装置进行中和热的测定实验。

①从实验装置上看,图中缺少的一种玻璃仪器是___________ 。
②测得反应前后体系的温度值(℃)分别为 、
、 ,则该过程放出的热量为
,则该过程放出的热量为___________ J(c和 分别取
分别取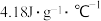 和
和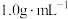 )。
)。
③如果改用60 mL 1.0 mol/L盐酸跟50 mL 1.1 mol/L NaOH溶液进行反应,则与上述实验相比,所放热量___________ (填“增加”“减少”或“不变”);所求中和热数值___________ (填“增加”“减少”或“不变”)。
(2)借鉴(1)的方法,甲同学测量放热反应 焓变
焓变 (忽略温度对焓变的影响,下同)。实验结果见下表。
(忽略温度对焓变的影响,下同)。实验结果见下表。
①温度:b___________ c(填“>”“<”或“=”)。
②
___________ (选择表中一组数据计算)。结果表明,该方法可行。
(3)乙同学也借鉴(1)的方法,测量反应A: 的焓变。
的焓变。
查阅资料:配制 溶液时需加入酸。
溶液时需加入酸。
①提出猜想:Fe粉与 溶液混合,在反应A进行的过程中,可能存在Fe粉和酸的反应。
溶液混合,在反应A进行的过程中,可能存在Fe粉和酸的反应。
验证猜想:用pH试纸测得 溶液的pH不大于1;向少量
溶液的pH不大于1;向少量 溶液中加入Fe粉,溶液颜色变浅的同时有气泡冒出,说明存在反应A和
溶液中加入Fe粉,溶液颜色变浅的同时有气泡冒出,说明存在反应A和___________ (用离子方程式表示)。
实验小结:猜想成立,不能直接测反应A的焓变。
教师指导:鉴于以上问题,特别是气体生成带来的干扰,需要设计出实验过程中无气体生成的实验方案。
②优化设计:乙同学根据相关原理,重新设计了优化的实验方案,获得了反应A的焓变。该方案为______________________ 。
(4)化学能可转化为热能,写出其在生产或生活中的一种应用___________ 。
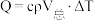 计算获得。
计算获得。(1)热量的测定:取50 mL 0.5 mol/L盐酸、50 mL 0.55 mol/L NaOH溶液和如图所示装置进行中和热的测定实验。

①从实验装置上看,图中缺少的一种玻璃仪器是
②测得反应前后体系的温度值(℃)分别为
 、
、 ,则该过程放出的热量为
,则该过程放出的热量为 分别取
分别取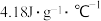 和
和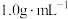 )。
)。③如果改用60 mL 1.0 mol/L盐酸跟50 mL 1.1 mol/L NaOH溶液进行反应,则与上述实验相比,所放热量
(2)借鉴(1)的方法,甲同学测量放热反应
 焓变
焓变 (忽略温度对焓变的影响,下同)。实验结果见下表。
(忽略温度对焓变的影响,下同)。实验结果见下表。| 序号 | 反应试剂 | 体系温度/℃ | ||
| 反应前 | 反应后 | |||
| i |   溶液100mL 溶液100mL | 1.20g Fe粉 | a | b |
| ii | 0.56g Fe粉 | a | c | |
②

(3)乙同学也借鉴(1)的方法,测量反应A:
 的焓变。
的焓变。查阅资料:配制
 溶液时需加入酸。
溶液时需加入酸。①提出猜想:Fe粉与
 溶液混合,在反应A进行的过程中,可能存在Fe粉和酸的反应。
溶液混合,在反应A进行的过程中,可能存在Fe粉和酸的反应。验证猜想:用pH试纸测得
 溶液的pH不大于1;向少量
溶液的pH不大于1;向少量 溶液中加入Fe粉,溶液颜色变浅的同时有气泡冒出,说明存在反应A和
溶液中加入Fe粉,溶液颜色变浅的同时有气泡冒出,说明存在反应A和实验小结:猜想成立,不能直接测反应A的焓变。
教师指导:鉴于以上问题,特别是气体生成带来的干扰,需要设计出实验过程中无气体生成的实验方案。
②优化设计:乙同学根据相关原理,重新设计了优化的实验方案,获得了反应A的焓变。该方案为
(4)化学能可转化为热能,写出其在生产或生活中的一种应用
您最近一年使用:0次
2023-09-09更新
|
162次组卷
|
3卷引用:浙江省宁波市北仑中学2023-2024学年高二上学期期初考试化学试题
6 . 在寒冷的冬季,我们可以通过取暖器、电热炉,暖宝宝等来取暖。请查阅资料,设计一个通过化学反应产生热量的暖手袋的制作方案______ 。
您最近一年使用:0次
7 . 某化学兴趣小组进行了实验:向2支试管中分别加入0.5 g Na2CO3固体和0.5 gNaHCO3固体,再分别加入30 mL 0.3 mol·L-1盐酸,充分反应后,用手触摸试管,明显感觉到加Na2CO3固体的试管变热了,加NaHCO3固体的试管变冷了。甲同学由此得出结论:CO (aq) +2H+ (aq)=H2O(1) +CO2(g)△H1<0, HCO
(aq) +2H+ (aq)=H2O(1) +CO2(g)△H1<0, HCO (aq)+H+ (aq)=H2O(1) +CO2(g) △H2>0。回答下列问题:
(aq)+H+ (aq)=H2O(1) +CO2(g) △H2>0。回答下列问题:
(1)乙同学认为该实验不一定能得到甲同学的结论,你支持谁的观点?_____ (填“甲”或“乙”) ,理由是_______ 。
(2)查阅资料:
反应I :CO (aq) +2H+ (aq)=H2O(l) +CO2(g) △H1= -12.14kJ· mol-1;
(aq) +2H+ (aq)=H2O(l) +CO2(g) △H1= -12.14kJ· mol-1;
反应II :HCO (aq) +H+ (aq)=H2O(l) +CO2(g) △H2= +12.64 kJ·mol-1。
(aq) +H+ (aq)=H2O(l) +CO2(g) △H2= +12.64 kJ·mol-1。
向V mLc mol· L-1碳酸钠溶液中,逐滴加入2V mLc mol·L-1稀盐酸。下列图象中,能正确表示该反应过程中的能量变化的是 (填标号)。
(3)该化学兴趣小组用如图所示装置设计了实验,验证碳酸钠、碳酸氢钠分别与稀盐酸反应的热效应。
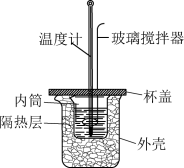
表格一:
表格二:
表格三:
实验操作:将试剂1与试剂2混合,测混合后溶液的温度,静置,冷却至定温,再将试剂3与之前的混合溶液混合,再测混合溶液的温度。
①实验中玻璃搅拌器的使用方法是_______________ 。
②表格二对应实验得出的结论是________________ 。
③反应III:Na2CO3(s) +2H+ (aq)=2Na+ (aq) +H2O(1) +CO2(g) △H3;
反应IV:NaHCO3(s)+ H+ (aq)=Na+ (aq) + H2O(l) +CO2(g) △H4。
则△H1______ (填“>”、“< ”或“=”,下同) △H3,△H2______ △H4。
 (aq) +2H+ (aq)=H2O(1) +CO2(g)△H1<0, HCO
(aq) +2H+ (aq)=H2O(1) +CO2(g)△H1<0, HCO (aq)+H+ (aq)=H2O(1) +CO2(g) △H2>0。回答下列问题:
(aq)+H+ (aq)=H2O(1) +CO2(g) △H2>0。回答下列问题:(1)乙同学认为该实验不一定能得到甲同学的结论,你支持谁的观点?
(2)查阅资料:
反应I :CO
 (aq) +2H+ (aq)=H2O(l) +CO2(g) △H1= -12.14kJ· mol-1;
(aq) +2H+ (aq)=H2O(l) +CO2(g) △H1= -12.14kJ· mol-1;反应II :HCO
 (aq) +H+ (aq)=H2O(l) +CO2(g) △H2= +12.64 kJ·mol-1。
(aq) +H+ (aq)=H2O(l) +CO2(g) △H2= +12.64 kJ·mol-1。向V mLc mol· L-1碳酸钠溶液中,逐滴加入2V mLc mol·L-1稀盐酸。下列图象中,能正确表示该反应过程中的能量变化的是 (填标号)。
A.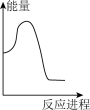 | B.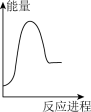 | C.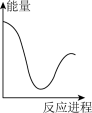 | D.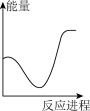 |

表格一:
试剂1 | 试剂2混合前温度/℃ | 混合后温度/℃ |
0.5 g Na2CO3 | 40mL HCl 19.0 | 21.7 |
0.5 g NaHCO3 | 40 mL HCl 19.0 | 18.1 |
表格二:
试剂1 | 试剂2混合 前温度/℃ | 溶解后温 度/℃ | 静置后的 温度/℃ | 试剂3混合 前温度/℃ | 混合后 温度/℃ |
0.5 g Na2CO3 | 10 mL H2O19.0 | 22. 3 | 19.0 | 10mL H2O 19.0 | 19.0 |
0.5 g NaHCO3 | 10 mL H2O19.0 | 17.5 | 19.0 | 10 mL H2O 19.0 | 19.0 |
表格三:
试剂1 | 试剂2混合 前温度/℃ | 溶解后温 度/℃ | 静置后的 温度/℃ | 试剂3混合 前温度/℃ | 混合后 温度/℃ |
0.5 g Na2CO3 | 10 mL H2O19.0 | 22.3 | 19.0 | 10mL HCl 19.0 | 20.5 |
0.5 g NaHCO3 | 10 mL H2O19.0 | 17.5 | 19.0 | 10 mL HCl19.0 | 18.3 |
实验操作:将试剂1与试剂2混合,测混合后溶液的温度,静置,冷却至定温,再将试剂3与之前的混合溶液混合,再测混合溶液的温度。
①实验中玻璃搅拌器的使用方法是
②表格二对应实验得出的结论是
③反应III:Na2CO3(s) +2H+ (aq)=2Na+ (aq) +H2O(1) +CO2(g) △H3;
反应IV:NaHCO3(s)+ H+ (aq)=Na+ (aq) + H2O(l) +CO2(g) △H4。
则△H1
您最近一年使用:0次
8 . 化学反应中伴随着能量变化,探究各种能量变化是一永恒的主题。
(1)下列变化属于放热反应的是___________ 。 填序号
填序号
 生石灰溶于水
生石灰溶于水  浓硫酸稀释
浓硫酸稀释  氢氧化钠固体溶于水
氢氧化钠固体溶于水  铜溶于浓硝酸
铜溶于浓硝酸  氯化铵固体与氢氧化钡晶体混合搅拌
氯化铵固体与氢氧化钡晶体混合搅拌  过氧化钠溶于水
过氧化钠溶于水
(2) 分解时的能量变化关系如下图甲所示,则
分解时的能量变化关系如下图甲所示,则 分解反应为
分解反应为 ___________ 反应 选填:吸热、放热
选填:吸热、放热 。查阅资料得知:将作为催化剂的
。查阅资料得知:将作为催化剂的 溶液加入
溶液加入 溶液后,溶液中会发生两个氧化还原反应,且两个反应中
溶液后,溶液中会发生两个氧化还原反应,且两个反应中 均参加了反应,试从催化剂的角度分析,这两个氧化还原反应的离子方程式分别是:
均参加了反应,试从催化剂的角度分析,这两个氧化还原反应的离子方程式分别是: 和
和 ___________ 。
(3)如下图乙是某化学兴趣小组探究不同条件下化学能转变为电能的装置。
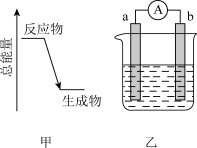
①当电极a为镁,电极b为铝,电解质溶液为氢氧化钠溶液时,该电池的负极为___________ 。 填名称
填名称
②燃料电池的工作原理是将燃料和氧化剂 反应所产生的化学能直接转化为电能。现设计一燃料电池,电极a通入氢气燃料,采用氢氧化钠溶液为电解液,b极的电极反应式为
反应所产生的化学能直接转化为电能。现设计一燃料电池,电极a通入氢气燃料,采用氢氧化钠溶液为电解液,b极的电极反应式为 ___________ 。
③质量相同的铜棒和铁棒用导线连接后插入 溶液中,一段时间后,取出洗净、干燥、称量,二者质量差为12g,则导线中通过的电子的物质的量为
溶液中,一段时间后,取出洗净、干燥、称量,二者质量差为12g,则导线中通过的电子的物质的量为 ___________ 。
(1)下列变化属于放热反应的是
 填序号
填序号
 生石灰溶于水
生石灰溶于水  浓硫酸稀释
浓硫酸稀释  氢氧化钠固体溶于水
氢氧化钠固体溶于水  铜溶于浓硝酸
铜溶于浓硝酸  氯化铵固体与氢氧化钡晶体混合搅拌
氯化铵固体与氢氧化钡晶体混合搅拌  过氧化钠溶于水
过氧化钠溶于水(2)
 分解时的能量变化关系如下图甲所示,则
分解时的能量变化关系如下图甲所示,则 分解反应为
分解反应为  选填:吸热、放热
选填:吸热、放热 。查阅资料得知:将作为催化剂的
。查阅资料得知:将作为催化剂的 溶液加入
溶液加入 溶液后,溶液中会发生两个氧化还原反应,且两个反应中
溶液后,溶液中会发生两个氧化还原反应,且两个反应中 均参加了反应,试从催化剂的角度分析,这两个氧化还原反应的离子方程式分别是:
均参加了反应,试从催化剂的角度分析,这两个氧化还原反应的离子方程式分别是: 和
和 (3)如下图乙是某化学兴趣小组探究不同条件下化学能转变为电能的装置。

①当电极a为镁,电极b为铝,电解质溶液为氢氧化钠溶液时,该电池的负极为
 填名称
填名称
②燃料电池的工作原理是将燃料和氧化剂
 反应所产生的化学能直接转化为电能。现设计一燃料电池,电极a通入氢气燃料,采用氢氧化钠溶液为电解液,b极的电极反应式为
反应所产生的化学能直接转化为电能。现设计一燃料电池,电极a通入氢气燃料,采用氢氧化钠溶液为电解液,b极的电极反应式为 ③质量相同的铜棒和铁棒用导线连接后插入
 溶液中,一段时间后,取出洗净、干燥、称量,二者质量差为12g,则导线中通过的电子的物质的量为
溶液中,一段时间后,取出洗净、干燥、称量,二者质量差为12g,则导线中通过的电子的物质的量为
您最近一年使用:0次
9 . 一种脱氧食品保鲜剂可以吸收水和氧气,主要成分为还原性铁粉、碱性粒子(生石灰)、无机盐(氯化钠)、活性炭等。下列有关分析正确的是
| A.保鲜剂中的无机盐和生石灰都有吸水作用 |
| B.保鲜剂在吸收水时,发生了吸热反应 |
| C.保鲜剂在吸收氧气的过程中,铁粉做原电池的正极 |
D.保鲜剂在吸收氧气的过程中,炭粉上发生的反应为 |
您最近一年使用:0次
解题方法
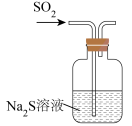
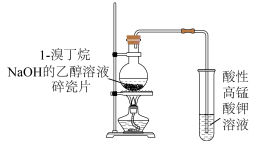
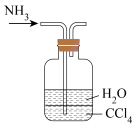
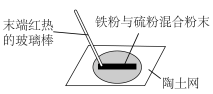
10 . 利用下列装置进行实验,不能达到实验目的的是
|
|
A.验证 氧化性 氧化性 | B.验证1-溴丁烷的消去反应 |
|
|
| C.制氨水 | D.证明Fe与S反应放热 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次