名校
解题方法
1 . 回答下列问题
I.已知H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ/mol。回答有关中和反应的问题。
(1)用0.1molBa(OH)2配成稀溶液与足量稀硝酸反应,能放出_______ kJ热量。
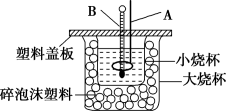
(2)如图装置中仪器A的名称_______ ,作用是_______ ;仪器B的名称_______ ,作用是_______ ;碎泡沫塑料的作用是_______ 。若通过实验测定中和热的ΔH,其结果常常大于-57.3kJ/mol,其原因可能是_______ 。
II.已知某反应A(g)+B(g)⇌C(g)+D(g),反应过程中的能量变化如图所示。
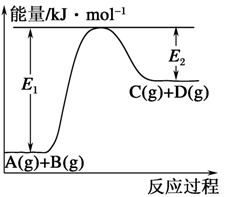
(3)该反应是_______ 反应(填“吸热”或“放热”),该反应的ΔH=_______ kJ·mol-1(用含E1、E2的代数式表示),1mol气体A和1mol气体B具有的总能量比1mol气体C和1mol气体D具有的总能量_______ (填“高”、“低”或“高低不一定”)。
I.已知H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ/mol。回答有关中和反应的问题。
(1)用0.1molBa(OH)2配成稀溶液与足量稀硝酸反应,能放出
(2)如图装置中仪器A的名称

II.已知某反应A(g)+B(g)⇌C(g)+D(g),反应过程中的能量变化如图所示。

(3)该反应是
您最近一年使用:0次
名校
2 . (Ⅰ)已知氮化硅陶瓷材料可由石英固体与焦炭颗粒在高温的氮气流中通过如下反应制得:SiO2+C+N2 Si3N4+CO(未配平)。该反应过程中的能量变化如图所示。回答以下问题:
Si3N4+CO(未配平)。该反应过程中的能量变化如图所示。回答以下问题:

(1)该反应中的氧化剂是___ 。
(2)该反应是___ (填“吸热反应”或“放热反应”),ΔH=___ 。
(3)若反应中测得生成4.48LCO气体(标准状况下),则转移的电子数为___ 。
(Ⅱ)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(4)如图是N2(g)和H2(g)反应生成1molNH3(g)过程中能量的变化示意图,请写出N2和H2反应的热化学方程式:___ 。

(5)若已知下列数据:
试根据表中及图中数据计算N—H的键能:____ kJ·mol-1。
(6)用NH3催化还原NOx还可以消除氮氧化物的污染。已知:
4NH3(g)+3O2(g)=2N2+6H2O(g) ΔH1=-akJ·mol-1①
N2(g)+O2(g)=2NO(g) ΔH2=-bkJ·mol-1②
求:若1molNH3还原NO至N2,则该反应过程中的反应热ΔH3=___ kJ·mol-1(用含a、b的式子表示)。
(7)捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g) (NH4)2CO3(aq) ΔH1
(NH4)2CO3(aq) ΔH1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g) NH4HCO3(aq) ΔH2
NH4HCO3(aq) ΔH2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g) 2NH4HCO3(aq) ΔH3
2NH4HCO3(aq) ΔH3
请回答下列问题:ΔH3与ΔH1、ΔH2之间的关系是ΔH3=___ 。
 Si3N4+CO(未配平)。该反应过程中的能量变化如图所示。回答以下问题:
Si3N4+CO(未配平)。该反应过程中的能量变化如图所示。回答以下问题:
(1)该反应中的氧化剂是
(2)该反应是
(3)若反应中测得生成4.48LCO气体(标准状况下),则转移的电子数为
(Ⅱ)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(4)如图是N2(g)和H2(g)反应生成1molNH3(g)过程中能量的变化示意图,请写出N2和H2反应的热化学方程式:

(5)若已知下列数据:
| 化学键 | H—H | N≡N |
| 键能/kJ·mol-1 | 435 | 943 |
(6)用NH3催化还原NOx还可以消除氮氧化物的污染。已知:
4NH3(g)+3O2(g)=2N2+6H2O(g) ΔH1=-akJ·mol-1①
N2(g)+O2(g)=2NO(g) ΔH2=-bkJ·mol-1②
求:若1molNH3还原NO至N2,则该反应过程中的反应热ΔH3=
(7)捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g)
 (NH4)2CO3(aq) ΔH1
(NH4)2CO3(aq) ΔH1反应Ⅱ:NH3(l)+H2O(l)+CO2(g)
 NH4HCO3(aq) ΔH2
NH4HCO3(aq) ΔH2反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)
 2NH4HCO3(aq) ΔH3
2NH4HCO3(aq) ΔH3请回答下列问题:ΔH3与ΔH1、ΔH2之间的关系是ΔH3=
您最近一年使用:0次
解题方法
3 . 回答下列问题
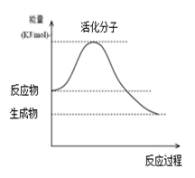
(1)图为某化学反应中的能量变化图。该反应是_______ (填“吸热”或“放热”)反应。
(2)实验测得16 g甲醇[CH3OH(l)]在氧气中充分燃烧生成二氧化碳气体和液态水时释放363.25kJ的热量,试写出该反应的热化学方程式_______ 。
(3)从化学键的角度分析,化学反应的过程就是反应物的化学键被破坏和生成物的化学键的形成过程。已知反应:N2(g)+3H2(g)⇌2NH3(g) ∆H=akJ/mol。有关键能数据如表:
试根据表中所列键能数据估算a的数值_______ 。
(1)图为某化学反应中的能量变化图。该反应是

(2)实验测得16 g甲醇[CH3OH(l)]在氧气中充分燃烧生成二氧化碳气体和液态水时释放363.25kJ的热量,试写出该反应的热化学方程式
(3)从化学键的角度分析,化学反应的过程就是反应物的化学键被破坏和生成物的化学键的形成过程。已知反应:N2(g)+3H2(g)⇌2NH3(g) ∆H=akJ/mol。有关键能数据如表:
| 化学键 | H-H | N-H | N N N |
| 键能(kJ/mol) | 436 | 391 | 945 |
试根据表中所列键能数据估算a的数值
您最近一年使用:0次
名校
4 . 一种用于食品加热的发热包,主要成分为 CaO.铝粉.Na2CO3.使用时向发热包加适量水,就能持续放热,温度可达 100∘C以上。可能发生的反应如下:
i.CaO+H2O=Ca(OH)2
ⅱ.Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
ⅲ.2A1+2H2O+2NaOH=2NaAlO2+3H2↑
(1)上述反应的所有物质中,属于盐的是_______ (填化学式)。
(2)属于复分解反应的是_______ (填序号)。
(3)有元素化合价变化的反应是_______ (填序号)。
(4)发热包加适量水后温度可达 100∘C 以上,请解释_______ (写出一点即可)。
i.CaO+H2O=Ca(OH)2
ⅱ.Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
ⅲ.2A1+2H2O+2NaOH=2NaAlO2+3H2↑
(1)上述反应的所有物质中,属于盐的是
(2)属于复分解反应的是
(3)有元素化合价变化的反应是
(4)发热包加适量水后温度可达 100∘C 以上,请解释
您最近一年使用:0次
2021-10-14更新
|
173次组卷
|
2卷引用:四川省内江市第一中学2021-2022学年高一上学期期中考试化学试题
解题方法
5 . 回答下列问题:
(1)结合钠与水的反应现象,从能量变化的角度看,钠与水的反应属于___________ 反应。
(2)以硫酸铜为电解质溶液的银锌原电池中,银片上观察到的现象是___________ ;锌电极的反应式为___________ 。
(3)将一定量的A气体和B气体在 的密闭容器中混合并在一定条件下发生反应:
的密闭容器中混合并在一定条件下发生反应:
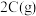 ,反应
,反应 后测得
后测得 的浓度为
的浓度为 。
。
①用物质 表示的平均反应速率为
表示的平均反应速率为___________  。
。
②其他条件不变时,再通入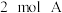 气体该反应的正反应速率将
气体该反应的正反应速率将___________ (填“增大”“不变”或“减小”)。
(1)结合钠与水的反应现象,从能量变化的角度看,钠与水的反应属于
(2)以硫酸铜为电解质溶液的银锌原电池中,银片上观察到的现象是
(3)将一定量的A气体和B气体在
 的密闭容器中混合并在一定条件下发生反应:
的密闭容器中混合并在一定条件下发生反应: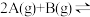
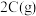 ,反应
,反应 后测得
后测得 的浓度为
的浓度为 。
。①用物质
 表示的平均反应速率为
表示的平均反应速率为 。
。②其他条件不变时,再通入
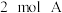 气体该反应的正反应速率将
气体该反应的正反应速率将
您最近一年使用:0次
名校
解题方法
6 . 回答下列问题:
(1)在微生物作用的条件下,NH 经过两步反应被氧化成NO
经过两步反应被氧化成NO 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下:

①第一步反应是___________ (填“放热”或“吸热”)反应。
② 全部氧化成
全部氧化成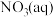 的热化学方程式是
的热化学方程式是___________ 。
(2)化学反应中的焓变与反应物和生成物的键能(E)有关。 、
、 下,已知1g氢气完全燃烧生成液态水时放出
下,已知1g氢气完全燃烧生成液态水时放出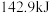 的热量,表示氢气燃烧热的热化学方程式是
的热量,表示氢气燃烧热的热化学方程式是___________ 。已知:E(H-H)=436kJ/mol,E(O=O)=498 kJ/mol,则E(H-O)=___________ 。
(3)纳米级Cu2O由于具有优良的催化性能而受到关注。已知:
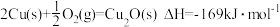 ;
;
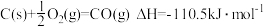 ;
;
 。
。
则工业上用炭粉在高温条件下还原CuO制取Cu2O和CO的热化学方程式为___________ 。若反应过程中转移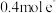 ,则该反应吸收的热量为
,则该反应吸收的热量为___________ kJ。
(4)充分燃烧一定量的丁烷 放出的热量大小为Q生成的CO2恰好与
放出的热量大小为Q生成的CO2恰好与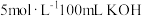 溶液完全反应生成正盐。则完全燃烧1mol丁烷放出的热量X=
溶液完全反应生成正盐。则完全燃烧1mol丁烷放出的热量X=___________ 。
(1)在微生物作用的条件下,NH
 经过两步反应被氧化成NO
经过两步反应被氧化成NO 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下:
①第一步反应是
②
 全部氧化成
全部氧化成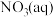 的热化学方程式是
的热化学方程式是(2)化学反应中的焓变与反应物和生成物的键能(E)有关。
 、
、 下,已知1g氢气完全燃烧生成液态水时放出
下,已知1g氢气完全燃烧生成液态水时放出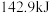 的热量,表示氢气燃烧热的热化学方程式是
的热量,表示氢气燃烧热的热化学方程式是(3)纳米级Cu2O由于具有优良的催化性能而受到关注。已知:
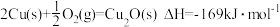 ;
;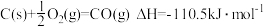 ;
; 。
。则工业上用炭粉在高温条件下还原CuO制取Cu2O和CO的热化学方程式为
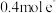 ,则该反应吸收的热量为
,则该反应吸收的热量为(4)充分燃烧一定量的丁烷
 放出的热量大小为Q生成的CO2恰好与
放出的热量大小为Q生成的CO2恰好与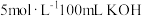 溶液完全反应生成正盐。则完全燃烧1mol丁烷放出的热量X=
溶液完全反应生成正盐。则完全燃烧1mol丁烷放出的热量X=
您最近一年使用:0次
解题方法
7 . 为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施。化学反应的焓变通常用实验进行测定,也可进行理论推算。
(1)下列变化过程,属于放热反应的是_______
①浓H2SO4稀释;②酸碱中和反应;③H2在Cl2中燃烧;④固体NaOH溶于水;⑤液态水变成水蒸气;⑥碳高温条件下还原CO2。
(2)实验测得,标准状况下11.2 L甲烷在氧气中充分燃烧生成液态水和二氧化碳气体时释放出 的热量,试写出表示甲烷燃烧热的热化学方程式:
的热量,试写出表示甲烷燃烧热的热化学方程式:_______ ;
(3)捕碳技术(主要指捕获CO2在降低温室气体排放中具有重要的作用。目前NH3和 已经被用作工业捕碳剂,它们与CO2可发生如下反应:
已经被用作工业捕碳剂,它们与CO2可发生如下反应:
反应Ⅰ: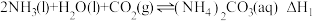
反应Ⅱ:
反应Ⅲ: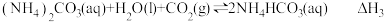
则 与
与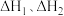 与之间的关系为
与之间的关系为
_______ ;
(4)已知反应 ,试根据表中所列键能数据估算a的值
,试根据表中所列键能数据估算a的值_______ 。
(1)下列变化过程,属于放热反应的是
①浓H2SO4稀释;②酸碱中和反应;③H2在Cl2中燃烧;④固体NaOH溶于水;⑤液态水变成水蒸气;⑥碳高温条件下还原CO2。
(2)实验测得,标准状况下11.2 L甲烷在氧气中充分燃烧生成液态水和二氧化碳气体时释放出
 的热量,试写出表示甲烷燃烧热的热化学方程式:
的热量,试写出表示甲烷燃烧热的热化学方程式:(3)捕碳技术(主要指捕获CO2在降低温室气体排放中具有重要的作用。目前NH3和
 已经被用作工业捕碳剂,它们与CO2可发生如下反应:
已经被用作工业捕碳剂,它们与CO2可发生如下反应:反应Ⅰ:
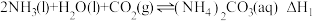
反应Ⅱ:

反应Ⅲ:
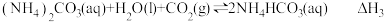
则
 与
与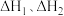 与之间的关系为
与之间的关系为
(4)已知反应
 ,试根据表中所列键能数据估算a的值
,试根据表中所列键能数据估算a的值| 化学键 |  |  |  |
键能/ | 436 | 391 | 945 |
您最近一年使用:0次
2021-10-13更新
|
645次组卷
|
2卷引用:山东省德州市夏津第一中学2021-2022学年高二上学期第一次月考化学试卷
解题方法
8 . 已知下列热化学方程式:
①2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ/mol
②C(s)+O2(g)=CO2(g) ΔH=-393.5kJ/mol
③C(s)+H2O(g)=CO(g)+H2(g) ΔH=+131.5kJ/mol
请回答:
(1)上述反应中属于放热反应的是_____ (填序号,下同),属于吸热反应的是_______ 。
(2)2gH2完全燃烧生成液态水,放出的热量为_______ 。
(3)依据事实,写出下列反应的热化学方程式。
①1molN2(g)与适量O2(g)反应生成NO(g),需吸收68kJ的热量,该反应的热化学方程式为_____ 。
②在25℃、101kpa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为_______ 。
①2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ/mol
②C(s)+O2(g)=CO2(g) ΔH=-393.5kJ/mol
③C(s)+H2O(g)=CO(g)+H2(g) ΔH=+131.5kJ/mol
请回答:
(1)上述反应中属于放热反应的是
(2)2gH2完全燃烧生成液态水,放出的热量为
(3)依据事实,写出下列反应的热化学方程式。
①1molN2(g)与适量O2(g)反应生成NO(g),需吸收68kJ的热量,该反应的热化学方程式为
②在25℃、101kpa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为
您最近一年使用:0次
2021-10-12更新
|
93次组卷
|
2卷引用:甘肃省靖远县二中2021-2022学年高二上学期第一次月考化学试题
9 . 下图是H2(g)+Cl2(g)=2HCl(g)反应过程中的能量变化图。

(1)由图可知,1molH2(g)和1molCl2(g)的总能量___________ (填“>”、“<”或者“=”)2molHCl(g)的能量。
(2)该反应是_______ (填“吸”或者“放”)热反应,从化学键的角度进行解释_______ 。
(3)已知H-H键、N-H键、N≡N键的键能分别为436kJ/mol、391kJ/mol、946kJ/mol,关于工业合成氨的反应,请根据键能的数据判断下列问题:
若有1molNH3生成,可___________ (填“吸收”或“放出”)热量___________ kJ;该反应的能量变化可用图___________ 表示。(填“甲“或“乙”)


(1)由图可知,1molH2(g)和1molCl2(g)的总能量
(2)该反应是
(3)已知H-H键、N-H键、N≡N键的键能分别为436kJ/mol、391kJ/mol、946kJ/mol,关于工业合成氨的反应,请根据键能的数据判断下列问题:
若有1molNH3生成,可

您最近一年使用:0次
名校
解题方法
10 . 已知下列热化学方程式:
①H2(g)+ O2(g)=H2O(l);∆H=﹣285kJ/mol
O2(g)=H2O(l);∆H=﹣285kJ/mol
②H2O(g)=H2(g)+ O2(g);∆H=+241.8kJ/mol
O2(g);∆H=+241.8kJ/mol
③C(s)+ O2(g)=CO(g);∆H=﹣110.4kJ/mol
O2(g)=CO(g);∆H=﹣110.4kJ/mol
④C(s)+O2(g)=CO2(g);∆H=﹣393.5kJ/mol
回答下列各问:
(1)上述反应中属于吸热反应的是_______ 。(用序号填写)
(2)表示C的燃烧热的热化学方程式为_______ 。(用序号填写)
(3)燃烧10g H2生成液态水,放出的热量为_______ 。
(4)H2(g)+ O2(g)=H2O(g);∆H
O2(g)=H2O(g);∆H_______ ﹣285kJ/mol。(填>、<、=)
(5)CO的燃烧热的热化学方程式为_______ 。
①H2(g)+
 O2(g)=H2O(l);∆H=﹣285kJ/mol
O2(g)=H2O(l);∆H=﹣285kJ/mol②H2O(g)=H2(g)+
 O2(g);∆H=+241.8kJ/mol
O2(g);∆H=+241.8kJ/mol③C(s)+
 O2(g)=CO(g);∆H=﹣110.4kJ/mol
O2(g)=CO(g);∆H=﹣110.4kJ/mol④C(s)+O2(g)=CO2(g);∆H=﹣393.5kJ/mol
回答下列各问:
(1)上述反应中属于吸热反应的是
(2)表示C的燃烧热的热化学方程式为
(3)燃烧10g H2生成液态水,放出的热量为
(4)H2(g)+
 O2(g)=H2O(g);∆H
O2(g)=H2O(g);∆H(5)CO的燃烧热的热化学方程式为
您最近一年使用:0次



