1 . 回答下列问题
(1)某实验小组同学进行如图所示实验,以检验化学反应中的能量变化。
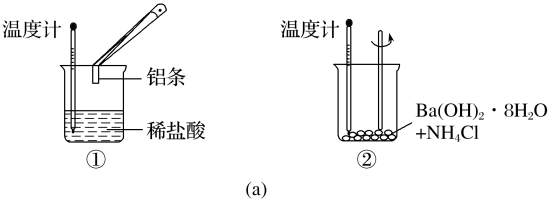
实验发现,反应后①中的温度升高,②中的温度降低。由此判断铝条与盐酸的反应是___________ 热反应,Ba(OH)2·8H2O与NH4Cl的反应是___________ 热反应。
(2)我国发射宇宙飞船的 “神舟”系列火箭用偏二甲肼(C2H8N2)作燃料,液态四氧化二氮作氧化剂,生成氮气和二氧化碳气体,其反应的化学方程式为C2H8N2+2N2O4=2CO2↑+3N2↑+4H2O。则该反应是___________ (填“放热”或“吸热”)反应,反应物的总能量___________ (填“大于”、“小于”或“等于”)生成物的总能量,断开化学键吸收的总能量___________ (填“大于”、“小于”或“等于”)形成化学键放出的总能量。
(3)矿物能源是现代人类社会赖以生存的重要物质基础,目前,全球仍主要处于化石能源时期。下列不属于化石能源的是___________。
(4)沼气是有机废弃物(树叶、秸秆、草类及垃圾、粪便等)在隔绝空气的条件下发酵分解而成的气体,主要成分是甲烷。农村沼气池中发酵后的池底剩余物是很好的沤肥。下面有关叙述中,错误的是___________。
(1)某实验小组同学进行如图所示实验,以检验化学反应中的能量变化。

实验发现,反应后①中的温度升高,②中的温度降低。由此判断铝条与盐酸的反应是
(2)我国发射宇宙飞船的 “神舟”系列火箭用偏二甲肼(C2H8N2)作燃料,液态四氧化二氮作氧化剂,生成氮气和二氧化碳气体,其反应的化学方程式为C2H8N2+2N2O4=2CO2↑+3N2↑+4H2O。则该反应是
(3)矿物能源是现代人类社会赖以生存的重要物质基础,目前,全球仍主要处于化石能源时期。下列不属于化石能源的是___________。
| A.石油 | B.煤 | C.天然气 | D.生物质能 |
| A.沼气是一种清洁的能源 |
| B.使用沼气作能源可以保护森林 |
| C.使用沼气给农民的生活带来了不便 |
| D.使用沼气是对化学能的充分利用 |
您最近一年使用:0次
2 . 现有反应:
A.CaCO3 CaO+CO2↑ B.Zn+H2SO4=ZnSO4+H2↑
CaO+CO2↑ B.Zn+H2SO4=ZnSO4+H2↑
C.C+CO2 2CO D.2KOH+H2SO4=K2SO4+2H2O
2CO D.2KOH+H2SO4=K2SO4+2H2O
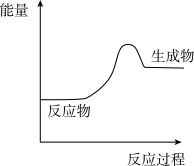
(1)上述四个反应中属于氧化还原反应且反应过程中能量变化符合如图的是_______ (填反应序号)。
(2)在常温下,上述四个反应中可用于设计原电池的是_______ (填反应序号),根据该原电池回答下列问题:
①负极发生_______ (填“氧化”或“还原”)反应;正极的电极反应式为_______ 。
②当导线中有1 mol电子通过时,理论上发生的变化是_______ (填序号)。
a.溶液增重32.5 g b.溶液增重31.5 g c.析出1g H2 d.析出11.2LH2
(3)对于反应B,将足量且等量的形状相同的锌块分别加入到等浓度等体积的两份稀硫酸X、Y中,同时向X中加入少量饱和CuSO4溶液,发生反应生成氢气的体积(V)与时间(t)的关系如图所示。
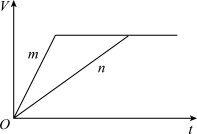
反应速率变快的原因是_______(填序号)。
A.CaCO3
 CaO+CO2↑ B.Zn+H2SO4=ZnSO4+H2↑
CaO+CO2↑ B.Zn+H2SO4=ZnSO4+H2↑C.C+CO2
 2CO D.2KOH+H2SO4=K2SO4+2H2O
2CO D.2KOH+H2SO4=K2SO4+2H2O(1)上述四个反应中属于氧化还原反应且反应过程中能量变化符合如图的是

(2)在常温下,上述四个反应中可用于设计原电池的是
①负极发生
②当导线中有1 mol电子通过时,理论上发生的变化是
a.溶液增重32.5 g b.溶液增重31.5 g c.析出1g H2 d.析出11.2LH2
(3)对于反应B,将足量且等量的形状相同的锌块分别加入到等浓度等体积的两份稀硫酸X、Y中,同时向X中加入少量饱和CuSO4溶液,发生反应生成氢气的体积(V)与时间(t)的关系如图所示。

反应速率变快的原因是_______(填序号)。
| A.CuSO4作催化剂 |
B.加入硫酸铜溶液增大了c( ) ) |
| C.Zn首先与Cu2+反应,生成的Cu与Zn、稀硫酸构成原电池 |
| D.加入硫酸铜溶液增大了溶液体积 |
您最近一年使用:0次
3 . 由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。
CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。
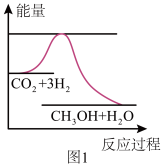
(1)该反应是___________ (填“吸热”或“放热”)反应。
(2)温度升高,CO2的转化率___________ (填“增大”、“不变”或“减小”)。
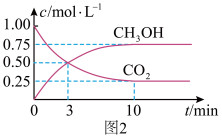
(3)为探究反应原理,现进行如下实验:在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。从反应开始到平衡,用H2浓度变化表示的平均反应速率v(H2)为___________ mol·L-1·min-1,CO2和H2的转化率比是___________
(4)下列措施中能使(3)题中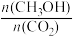 增大的有
增大的有___________ 。(填字母)
A.升高温度
B.加入催化剂
C.将H2O(g)从体系中分离
D.充入He(g),使体系总压强增大
E.再充入1molCO2和3molH2
 CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。
CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。
(1)该反应是
(2)温度升高,CO2的转化率
(3)为探究反应原理,现进行如下实验:在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。从反应开始到平衡,用H2浓度变化表示的平均反应速率v(H2)为

(4)下列措施中能使(3)题中
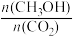 增大的有
增大的有A.升高温度
B.加入催化剂
C.将H2O(g)从体系中分离
D.充入He(g),使体系总压强增大
E.再充入1molCO2和3molH2
您最近一年使用:0次
解题方法
4 . 根据要求完成下面题目。
(1)反应Fe+H2SO4=FeSO4+H2↑的能量变化趋势如图所示:
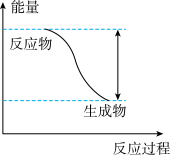
①该反应为_______ (填“吸热”或“放热”)反应。
②若将上述反应设计成原电池,铁为原电池某一极材料,则铁为:_______ (填“正”或“负”)极,该极上发生的电极反应为:_______ 。
(2)向两个1L的密闭容器中各加入活性炭(足量)和1.0molNO,发生反应为:C(s)+2NO(g) N2(g)+CO2(g)。实验测得不同温度下随着时间的变化NO和N2的物质的量变化如表示:
N2(g)+CO2(g)。实验测得不同温度下随着时间的变化NO和N2的物质的量变化如表示:
①T1时,0~5min内,以CO2表示的该反应速率v(CO2)=_______ mol·L-1·min-1
②T1时,能确定反应达到最大限度(即平衡状态)的时间是_______ min。
③容器中的温度关系为T1_______ T2(填“>”“<”或“=”)。
(1)反应Fe+H2SO4=FeSO4+H2↑的能量变化趋势如图所示:

①该反应为
②若将上述反应设计成原电池,铁为原电池某一极材料,则铁为:
(2)向两个1L的密闭容器中各加入活性炭(足量)和1.0molNO,发生反应为:C(s)+2NO(g)
 N2(g)+CO2(g)。实验测得不同温度下随着时间的变化NO和N2的物质的量变化如表示:
N2(g)+CO2(g)。实验测得不同温度下随着时间的变化NO和N2的物质的量变化如表示:| 物质的量/mol | 温度为T1/℃ | 温度为T2/℃ | |||||||
| 0 | 5min | 9min | 10min | 12min | 0 | 5min | 9min | 10min | |
| NO | 1.0 | 0.58 | 0.42 | 0.40 | 0.40 | 1.0 | 0.50 | 0.34 | 0.34 |
| N2 | 0 | 0.21 | 0.29 | 0.30 | 0.30 | 0 | 0.25 | 0.33 | 0.33 |
①T1时,0~5min内,以CO2表示的该反应速率v(CO2)=
②T1时,能确定反应达到最大限度(即平衡状态)的时间是
③容器中的温度关系为T1
您最近一年使用:0次
解题方法
5 . 现有反应:①Ba(OH)2∙8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O②Fe+H2SO4=FeSO4+H2↑。试回答下列问题:
(1)两反应中属于吸热反应的是_______ (填序号,下同),能设计成原电池的是_______ 。
(2)Fe-Cu原电池的装置如图所示。
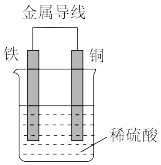
①铁作_______ (填“正极”或“负极”),溶液中H+向_______ (填“铁”或“铜”)电极方向移动。
②正极的现象是_______ ,负极的电极反应式为_______ 。
(1)两反应中属于吸热反应的是
(2)Fe-Cu原电池的装置如图所示。

①铁作
②正极的现象是
您最近一年使用:0次
解题方法
6 . 试从化学键的角度理解化学反应中的能量变化。(以2H2+O2=2H2O为例说明),已知:E反表示反应物(2H2+O2)所具有的总能量,E生表示生成物(2H2O)所具有的总能量。又知:拆开1moL H2中的化学键需要吸收436kJ能量,拆开1moL O2中的化学键需要吸收496kJ能量,形成水分子中的1moLH-O键能够释放463kJ能量。
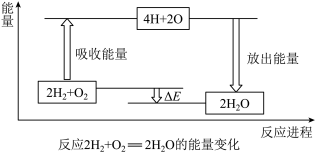
(1)宏观角度看:反应物所具有的总能量高于生成物所具有的总能量,所以该反应_______ (填“吸收”或“放出”)能量。
(2)微观角度看:断裂反应物中的化学键吸收的总能量为E吸 =_______ kJ; 形成生成物中的化学键放出的总能量为E放=_______ kJ。E吸_______ E放(填“>”或“<”),所以该反应要_______ (填“吸收”或“放出”)能量,能量变化值的大小△E=_______ kJ(填数值)

(1)宏观角度看:反应物所具有的总能量高于生成物所具有的总能量,所以该反应
(2)微观角度看:断裂反应物中的化学键吸收的总能量为E吸 =
您最近一年使用:0次
解题方法
7 . 回答下列问题:
(1)甲醛是一种重要的化工产品,可利用甲醇催化脱氢制备。甲醛与气态甲醇转化的能量关系如图所示。
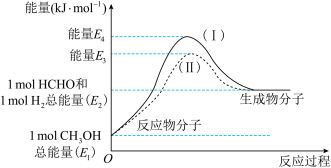
①甲醇催化脱氢转化为甲醛的反应是_______  填“吸热”或“放热”
填“吸热”或“放热” 反应。
反应。
②过程I与过程II的反应热是否相同?_______ ,原因是_______ 。
(2)在25℃、101kPa下,1g甲醇CH3OH燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为:_______ 。
(3)CH4(g)+2O2(g)=CO2 (g) +2H2O(l) △H1
CH4(g)+2O2(g)=CO2 (g) +2H2O(g) △H2
则 △H1_______ △H2(填“>”、“﹤”或“=”)
(4)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知: ① N2(g)+2O2(g)=N2O4 (l) △H1= -195.0kJ/mol
② N2H4 (l)+ O2(g)= N2(g)+ 2H2O(g) △H2= -534.2kJ/mol
写出肼和N2O4反应的热化学方程式_______ 。
(1)甲醛是一种重要的化工产品,可利用甲醇催化脱氢制备。甲醛与气态甲醇转化的能量关系如图所示。

①甲醇催化脱氢转化为甲醛的反应是
 填“吸热”或“放热”
填“吸热”或“放热” 反应。
反应。②过程I与过程II的反应热是否相同?
(2)在25℃、101kPa下,1g甲醇CH3OH燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为:
(3)CH4(g)+2O2(g)=CO2 (g) +2H2O(l) △H1
CH4(g)+2O2(g)=CO2 (g) +2H2O(g) △H2
则 △H1
(4)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知: ① N2(g)+2O2(g)=N2O4 (l) △H1= -195.0kJ/mol
② N2H4 (l)+ O2(g)= N2(g)+ 2H2O(g) △H2= -534.2kJ/mol
写出肼和N2O4反应的热化学方程式
您最近一年使用:0次
名校
解题方法
8 . 生产生活中的化学反应都伴随能量的变化,请回答下列问题。
(1)冷敷袋在日常生活中有降温、保鲜和镇痛等用途,制作冷敷袋可以利用___________ (填“放热”或“吸热”)的化学变化或物理变化。
(2)天然气中含有的微量 会腐蚀管道和设备,在
会腐蚀管道和设备,在 下进行脱硫处理,
下进行脱硫处理, 会被氧气氧化为
会被氧气氧化为 ,并产生水蒸气。
,并产生水蒸气。
写出该反应的热化学方程式:___________
(3)汽车尾气中排放的 和
和 会污染环境,在汽车尾气系统中装置催化转化器,可有效降低
会污染环境,在汽车尾气系统中装置催化转化器,可有效降低 和
和 的排放。已知:
的排放。已知:
Ⅰ.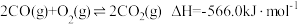
Ⅱ.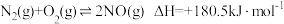
Ⅲ.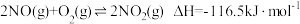
① 的燃烧热为
的燃烧热为___________  。
。
② 将
将 还原为单质的热化学方程式为
还原为单质的热化学方程式为___________ 。
③下图是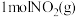 和
和 反应生成
反应生成 和
和 过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,
过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大, 的变化是
的变化是___________ (填“增大”、“减小”或“不变”,下同), 的变化是
的变化是___________ 。


(4)实验室利用如上图装置进行中和热的测定。
①图中还缺少一个玻璃仪器,名称为___________ 。
②在操作正确的前提下,提高中和热测定准确性的关键是___________ 。
(1)冷敷袋在日常生活中有降温、保鲜和镇痛等用途,制作冷敷袋可以利用
(2)天然气中含有的微量
 会腐蚀管道和设备,在
会腐蚀管道和设备,在 下进行脱硫处理,
下进行脱硫处理, 会被氧气氧化为
会被氧气氧化为 ,并产生水蒸气。
,并产生水蒸气。| 化学键 | 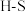 |  |  |  中共价键 中共价键 |
键能/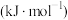 | 339 | 498 | 464 | 1083 |
写出该反应的热化学方程式:
(3)汽车尾气中排放的
 和
和 会污染环境,在汽车尾气系统中装置催化转化器,可有效降低
会污染环境,在汽车尾气系统中装置催化转化器,可有效降低 和
和 的排放。已知:
的排放。已知:Ⅰ.
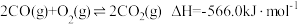
Ⅱ.
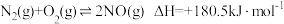
Ⅲ.
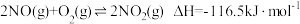
①
 的燃烧热为
的燃烧热为 。
。②
 将
将 还原为单质的热化学方程式为
还原为单质的热化学方程式为③下图是
 和
和 反应生成
反应生成 和
和 过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,
过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大, 的变化是
的变化是 的变化是
的变化是

(4)实验室利用如上图装置进行中和热的测定。
①图中还缺少一个玻璃仪器,名称为
②在操作正确的前提下,提高中和热测定准确性的关键是
您最近一年使用:0次
解题方法
9 . 回答下列问题
(1)下列反应中,属于放热反应的是__________ ,属于吸热反应的是________ 。
①水的分解 ②木炭燃烧 ③炸药爆炸 ④Ba(OH)2·8H2O与NH4Cl反应
⑤冰融化 ⑥氢气还原氧化铜 ⑦浓硫酸的稀释 ⑧酸碱中和反应
(2)已知:①CaCO3(s)=CaO+CO2(g) ΔH=+177.7 kJ·mol-1
②C(s)+H2O(g)=CO(g)+H2(g) ΔH=-131.3 kJ
③C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
④CO(g)+1/2O2(g)=CO2(g) ΔH=+ 283 kJ·mol-1
⑤H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(l) ΔH=-114.6 kJ·mol-1
⑥HNO3(aq)+NaOH(aq)=NaNO3(aq)+H2O(l) ΔH=-57.3 kJ·mol-1
⑦2H2(g)+O2(g)=2H2O(l) ΔH=-517.6 kJ·mol-1
⑧C(s)+1/2O2(g)=CO(g); △H =-393.5 kJ/mol
①上述热化学方程式中,不正确的有______________________ 。
②上述正确的热化学方程式中,表示燃烧热的热化学方程式有____________ ;表示中和热的热化学方程式有_____________________ 。
(1)下列反应中,属于放热反应的是
①水的分解 ②木炭燃烧 ③炸药爆炸 ④Ba(OH)2·8H2O与NH4Cl反应
⑤冰融化 ⑥氢气还原氧化铜 ⑦浓硫酸的稀释 ⑧酸碱中和反应
(2)已知:①CaCO3(s)=CaO+CO2(g) ΔH=+177.7 kJ·mol-1
②C(s)+H2O(g)=CO(g)+H2(g) ΔH=-131.3 kJ
③C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
④CO(g)+1/2O2(g)=CO2(g) ΔH=+ 283 kJ·mol-1
⑤H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(l) ΔH=-114.6 kJ·mol-1
⑥HNO3(aq)+NaOH(aq)=NaNO3(aq)+H2O(l) ΔH=-57.3 kJ·mol-1
⑦2H2(g)+O2(g)=2H2O(l) ΔH=-517.6 kJ·mol-1
⑧C(s)+1/2O2(g)=CO(g); △H =-393.5 kJ/mol
①上述热化学方程式中,不正确的有
②上述正确的热化学方程式中,表示燃烧热的热化学方程式有
您最近一年使用:0次
10 . I.火箭推进器中盛有强还原剂液态肼 和强氧化剂液态双氧水。当把0.4mol液态肼和0.8mol
和强氧化剂液态双氧水。当把0.4mol液态肼和0.8mol 混合反应,生成氮气和水蒸气,放出256.0kJ的热量(相当于25℃、101kPa下测得的热量)。
混合反应,生成氮气和水蒸气,放出256.0kJ的热量(相当于25℃、101kPa下测得的热量)。
(1)反应的热化学方程式为_______ 。
(2)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是___ 。
II.回答下列问题:
(3)在25℃、101kPa下,已知 气体在氧气中完全燃烧后恢复至原状态,平均每转移1mol电子放热190kJ,该反应的热化学方程式是
气体在氧气中完全燃烧后恢复至原状态,平均每转移1mol电子放热190kJ,该反应的热化学方程式是_______ 。
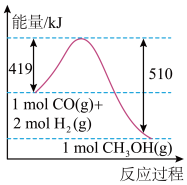
(4)根据下图写出反应的热化学方程式:_______ 。
(5)由金红石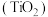 制取单质Ti的步骤为:
制取单质Ti的步骤为:
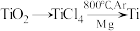
已知:I.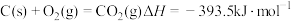
II.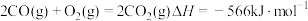
III.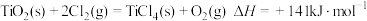
①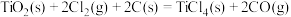 的
的 =
=_______ 。
②反应 在Ar气氛中进行的理由是
在Ar气氛中进行的理由是_______ 。
 和强氧化剂液态双氧水。当把0.4mol液态肼和0.8mol
和强氧化剂液态双氧水。当把0.4mol液态肼和0.8mol 混合反应,生成氮气和水蒸气,放出256.0kJ的热量(相当于25℃、101kPa下测得的热量)。
混合反应,生成氮气和水蒸气,放出256.0kJ的热量(相当于25℃、101kPa下测得的热量)。(1)反应的热化学方程式为
(2)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是
II.回答下列问题:
(3)在25℃、101kPa下,已知
 气体在氧气中完全燃烧后恢复至原状态,平均每转移1mol电子放热190kJ,该反应的热化学方程式是
气体在氧气中完全燃烧后恢复至原状态,平均每转移1mol电子放热190kJ,该反应的热化学方程式是(4)根据下图写出反应的热化学方程式:

(5)由金红石
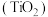 制取单质Ti的步骤为:
制取单质Ti的步骤为: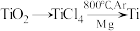
已知:I.
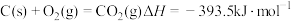
II.
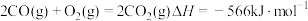
III.
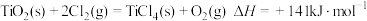
①
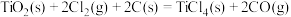 的
的 =
=②反应
 在Ar气氛中进行的理由是
在Ar气氛中进行的理由是
您最近一年使用:0次



