解题方法
1 . Ⅰ.现有部分元素的性质与原子(或分子)结构如表所示:
回答下列问题:
(1)T是_______ (填元素符号)。元素X在周期表的位置_______ 。
(2)Y与Z相比,金属性较强的是_____ (填元素符号),下列表述中能证明这一事实的是_______ (填标号)。
A.Y单质的熔点比Z单质的低
B.Y的化合价比Z的低
C.Y单质与水反应比Z单质与水反应剧烈得多
(3)Z的最高价氧化物属于_______ 氧化物(“酸性”、“碱性”或“两性”),写出Y、Z最高价氧化物对应水化物反应的离子方程式____ 。
Ⅱ.2SO2(g)+O2(g) 2SO3(g)反应过程的能量变化如图所示。
2SO3(g)反应过程的能量变化如图所示。
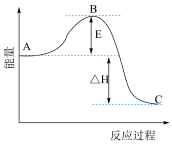
已知1mol SO2(g)氧化为1mol SO3的ΔH=-99kJ·mol-1.请回答下列问题:
(4)图中A、C分别表示_______ 、_______ 。
(5)图中△H=_______ kJ·mol-1。
(6)已知单质硫的燃烧热为296KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H_______ 。
元素 | 元素性质与原子(或分子)结构 |
| T | 最外层电子数是次外层电子数的3倍 |
| X | 常温下单质分子为双原子分子,是空气的主要成分,分子比较稳定 |
| Y | M层比K层少一个电子 |
| Z | 有三个电子层,M层上有3个电子 |
(1)T是
(2)Y与Z相比,金属性较强的是
A.Y单质的熔点比Z单质的低
B.Y的化合价比Z的低
C.Y单质与水反应比Z单质与水反应剧烈得多
(3)Z的最高价氧化物属于
Ⅱ.2SO2(g)+O2(g)
 2SO3(g)反应过程的能量变化如图所示。
2SO3(g)反应过程的能量变化如图所示。
已知1mol SO2(g)氧化为1mol SO3的ΔH=-99kJ·mol-1.请回答下列问题:
(4)图中A、C分别表示
(5)图中△H=
(6)已知单质硫的燃烧热为296KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H
您最近一年使用:0次
名校
解题方法
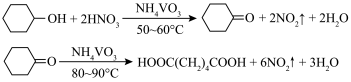
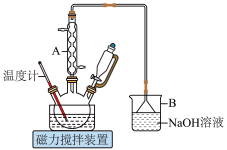
2 . 1,6己二酸是常用的化工原料,在高分子材料、医药、润滑剂的制造等方面都有重要作用。实验室利用图中的装置(夹持装置已省略),以环己醇和硝酸为反应物制备1,6己二酸。反应原理为:
实验步骤如下:
Ⅰ.向三颈烧瓶中加入0.03 g NH4VO3固体和18 mL浓HNO3(略过量),向恒压滴液漏斗中加入6 mL环己醇
Ⅱ.将三颈烧瓶放入水浴中,电磁搅拌并加热至50℃。移去水浴,打开恒压滴液漏斗活塞滴加5~6滴环己醇,观察到三颈烧瓶中产生红棕色气体时,开始慢慢加入余下的环己醇。调节滴加环己醇的速度,使三颈烧瓶内温度维持在50~60 ℃之间,直至环己醇全部滴加完毕
Ⅲ.将三颈烧瓶放入80~90 ℃水浴中加热10 min,至几乎无红棕色气体导出为止。然后迅速将三颈烧瓶中混合液倒入100 mL烧杯中,冷却至室温后,有白色晶体析出,减压过滤,___________,干燥,得到粗产品
Ⅳ.1,6-己二酸粗产品的提纯
(1)仪器A的名称为___________ ,其作用是___________ 。
(2)B中发生反应的离子方程式为___________ (其中一种产物为亚硝酸盐)
(3)若步骤Ⅱ中控制水浴温度不当,未滴加环己醇前就会观察到红棕色气体生成,原因为___________ ,滴加环己醇的过程中,若温度过高,可用冷水浴冷却维持50~60 ℃,说明该反应的ΔH___________ 0(填“>”或“<”)。
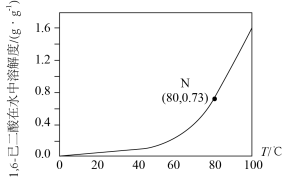
(4)将步骤Ⅲ补充完整:___________ 。步骤Ⅳ提纯方法的名称为___________ 。如图为1,6己二酸在水中的溶解度曲线,80 ℃时1,6-己二酸水溶液的密度为ρ g·mL-1;该溶液的物质的量浓度为___________ 。
| 试剂 | 相对分子质量 | 密度/(g·mL-1) | 熔点/℃ | 沸点/℃ | 溶解性 |
| 环己醇 | 100 | 0.962 | 25.9 | 161.8 | 可溶于水、乙醇、乙醚 |
| 1,6-己二酸 | 146 | 1.360 | 152 | 330.5 | 微溶于冷水,易溶于乙醇 |
| NH4VO3 | 117 | 2.326 | 210(分解) | — | 微溶于冷水,易溶于热水 |
Ⅰ.向三颈烧瓶中加入0.03 g NH4VO3固体和18 mL浓HNO3(略过量),向恒压滴液漏斗中加入6 mL环己醇
Ⅱ.将三颈烧瓶放入水浴中,电磁搅拌并加热至50℃。移去水浴,打开恒压滴液漏斗活塞滴加5~6滴环己醇,观察到三颈烧瓶中产生红棕色气体时,开始慢慢加入余下的环己醇。调节滴加环己醇的速度,使三颈烧瓶内温度维持在50~60 ℃之间,直至环己醇全部滴加完毕
Ⅲ.将三颈烧瓶放入80~90 ℃水浴中加热10 min,至几乎无红棕色气体导出为止。然后迅速将三颈烧瓶中混合液倒入100 mL烧杯中,冷却至室温后,有白色晶体析出,减压过滤,___________,干燥,得到粗产品
Ⅳ.1,6-己二酸粗产品的提纯
(1)仪器A的名称为
(2)B中发生反应的离子方程式为
(3)若步骤Ⅱ中控制水浴温度不当,未滴加环己醇前就会观察到红棕色气体生成,原因为
(4)将步骤Ⅲ补充完整:
| A.46.07% | B.57.08% | C.63.03% | D.74.61% |
您最近一年使用:0次
2024-02-29更新
|
325次组卷
|
8卷引用:东北三省三校(哈师大附中、东北师大附中、辽宁省实验中学)2021届高三第一次联合模拟考试(3月)理综化学试题
东北三省三校(哈师大附中、东北师大附中、辽宁省实验中学)2021届高三第一次联合模拟考试(3月)理综化学试题(已下线)重点7 化学实验综合题-2021年高考化学【热点·重点·难点】专练(山东专用)(已下线)押山东卷第20题 化学实验综合题-备战2021年高考化学临考题号押题(山东卷)(已下线)3.5.2 有机合成路线的设计与实施-2021-2022学年高二化学课后培优练(人教版2019选择性必修3)(已下线)05 以分离提纯为主线的有机制备类综合实验 (解析)-备战2023年高考化学大题逐空突破系列(全国通用)(已下线)题型三 以分离提纯为主的有机制备类实验-备战2024年高考化学答题技巧与模板构建河南省南阳市邓州市第六高级中学校2023-2024学年高二下学期开学测试化学试题四川省成都市第七中学林荫校区2023-2024学年高三下学期4月月考理科综合试卷-高中化学
解题方法
3 . 碳、氮的单质及其化合物在生产和生活中有广泛应用。
(1)已知在298K时,C(石墨)完全燃烧的热化学方程式:C(石墨)+O2(g)=CO2(g) ∆H=-393.5kJ·mol-1。该反应属于___________ (填“放热”或“吸热”)反应。
(2)—定条件下,在某密闭容器中进行反应:N2(g)+3H2(g)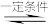 2NH3(g) ∆H<O。
2NH3(g) ∆H<O。
①若N2(g)的起始浓度为1mol-1•L-1,H2(g)的起始浓度为3mol•L-1,反应进行到2min时,测得H2(g)浓度为2mol•L-1,测2min内v(H2)=___________ mol•L-1•min•L-1。
②当反应达到平衡时,若只升高温度,则平衡向___________ (填“正反应”或“逆反应”)方向移动。
③当反应达到平衡时,若只增大压强,则化学平衡常数K___________ (填"增大”“减小”或“不变”)。
(3)常温下,往0.1mol•L-1NH4Cl溶液中滴入紫色石蕊试液后,溶液变红色,则该溶液pH___________ 7(填“〉”或“<”);c( )
)___________ c(Cl-)(填“〉”或“<”)。
(4)如图所示实验,用石墨电极电解饱和食盐水:2NaCl+2H2O 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
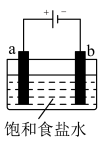
①a电极是电解池的___________ (填“阳极”或“阴极”)。
②溶液中H+向___________ (填“a”或“b”)电极移动。
③生成Cl2的电极反应式:___________ 。
(1)已知在298K时,C(石墨)完全燃烧的热化学方程式:C(石墨)+O2(g)=CO2(g) ∆H=-393.5kJ·mol-1。该反应属于
(2)—定条件下,在某密闭容器中进行反应:N2(g)+3H2(g)
 2NH3(g) ∆H<O。
2NH3(g) ∆H<O。①若N2(g)的起始浓度为1mol-1•L-1,H2(g)的起始浓度为3mol•L-1,反应进行到2min时,测得H2(g)浓度为2mol•L-1,测2min内v(H2)=
②当反应达到平衡时,若只升高温度,则平衡向
③当反应达到平衡时,若只增大压强,则化学平衡常数K
(3)常温下,往0.1mol•L-1NH4Cl溶液中滴入紫色石蕊试液后,溶液变红色,则该溶液pH
 )
)(4)如图所示实验,用石墨电极电解饱和食盐水:2NaCl+2H2O
 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
①a电极是电解池的
②溶液中H+向
③生成Cl2的电极反应式:
您最近一年使用:0次
名校
4 . 依据相关知识回答下列问题:
Ⅰ.键能是指在25 ℃、101 kPa,将1 mol理想气体分子AB拆开为中性气态原子A和B时所需要的能量。显然键能越大,化学键越牢固,含有该键的分子越稳定。
(1)已知键能:H-H键为436 kJ•mol-1;H-F键为565 kJ•mol-1;H-Cl键为431 kJ•mol-1;H-Br键为366 kJ•mol-1。则下列分子受热时最稳定的是_______。
(2)能用键能大小解释的是_______。
(3)已知:H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,生成lmol NH3过程中放出46kJ的热量。则N≡N的键能为_______ kJ/mol。
Ⅱ.CO与H2反应可制备CH3OH,由CH3OH和O2构成的质子交换膜燃料电池的结构示意图如下。
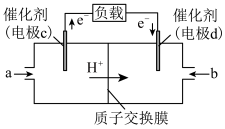
(4)电池总反应为2CH3OH+3O2=2CO2+4H2O,则c电极是_______ (填“正极”或“负极”),c电极的电极反应式为_______ 。若外电路中转移2 mol电子,则上述燃料电池所消耗的O2在标准状况下的体积为_______ L。
(5)下列反应中,属于吸热反应的是_______ (填序号)
①物质燃烧 ②炸药爆炸 ③酸碱中和反应 ④二氧化碳通过炽热的碳 ⑤食物因氧化而腐败 ⑥Ba(OH)2•8H2O与NH4Cl反应 ⑦铁粉与稀盐酸反应
Ⅰ.键能是指在25 ℃、101 kPa,将1 mol理想气体分子AB拆开为中性气态原子A和B时所需要的能量。显然键能越大,化学键越牢固,含有该键的分子越稳定。
(1)已知键能:H-H键为436 kJ•mol-1;H-F键为565 kJ•mol-1;H-Cl键为431 kJ•mol-1;H-Br键为366 kJ•mol-1。则下列分子受热时最稳定的是_______。
| A.HF | B.HCl | C.HBr | D.H2 |
| A.氮气的化学性质比氧气稳定 | B.常温常压下溴呈液态,碘呈固态 |
| C.稀有气体一般很难发生化学反应 | D.硝酸易挥发而硫酸难挥发 |
Ⅱ.CO与H2反应可制备CH3OH,由CH3OH和O2构成的质子交换膜燃料电池的结构示意图如下。

(4)电池总反应为2CH3OH+3O2=2CO2+4H2O,则c电极是
(5)下列反应中,属于吸热反应的是
①物质燃烧 ②炸药爆炸 ③酸碱中和反应 ④二氧化碳通过炽热的碳 ⑤食物因氧化而腐败 ⑥Ba(OH)2•8H2O与NH4Cl反应 ⑦铁粉与稀盐酸反应
您最近一年使用:0次
5 . 锂电池有广阔的应用前景。用“循环电沉积”法处理某种锂电池,可使其中的Li电极表面生成只允许 通过的
通过的 和C保护层,工作原理如图1,具体操作如下。
和C保护层,工作原理如图1,具体操作如下。
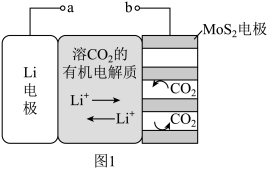
i.将表面洁净的Li电极和 电极浸在溶有
电极浸在溶有 的有机电解质溶液中。
的有机电解质溶液中。
ii.0-5min,a端连接电源正极,b端连接电源负极,电解, 电极上生成
电极上生成 和C。
和C。
iii.5-10min,a端连接电源负极,b端连接电源正极,电解, 电极上消耗
电极上消耗 和C,Li电极上生成
和C,Li电极上生成 和C,步骤ⅱ和步骤iii为1个电沉积循环。
和C,步骤ⅱ和步骤iii为1个电沉积循环。
iv.重复步骤ⅱ和步骤ⅲ的操作,继续完成9个电沉积循环。
(1)步骤ii内电路中的 由
由_______ 向_______ 迁移(填“Li电极”或“ 电极”)。
电极”)。
(2)已知下列反应的热化学方程式。
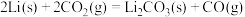


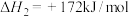
步骤ⅱ电解总反应的热化学方程式为_______ 。
(3)步骤ⅲ中,Li电极的电极反应式为_______ 。
(4) 和C只有在
和C只有在 的催化作用下才能发生步骤ⅲ的电极反应,反应历程中的能量变化如下图。下列说法正确的是
的催化作用下才能发生步骤ⅲ的电极反应,反应历程中的能量变化如下图。下列说法正确的是_______ (填字母序号)。
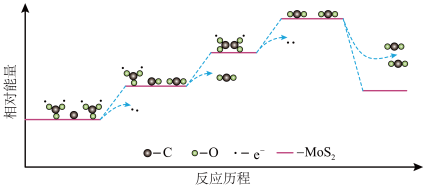
a.反应历程中存在碳氧键的断裂和形成
b.反应历程中涉及电子转移的变化均释放能量
c. 催化剂通过降低电极反应的活化能使反应速率加快
催化剂通过降低电极反应的活化能使反应速率加快
 通过的
通过的 和C保护层,工作原理如图1,具体操作如下。
和C保护层,工作原理如图1,具体操作如下。
i.将表面洁净的Li电极和
 电极浸在溶有
电极浸在溶有 的有机电解质溶液中。
的有机电解质溶液中。ii.0-5min,a端连接电源正极,b端连接电源负极,电解,
 电极上生成
电极上生成 和C。
和C。iii.5-10min,a端连接电源负极,b端连接电源正极,电解,
 电极上消耗
电极上消耗 和C,Li电极上生成
和C,Li电极上生成 和C,步骤ⅱ和步骤iii为1个电沉积循环。
和C,步骤ⅱ和步骤iii为1个电沉积循环。iv.重复步骤ⅱ和步骤ⅲ的操作,继续完成9个电沉积循环。
(1)步骤ii内电路中的
 由
由 电极”)。
电极”)。(2)已知下列反应的热化学方程式。
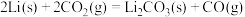


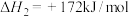
步骤ⅱ电解总反应的热化学方程式为
(3)步骤ⅲ中,Li电极的电极反应式为
(4)
 和C只有在
和C只有在 的催化作用下才能发生步骤ⅲ的电极反应,反应历程中的能量变化如下图。下列说法正确的是
的催化作用下才能发生步骤ⅲ的电极反应,反应历程中的能量变化如下图。下列说法正确的是
a.反应历程中存在碳氧键的断裂和形成
b.反应历程中涉及电子转移的变化均释放能量
c.
 催化剂通过降低电极反应的活化能使反应速率加快
催化剂通过降低电极反应的活化能使反应速率加快
您最近一年使用:0次
解题方法
6 . 到目前为止,由化学能转变的热能或电能仍然是人类使用的主要能源。
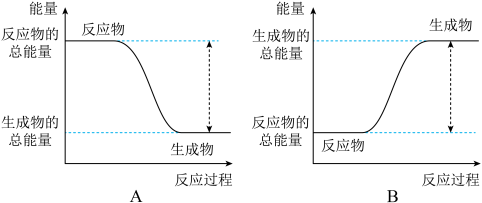
(1)从能量变化角度研究反应: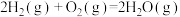 。下图能正确表示该反应中能量变化的是
。下图能正确表示该反应中能量变化的是___________ (填字母)。
(2)从断键和成键角度分析上述反应中能量的变化。部分化学键的键能如下表:
则生成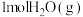 放出热量
放出热量___________ kJ。
(3)将Z棒和Cu棒用导线连接后,放入某电解质溶液中,构成如图所示装置。
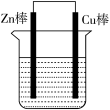
①若电解质溶液为稀硫酸,则Zn棒为原电池的___________ (填“正”或“负”)极,可观察到Cu棒上有气泡生成,写出Cu棒上的电极反应式___________ 。若反应过程中Zn棒减少的质量为3.25g,则生成的氢气在标准状况下的体积为___________ L。
②若电解质为硫酸铜溶液,则Cu棒上发生___________ (填“氧化”或“还原”)反应,Zn棒上发生的电极反应式为___________ 。
(1)从能量变化角度研究反应:
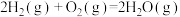 。下图能正确表示该反应中能量变化的是
。下图能正确表示该反应中能量变化的是
(2)从断键和成键角度分析上述反应中能量的变化。部分化学键的键能如下表:
| 化学键 |  |  |  |
| 键能(kJ/mol) | 436 | 496 | 463 |
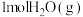 放出热量
放出热量(3)将Z棒和Cu棒用导线连接后,放入某电解质溶液中,构成如图所示装置。

①若电解质溶液为稀硫酸,则Zn棒为原电池的
②若电解质为硫酸铜溶液,则Cu棒上发生
您最近一年使用:0次
2023-03-12更新
|
756次组卷
|
2卷引用:陕西省汉中市2020-2021学年高一下学期期中联考化学试卷
名校
解题方法
7 . 实验室利用下列装置模拟工业生产制备少量硝酸。
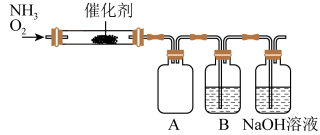
(1)实验结束时,两种反应气体中需要再持续通入_______ (填化学式)一段时间。
(2)B中反应的化学方程式为_______ 。
(3)实验时先用酒精喷灯预热催化剂,然后通入反应气体,当催化剂红热后撤离酒精喷灯,催化剂始终保持红热,温度可达到700℃以上。下列图示中,能够正确表示该反应过程能量变化的是_______
(4)已知:①2H2(g)+O2(g)=2H2O(1) △H=-571.5kJ/mol
②N2(g)+2O2(g)=2NO2(g) △H=+68.0kJ/mol
③N2(g)+3H2(g)=2NH3(g) △H=-92.5kJ/mol
则:8NH3(g)+6NO2(g)=7N2(g)+12H2O(l) △H=_______ kJ/mol
(5)控制氨气和氧气的比例是制备硝酸的关键。
①当比例不合适时,A中不仅有红棕色气体产生,还伴有白烟。白烟是_______ (填化学式)。
②理论上使氨气完全转化为硝酸,则NH3与O2(相同条件下)的体积比应满足V(NH3):V(O2)_____ 。

(1)实验结束时,两种反应气体中需要再持续通入
(2)B中反应的化学方程式为
(3)实验时先用酒精喷灯预热催化剂,然后通入反应气体,当催化剂红热后撤离酒精喷灯,催化剂始终保持红热,温度可达到700℃以上。下列图示中,能够正确表示该反应过程能量变化的是_______
A.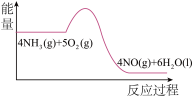 | B.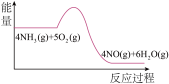 | C.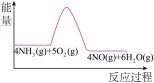 | D.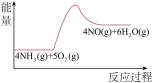 |
②N2(g)+2O2(g)=2NO2(g) △H=+68.0kJ/mol
③N2(g)+3H2(g)=2NH3(g) △H=-92.5kJ/mol
则:8NH3(g)+6NO2(g)=7N2(g)+12H2O(l) △H=
(5)控制氨气和氧气的比例是制备硝酸的关键。
①当比例不合适时,A中不仅有红棕色气体产生,还伴有白烟。白烟是
②理论上使氨气完全转化为硝酸,则NH3与O2(相同条件下)的体积比应满足V(NH3):V(O2)
您最近一年使用:0次
解题方法
8 . 能源是现代文明的原动力,通过化学方法可以使能量按人们所期望的形式转化,从而开辟新能源和提高能源的利用率,请回答下列问题。
(1)①工业合成氨反应:N2+3H2 2NH3是放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知1molN2完全反应生成NH3可放出92kJ热量。如果将10molN2和足量H2混合,使其充分反应,放出的热量
2NH3是放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知1molN2完全反应生成NH3可放出92kJ热量。如果将10molN2和足量H2混合,使其充分反应,放出的热量_______ (填“大于”、“小于”或“等于”)920kJ。
②已知拆开1 mol H-H键、1 mol N-H键、1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为_______ 。
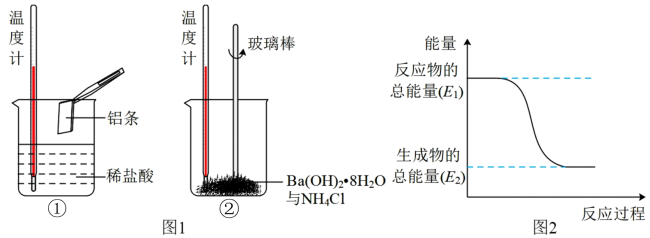
(2)某实验小组同学进行如图1所示实验,以检验化学反应中的能量变化。请根据你掌握的反应原理判断,②中的温度_______ (填“升高”或“降低”)。反应过程_______ (填“①”或“②”)的能量变化可用图2表示。
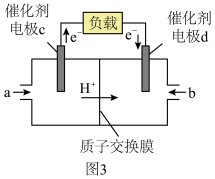
(3)用CH3OH和O2组合形成的质子交换膜燃料电池的结构如图3所示,则d电极是_______ (填“正极”或“负极”),d电极的电极反应式为_______ 。
(1)①工业合成氨反应:N2+3H2
 2NH3是放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知1molN2完全反应生成NH3可放出92kJ热量。如果将10molN2和足量H2混合,使其充分反应,放出的热量
2NH3是放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知1molN2完全反应生成NH3可放出92kJ热量。如果将10molN2和足量H2混合,使其充分反应,放出的热量②已知拆开1 mol H-H键、1 mol N-H键、1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为
(2)某实验小组同学进行如图1所示实验,以检验化学反应中的能量变化。请根据你掌握的反应原理判断,②中的温度

(3)用CH3OH和O2组合形成的质子交换膜燃料电池的结构如图3所示,则d电极是

您最近一年使用:0次
解题方法
9 . 利用反应A可将释放的CO2转化为具有工业利用价值的产品。
反应A:CO2+H2O CO+H2+O2
CO+H2+O2
已知:
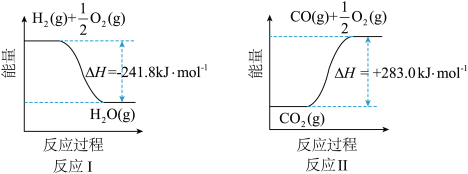
(1)反应Ⅱ是___________ 反应(填“吸热”或“放热”),其原因是___________ 。
(2)反应A的热化学方程式是___________ 。反应A的平衡常数表达式为___________ 。
反应A:CO2+H2O
 CO+H2+O2
CO+H2+O2已知:

(1)反应Ⅱ是
(2)反应A的热化学方程式是
您最近一年使用:0次
解题方法
10 . 在化学反应中,只有能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示。请认真观察图象,然后回答问题:
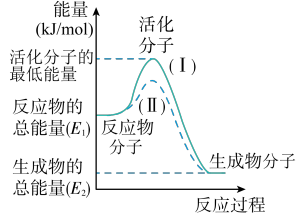
(1)图中所示反应是_______ (填“吸热”或“放热”)反应,该反应的ΔH=_______ (用含E1、E2的代数式表示);
(2)对于同一反应,图中虚线(II)与实线(I)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,你认为最可能的原因是_______ 。
(3)已知红磷比白磷稳定,则反应:
P4(白磷,s)+5O2(g)=2P2O5(s) ΔH1;
4P(红磷,s)+5O2(g)=2P2O5(s) ΔH2;
ΔH1和ΔH2的关系是ΔH1_______ ΔH2(填“>”“<”或“=”)。
(4)在25℃、101kPa时,已知:
2H2O(g)=O2(g)+2H2(g) ΔH1
Cl2(g)+H2(g)=2HCl(g) ΔH2
2Cl2(g)+2H2O(g)=4HCl(g)+O2(g) ΔH3
则ΔH3与ΔH1和ΔH2之间的关系正确的是_______。

(1)图中所示反应是
(2)对于同一反应,图中虚线(II)与实线(I)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,你认为最可能的原因是
(3)已知红磷比白磷稳定,则反应:
P4(白磷,s)+5O2(g)=2P2O5(s) ΔH1;
4P(红磷,s)+5O2(g)=2P2O5(s) ΔH2;
ΔH1和ΔH2的关系是ΔH1
(4)在25℃、101kPa时,已知:
2H2O(g)=O2(g)+2H2(g) ΔH1
Cl2(g)+H2(g)=2HCl(g) ΔH2
2Cl2(g)+2H2O(g)=4HCl(g)+O2(g) ΔH3
则ΔH3与ΔH1和ΔH2之间的关系正确的是_______。
| A.ΔH3=ΔH1+2ΔH2 | B.ΔH3=ΔH1+ΔH2 |
| C.ΔH3=ΔH1-2ΔH2 | D.ΔH3=ΔH1-ΔH2 |
您最近一年使用:0次



